Biochemia piwa obejmuje przemiany chemiczne w produkcji i starzeniu się piwa, przebiegające z udziałem enzymów wytworzonych przez organizmy. Szczególne znaczenie w tych przemianach ma działalność drożdży piwowarskich oraz enzymy słodu.
W artykule przedstawiono związki chemiczne wpływające na cechy sensoryczne współczesnego piwa oraz biochemiczne aspekty ich przemian.
W piwie występuje ponad 800 związków, które tworzą jego smak i aromat[1]. Podstawowymi składnikami piwa są woda, etanol oraz węglowodany. Wiele substancji silnie wpływających na cechy sensoryczne piwa występuje jedynie w śladowych ilościach. Mają one jednak kluczowe znaczenie dla jego ogólnej jakości z powodu niskich progów wyczuwalności[2]. Związki te wykazują również liczne interakcje między sobą. Można wyróżnić efekt synergistyczny, kiedy jeden związek wzmaga percepcję drugiego, oraz antagonistyczny, kiedy jeden związek zmniejsza percepcję drugiego[3]. Złożoność składu piwa, liczne interakcje oraz znaczenie nawet subtelnych różnic w stężeniu różnych związków powoduje spore trudności w uzyskaniu założonego profilu sensorycznego gotowego piwa.
Rys historyczny
Z historycznego punktu widzenia piwo to fermentowany napój wytworzony ze zbóż. Współcześnie termin piwo jest zawężony do chmielonego napoju uzyskanego z upłynnionej skrobi, który uległ fermentacji specyficznymi szczepami drożdży Saccharomyces[4].
Wiedzę na temat piwa produkowanego przed wiekami pozyskuje się na podstawie archeologicznych artefaktów i pisanych dokumentów[4]. W przeciwieństwie jednak do wina istnieje niewiele chemicznych znalezisk archeologicznych potwierdzających obecność piwa w neolitycznej Mezopotamii. Obecność piwa w dawnych naczyniach można stwierdzić przez wykrycie szczawianów, głównie szczawianów wapnia, które są głównym składnikiem gromadzącego się osadu z piwa, tzw. „kamienia piwnego”[5].
Trudności nastręcza również interpretacja starych dokumentów. Współcześnie w procesie produkcji piwa wyróżnia się trzy główne etapy: słodowanie (kiełkowanie zboża i suszenie), zacieranie (enzymatyczny rozkład naturalnych polimerów) i fermentację (mikrobiologiczną transformację różnych związków). Niekoniecznie na takiej koncepcji opierała się produkcja piwa przed wiekami, co może prowadzić do nieporozumień. Kolejną trudnością jest fakt, że dawne terminy etymologicznie związane z piwem (np. staroangielskie „beor”) nie zawsze były używane w kontekście napojów opartych na zbożu; mogły również oznaczać np. miód pitny bądź fermentowane soki owocowe[4].
Historyczne dodatki roślinne

Od tysięcy lat różne zioła były dodawane do piwa w celu nadania aromatu i wydłużenia trwałości[6]. Mieszanka ziół do produkcji piwa w północno-zachodniej Europie i Skandynawii nosiła nazwę gruit lub grut[7]. Pierwszy raz słowo gruit w zapiskach pojawia się w 999[7][8]. Cesarz Otton III używa go w podwójnym znaczeniu – zarówno jako składnik do produkcji piwa, jak i nazwa prawa do jego produkcji, bowiem od 811 wraz z edyktem Capitulare de villis Karola Wielkiego prawo to zostało ograniczone (poza produkcją na użytek własny). Najprawdopodobniej gruit wnosił do piwa również drożdże i początkowo mógł przypominać chleb[4]. Gruit kupowało się u lokalnych władz miasta lub biskupów. Stanowiło to wczesną formę opodatkowania piwa[4]. Przykładowo w miejscowości Dordrecht piwowarzy musieli udawać się do specjalnego budynku ze swoim słodem, aby domieszano do niego gruit[7]. Kościół przestał pobierać za niego opłaty w XV w.[9]
Skład mieszanki ziół różnił się w zależności od regionu, jednak kluczowym składnikiem była woskownica europejska[9]. Poza tym mogła zawierać m.in. kolendrę, krwawnik pospolity i chmiel[4], a nawet rośliny zawierające substancje psychoaktywne[4][7].
Z czasem wytworzyła się duża konkurencja między piwem z dodatkiem woskownicy a piwem z dodatkiem chmielu[10]. W literaturze spotyka się wiele sprzecznych informacji odnośnie do pierwszego użycia chmielu w piwie[6]. Pierwsza wzmianka o dodaniu chmielu do piwa pochodzi z 822, kiedy opat Adelhar z Korbei wydał instrukcje dla swojego klasztoru Consuetudines Corbeienses[4]. W Polsce, krajach Bałtyckich i w Rosji chmiel zaczął dominować już XIII w.[9]; w północno-zachodniej Europie popularność woskownicy stopniowo zmniejszała się od XIV w. (poza Wyspami Brytyjskimi, gdzie jej popularność nie spadała) aż w XVIII w. powszechnie przeważał chmiel[8][10]. Do zaniku użycia woskownicy przyczyniły się pogłoski, że jest trująca, choć współczesne badania temu zaprzeczają[8].
Drożdże
Niegdyś nie zdawano sobie sprawy z udziału drożdży w produkcji piwa. Do XV-XVI w. brzeczka po gotowaniu była infekowana przez drożdże zawieszone w powietrzu. Metoda ta była bardzo zawodna i niosła duże ryzyko infekcji przez niepożądane mikroorganizmy[11]. Pierwsza wzmianka o udziale drożdży z powietrza w produkcji piwa pochodzi z 1551 z Monachium[8][11], choć najprawdopodobniej już przed 1300 browarnicy używali części piany fermentującego piwa, by rozpocząć fermentację kolejnego. Następnie browarnicy zaczęli hodować drożdże osobno i dodawać je później do brzeczki. Problematyczne były jednak infekcje i nadmierna temperatura, zwłaszcza latem[11].
Czasami suszono osad z beczki po piwie zawierający drożdże i mieszano to z mąką, aby wyrobić ciasto, które po dodaniu wody mogło rozpocząć fermentację. Osad zamiast suszenia mógł zostać też dodany bezpośrednio do nowej brzeczki, podobnie w przypadku gotowego piwa czy chleba. Poza tym, na skutek niedokładnego czyszczenia naczyń o chropowatej powierzchni, zawsze znajdowały się na nich jakieś komórki drożdży. Użycie czystych kultur drożdży, a przez to pewna kontrola tego procesu stała się możliwa dopiero pod koniec XIX w[11]. Jako pierwszy czysty szczep drożdży wyizolował w 1883 Emil Christian Hansen, nazywając go Saccharomyces carlsbergensis[12].
Do XVI w. w całej Europie do produkcji piwa typowo używano drożdży górnej fermentacji[11][12]. Fermentacja dolna pojawiła się po raz pierwszy prawdopodobnie w bawarskich klasztorach, a pierwsze wzmianki o niej pochodzą z XV w. Bawarczycy zauważyli, że jakość piwa wyprodukowanego w porze letniej jest znacznie niższa, piwo jest bardzo podatne na infekcje, kwaśnienie, dlatego w 1533 książę Maksymilian I Bawarski zakazał warzenia piwa w okresie od 23 kwietnia do 29 września bez specjalnego zezwolenia[12]. W związku z produkcją piwa w niższych temperaturach wyselekcjonowany został szczep drożdży, który lepiej radził sobie z fermentacją w takich warunkach i miał tendencję do opadania na dno naczynia[13]. Ze względu na letnią przerwę należało wyprodukować więcej piwa i przechowywać je aż do kolejnej jesieni, stąd nazywano je „lager” (z niem. skład, magazyn)[12]. Piwo charakteryzowało się trwałością, a do tego wyróżniało się swoim smakiem na tle innych piw w tym czasie[4].
W XIX w. pojawiły się nowe technologie i możliwości. Chłodzenie brzeczki, kadzie fermentacyjne, zbiorniki do leżakowania, dostępność naturalnego lodu do chłodzenia piwa w podziemnych piwnicach sprawiły, że w 1850 zniesiono zakaz warzenia w lecie. Pojawienie się lodówki w 1875 umożliwiło produkcję lagerów wszędzie i niezależnie od pory roku. Piwa dolnej fermentacji stawały się coraz bardziej popularne i zaczęły wypierać piwa górnej fermentacji. Nowe style piw stawały się modne, zwłaszcza pilzner opracowany przez Josefa Grolla w 1842[4].
Istotne odkrycia naukowe
W 1762 Michael Combrune opublikował Essay on Brewing, w którym podkreślał konieczność używania termometru podczas warzenia i słodowania. Do odkrycia mechanizmów procesu fermentacji przyczynili się Antoine Lavoisier (1789) i Joseph Gay-Lussac (1815), dzięki którym zostało ustalone chemiczne równanie utleniania glukozy do CO
2 i etanolu[4]. W 1833 Anselme Payen odkrył i wyizolował pierwszy enzym – diastazę[14]. W 1835 Szwed Jöns Jacob Berzelius sformułował zasady katalizy, a Justus von Liebig zastosował je do fermentacji cukrów, uzyskując jej dość dokładny opis. W 1837 trzech naukowców Charles Cagniard de la Tour, Friedrich Traugott Kützing i Theodor Schwann niezależnie odkryli, że drożdże są organizmami żywymi. Karl Josef Napoleon Balling w 1843 opracował niezawodną metodę pomiaru i kontroli przemiany cukrów z brzeczki w etanol podczas fermentacji. Ostatecznie Louis Pasteur w latach 1855–1875 ustalił jednoznacznie rolę drożdży w fermentacji alkoholowej, jej fizjologiczne aspekty i różnice między metabolizmem tlenowym a beztlenowym[4].
Choć istnieje sporo źródeł sprzed połowy XIX w. o warzeniu piwa, możliwość wykorzystania tych wskazówek przez innych była ograniczona, ponieważ brakowało bardzo istotnych informacji jak cechy sprzętu użytego do produkcji czy wiarygodnych pomiarów. Naukowe teorie dotyczące tych procesów mogły powstać dopiero po wprowadzeniu do piwowarstwa termometrów, cukromierzy, jednolitych miar i porównywalnego sprzętu[4].
Woda
Nowoczesne browary zużywają od ok. 2 l[15] do 5,7 l wody na wyprodukowanie 1 l piwa. Woda służąca bezpośrednio jako surowiec w produkcji piwa (średnio ok. 2 l na 1 l gotowego piwa)[16] stanowi ok. 90% jego składu[15] i musi odpowiadać nie tylko jakości wody pitnej, ale i spełniać dodatkowe wymagania. Związane są one z procesem technologicznym i pożądaną jakością piwa[16].
Sole rozpuszczone w wodzie
Do najważniejszych parametrów wody w piwowarstwie należy twardość i alkaliczność resztkowa. Niewęglanowa (trwała) twardość wody jest limitowana pożądanym stężeniem związków wapnia. Nie wpływa na nią gotowanie, bo wapń występuje w formie soli mocnych kwasów jak chlorek wapnia czy siarczan wapnia[17]. Natomiast twardość węglanowa (przemijająca) tworzona przez wodorowęglan wapnia Ca(HCO
3)
2 obniża się podczas gotowania – Ca(HCO
3)
2 rozpada się, tworząc nierozpuszczalny węglan wapnia[17]. Jony wodorowęglanowe podwyższają jednak pH[18], co wywiera wpływ na procesy enzymatyczne i zjawiska koloidalne – tworzy niekorzystne mętnienie[15]. Tymczasem w produkcji piwa pożądane jest osiągnięcie niskiego pH w zacierze i brzeczce (ok. 5,5) dla lepszej aktywności enzymów i osiągnięcia większej wydajności[16]. Poza tym wyższe pH może prowadzić do większego wyługowania garbników i substancji goryczkowych z łuski słodu, co może nadawać piwu cierpką, nieprzyjemną goryczkę[15].
Dla określenia dopuszczalnych właściwości alkalizujących wody w piwowarstwie stosuje się parametr alkaliczności resztkowej. Stanowi ona różnicę między właściwościami alkalizującymi anionów wodorowęglanowych HCO−
3 a właściwościami zakwaszających kationów[15] (głównie wapnia i magnezu, które reagując z fosforanami wypłukiwanymi ze słodu, wyzwalają protony[17]). Alkaliczność resztkową można wyrazić wzorem:
– alkaliczność resztkowa w °n (stopniach niemieckich)
– zasadowość ogólna w °n
– twardość wapniowa w °n
– twardość magnezowa w °n
i – współczynniki pozwalające na uwzględnienie mniejszych właściwości zakwaszających kationów Ca2+
i Mg2+
w stosunku do właściwości alkalizujących HCO−
3[15].
Większa alkaliczność resztkowa oznacza wyższy odczyn pH zacieru i brzeczki. W zacierze wyższa wartość pH może dodatkowo wiązać się z wydłużeniem procesu filtrowania[15].
Zmiękczanie wody do produkcji piwa polega przede wszystkim na dekarbonizacji. Najczęściej stosuje się w tym celu: dekarbonizację wapniową (dodanie Ca(OH)
2 i tworzenie nierozpuszczalnego CaCO
3), technologię jonitową, technologię membranową (odwrócona osmoza, nanofiltracja), filtracja (węgiel aktywny, filtry odżelaziające)[16]. W dawnych czasach, kiedy nie znano metod uzdatniania wody, twardość wody występującej w danym regionie wpływała na charakter okolicznego piwa. Piwowarzy warzący piwo pilzneńskie dysponowali bardzo miękką wodą, do piwa monachijskiego używana była twarda woda, a w przypadku piwa dortmundzkiego – bardzo twarda[19].
Na ogół do produkcji jasnych lagerów najlepiej sprawdza się miękka woda, podczas gdy do ciemnych ale, np. stoutów najlepsza jest woda twardsza[20]. Większa alkaliczność służy takim piwom ze względu na to, że ciemne, prażone słody wprowadzają generalnie kwasowość, którą ona równoważy, a poza tym zapewnia ona lepszą ekstrakcję związków barwiących i aromatycznych[17]. Zaleca się, aby alkaliczność resztkowa wody do zacierania słodu nie przekraczała 2 °n dla pilznera, 5 °n dla innych jasnych piw i 10 °n dla piw ciemnych[18].
Woda zawierająca jony żelaza jest niekorzystna do produkcji piwa ze względu na udział w tworzeniu szlamów, zmętnień, przyczynianie się do ciemnienia brzeczki i piwa, hamowanie aktywności drożdży i nadawanie metalicznego posmaku. Jony miedzi są toksyczne i mutagenne dla drożdży, ale odkąd kadzie i systemy rur wykonuje się z nierdzewnej stali, rzadko spotyka się związane z nimi problemy. Mangan może mieć niekorzystny wpływ na smak i stabilność koloidalną piwa (sprzyja zmętnieniom). Jednakże śladowe ilości zarówno manganu, jak i żelaza oraz miedzi są potrzebne dla prawidłowej aktywności drożdży[21].
Jony siarczanowe SO2−
4 przyczyniają się do nadawania piwu bardziej wytrawnego, gorzkiego smaku, który powinien być zrównoważony odpowiednią ilością jonów chlorkowych. Poza tym drożdże potrafią przyswajać siarczany i tworzyć aromaty siarkowe, m.in.H
2S i SO
2. Jony chlorkowe Cl−
poprawiają klarowanie się piwa i jego stabilność koloidalną, biorą udział w nadawaniu treściwości piwu. Stosunek ich stężenia do stężenia siarczanów ma wpływ na odczucie goryczki piwa. Stężenie Cl−
nie powinno przekraczać 150 mg/l. Azotany (NO−
3) są niepożądanymi anionami; ich ilość w wodzie pitnej nie powinna przekraczać 50 mg/l, jednak w wodzie do produkcji piwa ich stężenie powinno być jeszcze niższe ze względu na to, że pewne ilości wprowadzane są również z chmielem. Mogą się przekształcać w piwie do azotynów (NO−
2), które są toksyczne dla drożdży[21].
Stabilność mikrobiologiczna
Mikroorganizmy patogenne dla człowieka nie są w stanie przetrwać w piwie z wielu powodów: piwo zawiera etanol (zwykle 3,5–5% objętościowo), substancje goryczkowe z chmielu, niskie pH (3,4–4,8), niewielką ilość tlenu (poniżej 0,1 ppm), podwyższoną zawartość CO
2, niedobór substancji odżywczych dla mikroorganizmów, a kolejną barierą może być ewentualna refermentacja w butelce. Poza tym wiele etapów produkcji piwa zmniejsza ryzyko zakażenia, np. gotowanie brzeczki, pasteryzacja, filtracja, aseptyczny rozlew[22]. Mimo to w piwie mogą rozwijać się mikroorganizmy odpowiedzialne za jego psucie, zarówno bakterie (np. bakterie kwasu octowego, Lactobacillus sp., Pediococcus sp., Z. mobilis, Klebsiella sp.), jak i drożdże (np. Saccharomyces sp., Pichia sp.). Psucie piwa objawia się mętnieniem, nieprzyjemnymi aromatami i smakiem, choć generalnie nie stanowi to zagrożenia dla zdrowia[23].
Efektywność pasteryzacji w zwalczaniu bakterii zależy od temperatury i czasu, w którym piwo było przetrzymywane w tej temperaturze. Do jej określania stosuje się tzw. jednostkę pasteryzacyjną (JP; ang. pasteurization unit) o następującym wzorze:
- JP = czas [min] • 1,393(zastosowana temperatura–60 °C)
Przy zastosowaniu temperatury 60 °C przez minutę otrzymuje się 1 JP; przy temperaturze 70 °C będzie to już 27,5 JP[24]. Dla utrwalenia piwa zazwyczaj stosuje się dawkę 8–30 JP. Unika się niepotrzebnie dużych dawek ze względu na możliwe niekorzystne zmiany organoleptyczne, a także zbędny wydatek energii[25].
Na ogół świeże pasteryzowane piwo nie odróżnia się w smaku od niepasteryzowanego, natomiast w przypadku kilkutygodniowego piwa niepasteryzowanego (i nieutrwalanego) występuje znaczne ryzyko jego zepsucia. Z tego względu w latach 80 XX w. nierzadko zdarzały się w sklepach skwaśniałe piwa, a pasteryzowane piwa utożsamiane były z wyższą jakością. Współcześnie przedłużoną trwałość niepasteryzowanych piw osiąga się przez mikrofiltrację, która wyjaławia piwa nie tylko z mikroorganizmów, ale i cennych białek oraz polifenoli[26].
Reakcje enzymatyczne podczas zacierania

Celem zacierania jest produkcja brzeczki zawierającej odpowiednią ilość cukrów fermentujących, substancji odżywczych dla drożdży oraz związków (lub prekursorów) zapachowo-smakowych[27]. Podczas zacierania zachodzi rozkład węglowodanów, β-glukanów i białek pod wpływem odpowiednio amylaz, β-glukanaz i proteaz[28].
Węglowodany
Węglowodany stanową około 90% ekstraktu brzeczki podstawowej, z czego zwykle 67–77% to cukry fermentujące. Najważniejszym cukrem fermentującym jest maltoza[29].
Słodowany jęczmień jest głównym źródłem węglowodanów w procesie produkcji piwa[28][29], ale wprowadzać je mogą również inne zboża w różnej formie, np. pszenica, ryż, kukurydza, a także syropy cukrowe[29]. Słód zawiera enzymy amylolityczne, które rozkładają rozpuszczoną (skleikowaną) skrobię na cukry, które następnie są wykorzystywane przez drożdże do produkcji alkoholu[28].
Zawartość węglowodanów w gotowym piwie zwykle mieści się w przedziale od 3 do 61 g/l. Lagery charakteryzuje na ogół wyższy stopień odfermentowania niż piw górnej fermentacji, a więc niższe stężenia węglowodanów[29].
Rozkład skrobi
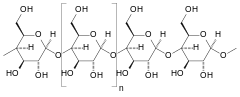
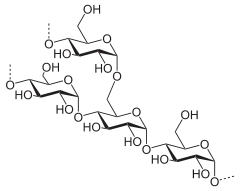
Skrobia składa się z dwóch polimerów glukozowych: amylozy (zwykle 20–25%) i amylopektyny (75–80%). Amyloza jest liniowym polimerem złożonym z nawet 6000 jednostek glukozowych połączonych wiązaniem α-1,4-glikozydowym. Amylopektyna składa się z łańcuchów złożonych z cząsteczek glukozy połączonych wiązaniami α-1,4-glikozydowymi oraz z łańcuchów bocznych powstałych przez wiązania α-1,6-glikozydowe. Rozpuszczanie skrobi w wodzie odbywa się w podwyższonej temperaturze i nazywa się kleikowaniem[30]. Temperatura kleikowania zależy od pochodzenia skrobi, ale zwykle wynosi 65–75 °C[31]. Podczas zacierania, dzięki współdziałaniu enzymów oraz dobremu rozluźnieniu słodu, może rozpoczynać się już w niższej[32][31]. Następuje wtedy pęcznienie i pękanie granulek skrobi zawartej w słodzie i zwiększenie lepkości[30]. Następnie enzymy słodowe przeprowadzają hydrolizę skrobi. Należy do nich α-amylaza, β-amylaza, dekstrynaza graniczna i α-glukozydaza[33].
α-Amylaza należy do endoamylaz – przecina wiązania α-1,4-glikozydowe wewnątrz cząsteczki skrobi w sposób przypadkowy, poza wiązaniami znajdującymi się w bezpośrednim sąsiedztwie rozgałęzień[31]. Produktem jej działania są różnej wielkości dekstryny[32] oraz w niewielkiej ilości cukry fermentujące (glukoza, maltoza, maltotrioza) – przede wszystkim, gdy działa na już stosunkowo niewielkie cząsteczki. α-Amylaza w wyniku gwałtownego zmniejszania rozmiaru cząsteczek skrobi powoduje silne obniżenie lepkości zacieru, dlatego nazywa się ją „enzymem upłynniającym”. Zwiększa dostępność dużych cząsteczek skrobi dla działania β-amylazy. α-Amylaza toleruje temperatury powyżej 70 °C, w których β-amylaza ulega bardzo szybkiej denaturacji[31].
β-Amylaza należy do egzoamylaz – atakuje nieredukujące końce amylozy i amylopektyny, hydrolizując co drugie wiązanie α-1,4-glikozydowe. W wyniku jej działania uwalniany jest cukier maltozowy, przez co nazywana jest „enzymem scukrzania”. Aktywność enzymu zatrzymuje się w chwili zbliżenia się do punktu rozgałęzienia, dlatego w odpowiednio długim czasie jest w stanie zhydrolizować całe cząsteczki amylozy, ale jedynie zewnętrzne obszary amylopektyny, zostawiając dekstryny graniczne[31].
Dekstrynaza graniczna jest enzymem odpowiedzialnym za rozkład wiązania α-1,6-glikozydowego, a przez to usuwanie rozgałęzień w amylopektynie i dekstrynach. Aktywność tego enzymu podczas zacierania jest jednak niewielka[33][34], o czym świadczy znaczna ilość rozgałęzionych dekstryn w przefermentowanej brzeczce i piwie[33].
α-Glukozydaza jest egzoamylazą uwalniającą pojedyncze cząsteczki glukozy z redukującego końca polisacharydów, przecinając wiązania α-1,4-glikozydowe. Enzym ten działa optymalnie w temperaturach 35–40 °C[35], jest termolabilny i ma przez to niewielkie znaczenie w procesie zacierania[33].
Węglowodany po procesie zacierania

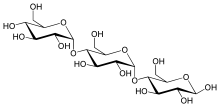
W wyniku działania enzymów amylolitycznych otrzymujemy ostatecznie:
- różnej długości dekstryny nieulegające fermentacji;
- maltotriozę wykorzystywaną przez wysoko odfermentujące drożdże dopiero po wykorzystaniu maltozy i innych dwucukrów, a więc dopiero podczas leżakowania[34]. Może być wykorzystywana szybciej przez szczepy drożdży dolnej fermentacji niż górnej[36]. Maltotrioza powstaje w większych ilościach, jeśli warunki zacierania faworyzują działanie α-amylazy[31];
- maltozę i niewielkie ilości innych dwucukrów (np. sacharoza) wykorzystywane przez drożdże;
- cukry proste (glukoza, fruktoza)[33] wykorzystywane przez drożdże w pierwszej kolejności[34].
β-Glukany i arabinoksylany

Głównym składnikiem ścian komórkowych bielma jęczmienia są β-glukany – liniowe polimery glukozy, które w opisywanym tutaj przypadku połączone wiązaniami β-1,3-glikozydowymi (około 30%) i β-1,4-glikozydowymi (około 70%). Stopień rozkładu β-glukanów zależy od stopnia namoczenia jęczmienia, ilości enzymów rozkładających ściany komórkowe i struktury ścian[29]. W enzymatycznych reakcjach rozkładu bierze udział:
- solubilaza β-glukanu – karboksypeptydaza usuwająca wiązania estrowe między białkami i β-glukanami;
- endo-β-glukanazy – hydrolizują β-glukany do tri- i tetrasacharydów;
- egzo-β-glukanazy – hydrolizują β-glukany do glukozy[29].
Głównym składnikiem ścian komórkowych warstwy aleuronowej są arabinoksylany[37]. Arabinoksylany są polimerami częściowo rozpuszczalnymi w wodzie, przechodzą ze słodu do brzeczki zarówno przez fizyczne rozpuszczenie w wodzie, jak i przez działanie hydrolaz arabinoksylanów. Składają się z β-(1,4)-ksylanów, do których przyłączone są reszty arabinozy w pozycji C2 lub C3 ksylozy[38].
Zarówno niecałkowity rozkład β-glukanów, jak i nadmiar uwolnionych arabinoksylanów może wywołać problemy z filtracją (związki te podwyższają lepkość brzeczki) oraz tworzenie się zmętnień podczas przechowywania piwa[37]. β-Glukany mogą wytrącać się już przy ich stosunkowo niskim stężeniu, ale arabinoksylany są bardziej odporne na rozkład i ich stężenie w gotowym piwie jest kilkakrotnie większe[37].
Białka
Najliczniejszymi białkami ziarna jęczmienia są hordeiny (40–50%) należące do prolamin. Poza tym występują w nim m.in. albuminy, gluteliny, globuliny, serpiny i enzymy. Białka są ważne w tworzeniu się i utrzymywaniu się piany, wpływają na teksturę piwa, barwę i wartość odżywczą. Mogą brać udział w tworzeniu zmętnień[33]. Częściowy rozkład białek podczas słodowania i zacierania prowadzi do powstania aminokwasów niezbędnych dla metabolizmu drożdży, a także uczestniczących w reakcjach Maillarda[39].
Tylko około 20% białek jęczmienia jest rozpuszczalne w wodzie[40]. Do oceny rozluźnienia proteolitycznego i rozpuszczalności słodowych białek używa się specjalnego parametru w postaci liczby Kolbacha[39][41].
W polskich warunkach zawartość białka w ziarnie jęczmienia jest zwykle zbyt duża (ponad 11,5%), co prowadzi do nierównomiernego kiełkowania podczas słodowania, obniżenia ekstraktywności słodu i nadmiaru związków azotowych, a przez to do tendencji do tworzenia zmętnień. Zawartość białka poniżej 9% świadczy z kolei o zbyt niskiej aktywności enzymatycznej[41].
Zawartość wolnego azotu aminowego (FAN), tj. przyswajalnej formy azotu dla drożdży w postaci aminokwasów, krótkich peptydów i jonów amonowych, powinna wynosić w brzeczce co najmniej 200 mg/dm³, a w przypadku stosowania surowców niesłodowanych – nie mniej niż 150 mg/dm³[41]. Jednocześnie brak białek o dużej i średniej masie cząsteczkowej prowadzi do słabego wytwarzania piany i braku odczucia „pełni” w teksturze piwa, dlatego pożądane jest osiągnięcie optymalnego stopnia ich rozkładu[39]. Stabilna, okazała piana w piwie nie tylko jest ważną cechą wizualną. Składniki zapachowe w mniejszym lub większym stopniu kumulują się w pianie. Piana powoduje powolne wydobywanie się składników zapachowych charakterystycznych dla danego stylu piwa, a to sprzyja zachowaniu świeżości podczas konsumowania[42].
Zawartość białek zmniejsza się nie tylko przez ich enzymatyczny rozkład, ale i w kolejnych etapach produkcji piwa:
- podczas gotowania brzeczki, kiedy to ulegają koagulacji i są usuwane jako osad gorący;
- podczas obniżania pH w trakcie fermentacji – ulegają sedymentacji;
- podczas dojrzewania (leżakowania) piwa, kiedy ulegają adhezji do komórek drożdży[40].
Warunki zacierania

W procesie zacierania ważne jest uzyskanie optymalnego stopnia hydrolizy skrobi, białek i β-glukanów oraz wykorzystanie maksymalnej ilości ekstraktu ze słodu. Zależy to od warunków zacierania, czyli przede wszystkim od:
- temperatury i czasu utrzymywania zacieru w danej temperaturze (tzw. przerwy);
- pH zacieru;
- gęstości zacieru[32].
Optymalne temperatury i pH rozkładu przez enzymy podczas zacierania są następujące:
| Enzymy | Temperatura (°C)[28] | pH[32] | Działanie |
|---|---|---|---|
| β-glukanazy | 40–45 | 5,4–5,8 | rozkładają ściany komórkowe |
| egzopeptydazy | 40 | 7,0–8,0 | rozkładają białka, hydrolizując końcowe wiązania peptydowe |
| endopeptydazy | 50–65 | 4,0–4,6 | rozkładają białka wewnątrz łańcucha polipeptydowego |
| β-amylazy | 60–65 | 5,4–5,6 | rozkładają skrobię, tworząc cukry fermentujące |
| α-amylazy | 65–75 | 5,6–6,8 | rozkładają skrobię, tworząc głównie dekstryny |

W uzyskiwaniu odpowiednich temperatur i przerw stosuje się różne strategie. W metodzie infuzji wzrastającej zacier podgrzewany jest powoli do pożądanej temperatury z zachowaniem przerw. W metodach dekokcyjnych część zacieru poddaje się gotowaniu (głównie, by lepiej skleikować skrobię), a następnie miesza się z resztą[32]
Enzymy, mimo różnych optymalnych warunków działania, występują w zacierze w tym samym czasie, a ilość ich aktywnych cząsteczek pod wpływem podwyższenia temperatury może się tylko zmniejszyć (ulec inaktywacji), chyba że stosowane są egzogenne enzymy pochodzenia mikrobiologicznego. Przy ustalaniu sposobu zacierania bierze się w praktyce pod uwagę temperatury zbliżone do optimum kilku enzymów:
- 37–45 °C – przerwa β-glukanowa, enzymatyczny rozkład składników ścian komórkowych;
- 45–55 °C – przerwa białkowa, powstawanie aminokwasów;
- 62–65 °C – przerwa maltozowa, tworzenie się ekstraktu fermentującego;
- 70–76 °C – przerwa docukrzania, intensywne tworzenie się dekstryn granicznych ze skrobi;
- 76–78 °C – zakończenie zacierania, inaktywacja enzymów[32][43].
Długie zacieranie w temperaturach 62–64 °C powoduje powstanie dużej ilości cukrów fermentujących, osiąganie dużego stopnia odfermentowania i dużej zawartości alkoholu. Długie zacieranie w temperaturach 72–75 °C powoduje, że piwie ostatecznie zostaje dużo dekstryn, a stopień odfermentowania jest niski[34]. Dekstryny nie mają smaku, ale wpływają na lepkość i przyczyniają się do odczucia „pełni”, nadają teksturę piwu[44].
Na koniec temperaturę zacieru podwyższa się do ok. 78 °C (ang. mash-out). Choć filtracja przebiega wydajniej w jeszcze wyższych temperaturach z powodu obniżenia lepkości, nie przekracza się jednak tej granicy. Podczas filtracji przechodzi bowiem jeszcze do roztworu nierozłożona skrobia, która może być zhydrolizowana przez aktywną jeszcze α-amylazę. W wyższych temperaturach enzym ten może już wcale nie wykazywać aktywności i skrobia może znaleźć się w gotowym piwie, powodując zmętnienie skrobiowe[34].
High gravity brewing
W wielu browarach nacisk na skracanie czasu produkcji i obniżenie kosztów spopularyzował metodę zwaną po angielsku high gravity brewing (HGB) w produkcji piwa[45], która nie wymaga dodatkowych inwestycji[46]. Polega ona na wytwarzaniu brzeczki o znacznie wyższej zawartości ekstraktu niż zakładany ekstrakt piwa gotowego. Po fermentacji piwo takie rozcieńcza się wodą do pożądanej zawartości ekstraktu. Pozwala to nie tylko zwiększyć wydajność warzelni, ale przede wszystkim zaoszczędzić na energii, gdyż dodawana później woda nie musi być podgrzewana i gotowana[47]. Osiągane w ten sposób wyższe stężenie alkoholu (przed rozcieńczeniem) zwiększa wytrącanie się kompleksów białka-polifenole, co sprzyja stabilności koloidalnej. Odpowiednie rozcieńczenie umożliwia łatwe sterowanie końcową zawartością cukrów oraz alkoholu w piwie[46].
Wymagany wyższy ekstrakt uzyskuje się czasem drogą na skróty, np. przez dodatek cukru lub syropu glukozowo-fruktozowego, co podwyższa potem stopień odfermentowania piwa[47]. Zamienniki słodu wprowadzają do brzeczki tylko węglowodany, nie zawierają związków odżywczych niezbędnych dla drożdży[46]. Jednak piwo wyprodukowane z ich udziałem mogą być bardziej odporne na starzenie się. Możliwe jest wyprodukowanie piwa zupełnie bez słodu, ze 100% niesłodowanego jęczmienia z dodatkiem enzymów egzogennych, którego jakość jest porównywalna z piwem otrzymanym ze słodu[48].
Metoda HGB, zwłaszcza przy dużych ekstraktach, niekorzystnie oddziałuje na drożdże poprzez stres osmotyczny, zwiększone stężenie etanolu, CO
2, co w konsekwencji prowadzi do nadprodukcji estrów (aromaty owocowe, rozpuszczalnikowe), wydłużonej fazy adaptacyjnej we wzroście drożdży, zmniejszonej stabilności piany i zwiększonej ilości cukrów resztkowych w piwie[45]. Poza tym pogarsza się kondycja drożdży, przez co gorsza jest ich wydajność w przypadku zaszczepienia nimi kolejnej brzeczki. Im wyższy ekstrakt brzeczki, tym bardziej wydłuża się wymagany czas fermentacji. Jednym ze sposobów poprawy wydajności fermentacji w takich warunkach jest zwiększenie ilości drożdży dodawanych do zaszczepienia brzeczki. Powoduje to wyższe odfermentowanie (większa zawartość etanolu), nieco większe stężenie alkoholi fuzlowych i większy poziom diacetylu w piwie zielonym. Inną metodą poprawy fermentacji jest suplementacja brzeczki pożywkami dla drożdży (zawierającymi jony cynku, magnezu i lipidy)[45].
Związki karbonylowe
Do najważniejszych związków karbonylowych w piwie należy aldehyd octowy oraz diketony wicynalne (posiadające grupy karbonylowe w pozycjach sąsiednich), ponieważ mają najniższe progi wyczuwalności[49].
Aldehyd octowy

W procesie glikolizy glukoza przekształcana jest w pirogronian, który pod wpływem dekarboksylazy pirogronianowej przekształca się w aldehyd octowy, a ten następnie przy udziale dehydrogenazy alkoholowej – w etanol
Aldehyd octowy jest prekursorem etanolu i octanów. W niskich stężeniach nadaje przyjemny owocowy aromat; w wyższych natomiast wywołuje nieprzyjemny, drażniący zapach przypominający zielone, niedojrzałe jabłko bądź świeżo ściętą trawę[3][50]. Jego stężenie jest uznawane za jeden z najważniejszych czynników wpływających na aromat i stabilność piwa[50]. Może ponadto przyczyniać się do obniżania trwałości piwa, dlatego dąży się ograniczania ilości tego związku[51]. W niewadliwym gotowym piwie zawartość aldehydu octowego wynosi zwykle 2 do 10 mg/l[52] i zaleca się, by nie przekraczała 35 mg/l[53].
Powstawanie aldehydu octowego
Aldehyd octowy powstaje przy udziale dekarboksylazy pirogronianowej w procesie dekarboksylacji pirogronianu. Najintensywniej tworzy się podczas fazy aktywnego wzrostu drożdży, przy najsilniejszym wydzielaniu CO
2. W późnej fazie fermentacji aldehyd octowy jest redukowany do etanolu z udziałem dehydrogenazy alkoholowej Adh1. Reakcja ta zachodzi, gdy obecne są fermentowalne źródła węgla. Jej funkcją biologiczną jest regeneracja NAD+. Kiedy źródła węgla wyczerpią się, do pozyskania energii zaczyna być wykorzystywany wytworzony etanol. Izozym dehydrogenazy alkoholowej – Adh2 utlenia etanol do aldehydu octowego. Ten z kolei może zostać wykorzystany w cyklu Krebsa bądź w glukoneogenezie[54]. Zatem poziom aldehydu octowego jest najwyższy podczas burzliwej fermentacji, spada do niskiego poziomu pod koniec fermentacji i powoli z czasem podwyższa się, m.in. wskutek utleniania etanolu i aktywności drożdży[55]. Zakłócając ekspresję genu ADH2, można skutecznie ograniczyć ilość aldehydu octowego w piwie. Metodą tradycyjnej mutagenezy udało się uzyskać w ten sposób taki szczep drożdży, który wytwarza o ponad 80% mniej aldehydu octowego niż powszechnie stosowane przemysłowe szczepy[51].

Pdc – dehydrogenaza pirogronianowa; Adh – dehydrogenaza alkoholowa; Ald – dehydrogenaza aldehydowa; Acs – syntetaza acylo-CoA
Wyższe stężenie aldehydu octowego odnotowuje się przy podwyższonej temperaturze fermentacji, ale w takich warunkach szybciej też następuje jego degradacja. Wyższe stężenia osiąga on również przy dużej zawartości związków azotowych w brzeczce, co wzmaga intensywność fermentacji[56]. Ponadto różne szczepy Saccharomyces cerevisiae są zdolne go produkować w różnym zakresie stężeń[57][58]. W gotowym piwie aldehyd octowy łatwo tworzy się z etanolu, jeśli obecny jest tlen. Większość komercyjnych piw jest jednak butelkowana z bardzo niskim stężeniem tlenu (poniżej 0,2 mg/l), co znacznie ogranicza ten proces[59].
Rola aldehydu octowego w starzeniu się piwa
W starzejącym się piwie szczególny wpływ na aromat ma wysokie stężenie trans-2-nonenalu i aldehydu octowego. Do ich nadmiernego powstawania przyczynia się dostępność reaktywnych form tlenu[60]. Rodnikiem, który w starym piwie występuje w największej ilości jest rodnik 1-hydroksyetylowy, powstały w wyniku reakcji etanolu z rodnikami hydroksylowymi. Głównym produktem jego degradacji jest aldehyd octowy[61]. Aldehyd octowy ulega z czasem reakcjom kondensacji aldolowej, w wyniku których mogą tworzyć się niekorzystne związki. Przez kondensację aldehydu octowego i heptanalu może powstać trans-2-nonenal[62][63]. trans-2-Nonenal tworzy niepożądane nuty zapachowe określane jako zapach mokrego kartonu. Inne alifatyczne aldehydy (C
4–C
10) również niekorzystnie wpływają na aromat i mogą przyczyniać się do powstawania nieprzyjemnego bukietu starzejącego się piwa[64].

Diketony wicynalne
Do najważniejszych diketonów wicynalnych w piwie należą diacetyl (2,3-butanodion) oraz 2,3-pentanodion[65]. Tworzą się one podczas fermentacji jako produkty uboczne biosyntezy aminokwasów przez drożdże. Aromat diacetylu określany jest jako maślany, przypominający mleczne karmelki, a podobny mu aromat 2,3-pendanodionu przypomina toffi. Są one najsilniej wyczuwalne w lekkich piwach, w których nie są zdominowane przez inne aromaty. Z tego powodu istnieje potrzeba minimalizowania ich ilości, zwłaszcza w lagerach[66].
Powstawanie diacetylu i 2,3-pentanodionu
Diacetyl i 2,3-pentanodion powstają przez spontaniczną nieenzymatyczną oksydacyjną dekarboksylację α-acetohydroksykwasów, które są związkami pośrednimi w biosyntezie waliny i izoleucyny[67]. Na zasadzie sprzężenia zwrotnego ujemnego, dostępność waliny w komórce drożdży jest związana z inhibicją zwrotną syntazy acetomleczanowej, która nieodwracalnie przekształca pirogronian do α-acetomleczanu (prekursora diacetylu) oraz α-ketomaślan do α-acetohydroksymaślanu (prekursora 2,3-pentanodionu)[68].

Diacetyl może powstawać również w wyniku działalności infekujących bakterii, przede wszystkim bakterie fermentacji mlekowej[69], wśród których w browarach największy problem stanowi rodzaj Pediococcus[65].
Podczas syntezy waliny w komórkach drożdży etapem ograniczającym szybkość reakcji jest przekształcanie α-acetomleczanu do 2,3-dihydroksyizowalerianianu. Część cząsteczek α-acetomleczanu jest wydzielana poza komórkę drożdży do brzeczki, gdzie ulegają one nieenzymatycznej oksydacyjnej dekarboksylacji do diacetylu lub też nieoksydacyjnej, tworząc acetoinę[67]. Ten drugi, korzystny typ dekarboksylacji można stymulować przez lekkie ogrzanie w warunkach beztlenowych oraz przez utrzymywanie niskiego potencjału oksydacyjno-redukcyjnego w brzeczce[70]. Drożdże browarnicze nie wytwarzają enzymu dekarboksylazy α-acetomleczanowej, który katalizuje tę reakcję[71].
Wytwarzanie diacetylu zależy zatem od intensywności biosyntezy waliny, a ta z kolei zależy od zapotrzebowania i dostępu komórek do tego aminokwasu[67]. Im więcej waliny w komórce drożdży, tym mniej wytworzy się prekursorów tych związków. Jednak duża dostępność waliny w brzeczce nie zatrzymuje zupełnie biosyntezy tego aminokwasu. Walina nie należy bowiem do aminokwasów szybko przyswajanych przez drożdże (do których należy kwas glutaminowy, kwas asparaginowy, asparagina, glutamina, seryna, treonina, lizyna i arginina)[72] i jej pobór w czasie pierwszych 12 godzin fermentacji jest zwykle bardzo powolny[67]. Dodatek łatwo przyswajalnych aminokwasów, jak również wysokie stężenie wolnego azotu aminowego (który obejmuje te preferowane aminokwasy) prowadzi do zwiększonego wytwarzania diacetylu. Pobór waliny przez komórki jest wtedy zbyt wolny, aminokwasy konkurują o dostęp do permeaz i musi ona być intensywniej biosyntetyzowana, zwiększając stężenie prekursorów diketonów wicynalnych. Zwiększenie stężenia diacetylu występuje także w przypadku zbyt niskiego poziomu wolnego azotu aminowego (poniżej 150 ppm) – w tym wypadku również zachodzi potrzeba biosyntezy waliny. Suplementacja brzeczki samą waliną (100–300 mg/l) może jednak zredukować stężenie diacetylu po fermentacji do 33% w przypadku drożdży Saccharomyces pastorianus[73].
Zawartością waliny w brzeczce można też sterować poprzez warunki zacierania. Optymalne warunki dla uwalniania największych ilości waliny ze słodu to temperatura 50 °C, pH 5,4 i czas 60–75 minut[67]. Znaczenie ma również sposób produkcji słodu – niska temperatura jego suszenia sprzyja pozostawaniu większej ilości waliny i innych aminokwasów[74]. Najwięcej waliny zawierają słody owsiane – 5,0–5,7% aminokwasów białek. Dla porównania, słody jęczmienne zawierają średnio 4,7–4,9%, a pszeniczne 4,4%[67].
Redukcja diketonów wicynalnych
Drożdże są zdolne pobrać i zredukować diketony wicynalne do alkoholi, które mają bardzo wysoki próg wyczuwalności i praktycznie nie wpływają na aromat. 2,3-pentanodion jest redukowany do 2,3-pentanodiolu, natomiast diacetyl jest redukowany do acetoiny, a ta ostatecznie do 2,3-butanodiolu. Z punktu widzenia biologii drożdży redukcja ta jest również korzystna, ponieważ jej produkty są mniej toksyczne od substratów[75]. W redukcji bierze udział wiele różnych, specyficznych i niespecyficznych reduktaz ketonów zależnych od NADH lub NADPH. Prawdopodobnie jednak największą aktywność w tym procesie wykazuje dehydrogenaza alkoholowa[65]. Dokładne mechanizmy tych procesów nie są jeszcze dobrze poznane[67].
Redukcja diketonów wicynalnych zaczyna się już podczas fermentacji burzliwej, ale dopiero podczas leżakowania (fermentacji cichej) ich stężenia spadają do poziomów poniżej progu wyczuwalności. Dłuższego czasu potrzebują przede wszystkim lagery[73]. Proces usunięcia diacetylu jest etapem limitującym w dojrzewaniu piwa[66]. Jednocześnie istnieje ekonomiczny nacisk na skracanie długotrwałego i energochłonnego procesu dojrzewania, możliwie bez negatywnego wpływu na jakość piwa[73].
Na redukcję wpływają parametry związane z przepuszczalnością błon (m.in. temperatura, natlenienie)[76], związane z szybkością namnażania się drożdży (m.in. pH, temperatura) oraz związane z aktywnością enzymów odpowiedzialnych za tę redukcję. Wyższe temperatury fermentacji przyspieszają tworzenie się diacetylu w następstwie szybszego wzrostu drożdży, zwiększają jego maksymalne stężenie osiągane w fermentującym piwie, ale jednocześnie większa biomasa drożdży w tych warunkach szybciej redukuje diacetyl. Najszybsza konwersja α-acetomleczanu do diacetylu, jak również redukcja diacetylu zachodzi przy pH 3,5. Czas dojrzewania może być zatem skrócony przez uzyskiwanie możliwie niskiego pH piwa[67]. Typowe wartości pH są jednak wyższe, wynoszą około 4,5, a ich obniżanie nie zawsze jest korzystne pod względem innych cech sensorycznych[77].

Doświadczalnie wykazano, że poziom egzogennego diacetylu dodawanego do fermentującej brzeczki szybko spada do poziomu kontrolnej fermentującej brzeczki. Jednak im w późniejszym etapie fermentacji ma to miejsce, tym wolniej spada jego stężenie[76]. Wyniki te sugerują, że to nie redukcja diacetylu, a raczej spontaniczna dekarboksylacja α-acetomleczanu do diacetylu jest etapem limitującym, a ponadto istotna jest dobra kondycja drożdży w tym procesie[67]. Zasadne jest więc dodawanie burzliwie fermentującej brzeczki do dojrzewającego piwa zielonego w objętości 5–10%[78]. Proces ten nazywany jest „krausening” od niemieckiego słowa Kräusen, oznaczającego fermentującą brzeczkę w fazie wysokich krążków. Skuteczne usuwa on diacetyl i inne niepożądane aromaty aktywnie przekształcane przez drożdże. Stosowany może być również w zamkniętych zbiornikach w celu naturalnego nasycenia piwa CO
2[79].
Nadmierny poziom diacetylu stanowi spory problem w próbach fermentacji ciągłych z unieruchomionymi komórkami drożdży. Jest to związane m.in. z niewystarczającym czasem fermentacji, by zreasymilować i zredukować ten związek, ze zwiększoną ekspresją genu syntazy acetylomleczanowej (ALS) oraz zmianami w metabolizmie aminokwasów w komórkach immobilizowanych drożdży. Tymczasem problemy te można rozwiązać poprzez użycie genetycznie modyfikowanych drożdży, np. z wprowadzonym bakteryjnym genem dekarboksylazy α-acetomleczanowej[71]. W praktyce w walce z nadmierną ilością diketonów wicynalnych nie używa się jednak modyfikowanych genetycznie szczepów drożdży, egzogennych enzymów ani silnego podgrzewania. W tym ostatnim przypadku do pozbycia się całkowicie α-acetomleczanu trzeba by ogrzewać piwo w temperaturze 90 °C przez 10 minut[65].
Inne związki karbonylowe
Wiele innych aldehydów i ketonów niekorzystnie wpływa na aromat piwa. Ich źródłem są reakcje Maillarda podczas suszenia słodu, rozpad kwasów tłuszczowych i reakcje utleniania podczas przechowywania. Do najważniejszych związków karbonylowych w piwie należą[80]:
| Związek karbonylowy | Aromat | Pochodzenie |
|---|---|---|
| 2-metylopropanal | zbożowy, rozpuszczalnikowy, owocowy | degradacja Streckera waliny; może również wynikać z utlenienia podczas przechowywania i starzenia się piwa |
| 2-metylobutanal | migdałowy, jabłkowy, słodowy | degradacja Streckera izoleucyny; może również wynikać z utlenienia |
| 3-metylobutanal | słodowy, czekoladowy, migdałowy | degradacja Streckera leucyny; może również wynikać z utlenienia |
| heptanal | ostry, owocowy, winny | rozpad kwasów tłuszczowych podczas starzenia się piwa |
| oktanal | ostry, owocowy, podobny do pomarańczy | rozpad kwasów tłuszczowych podczas starzenia się piwa |
| furfural | karmel, chleb, pieczone mięso | produkt reakcji Maillarda |
Alkohole i estry
Etanol
Etanol stanowi jeden z głównych produktów metabolizmu drożdży. To przede wszystkim ten związek odpowiada za rozgrzewające właściwości piwa, choć to wrażenie sensoryczne w tym trunku jest redukowane przez obecność CO
2. Etanol zwiększa odczuwanie słodyczy oraz wchodzi w reakcje z kwasami, także tymi pochodzenia chmielowego, tworząc estry[81]. Przyczynia się do nadawania treściwości piwu[82]. Etanol, podobnie jak cukry, zmniejsza zdolność wyczuwania niepożądanych aromatów aldehydowych[83]. Tworzy jedną z głównych barier ograniczających rozwój infekujących bakterii[84].
Alkohole wyższe
Alkohole wyższe (alkohole fuzlowe) zawierają więcej niż 2 atomy węgla w cząsteczce, mają wyższą masę cząsteczkową i temperaturę wrzenia od etanolu[85]. Powstają jako produkty uboczne fermentacji alkoholowej. Na właściwości sensoryczne największy wpływ mają n-propanol, izobutanol oraz pentanole: 2-metylobutanol i 3-metylobutanol. Przyczyniają się do tworzenia rozgrzewającego charakteru piw i wzmacniają aromat etanolu[86]. Mogą nadawać aromaty rozpuszczalnikowe, kwiatowe[87], a ich nadmiar może wywoływać nieprzyjemny ostry zapach i smak[85].
Alkohole wyższe mogą powstawać na drodze katabolicznej lub anabolicznej. Droga kataboliczna przeważa w brzeczkach bogatych w aminokwasy, gdzie duża zawartość α-ketokwasów hamuje drogę anaboliczną. W przypadku niedoboru aminokwasów w brzeczce, α-ketokwasy powstają de novo z cukrów i przeważa droga anaboliczna[86].
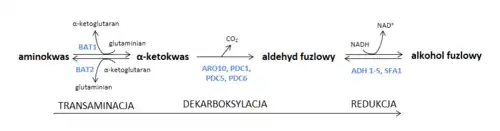
Droga kataboliczna, tzw. szlak Ehrlicha, zakłada, iż aminokwas przechodzi reakcję transaminacji do α-ketokwasu, następnie dekarboksylację do aldehydu fuzlowego i redukcję do alkoholu wyższego[87]. Reakcja transaminacji jest odwracalną reakcją regulowaną enzymami katalizującymi przenoszenie grup aminowych między aminokwasami i odpowiadającymi im α-ketokwasami z udziałem dehydrogenazy glutaminianowej. Etap dekarboksylacji przez dekarboksylazy jest nieodwracalny. Do redukcji aldehydów fuzlowych do alkoholi zdolne są dehydrogenazy alkoholowe oraz dehydrogenaza aldehydu octowego[87][88].
Te same α-ketokwasy uczestniczące w szlaku Ehrlicha mogą powstawać podczas syntezy aminokwasów de novo ze związków wytworzonych w wyniku metabolizmu węglowodanów. Odpowiada za to szereg różnych enzymów w zależności od rodziny biosyntetycznej aminokwasu. Na zawartość fuzli w piwie wpływa zatem dostępność aminokwasów w środowisku determinowana m.in. przez skład zasypu i rodzaj pożywek[89]. Istotne są również warunki fermentacji. W brzeczkach natlenionych z niedoborem glukozy przeważa utlenianie aldehydów. Aminokwasy są wtedy przekształcane głównie do kwasów fuzlowych[90]. Wyższe temperatury fermentacji zwiększają ilość alkoholi wyższych, natomiast przeciwny efekt obserwuje się w przypadku fermentacji pod ciśnieniem[86]. Kluczowy jednak dla produkcji alkoholi fuzlowych jest zastosowany szczep drożdży. Generalnie szczepy drożdży górnej fermentacji wytwarzają więcej alkoholi wyższych niż szczepy dolnej fermentacji[91].
Estry
Alkohole wyższe są prekursorami estrów. Estry to produkty kondensacji kwasów organicznych i alkoholi. Choć ich stężenie w piwie jest bardzo niskie, już te niewielkie ilości są bardzo dobrze wyczuwalne i mogą wpływać na ostateczny aromat piwa[92]. Co więcej, obecność niewielkiego stężenia różnych estrów może dawać efekt synergistyczny[93]. Mogą nadawać piwu słodkie, owocowe aromaty[94], jednak w nadmiarze skutkują nieprzyjemną goryczką w smaku[87]. Na ogół estry są niepożądane w większości piw dolnej fermentacji, gdzie oczekuje się czystości charakteru słodowego.
Podczas syntezy estrów, kwasy organiczne łączą się z koenzymem A przy udziale syntetaz acylo-CoA, tworząc acylo-CoA. W drugim etapie cząsteczki acylo-CoA łączą się z alkoholem przy udziale acylotransferaz alkoholowych, tworząc estry[87]. Estry w piwie można podzielić na dwie główne grupy: estry kwasu octowego oraz estry etylowe średniołańcuchowych kwasów tłuszczowych[95].

Najpierw tworzony jest acylo-CoA, który następnie reaguje z alkoholem. W przypadku estrów kwasu octowego reaguje acetylo-CoA (acylo-CoA) z alkoholem. Przy tworzeniu się estrów etylowych reaguje etanol (alkohol) z acylo-CoA
Biosynteza estrów kwasu octowego przebiega w następujący sposób. Acetylo-CoA, który po estryfikacji tworzy octany, jest pozyskiwany z oksydacyjnej dekarboksylacji pirogronianu lub w wyniku bezpośredniej aktywacji octanu z udziałem ATP (reakcja acetylowania CoA). W warunkach beztlenowych nie jest wykorzystywany w cyklu Krebsa, więc ulega estryfikacji – łączy się z alkoholami. Katalizatorem reakcji są acylotransferazy alkoholowe (AATases) kodowane przez geny ATF1 i ATF2. Nadekspresja tych genów może znacznie podwyższyć stężenie tych estrów w piwie[87].
Estry etylowe średniołańcuchowych kwasów tłuszczowych powstają w wyniku reakcji estryfikacji dłuższych łańcuchów acylo-CoA z etanolem[87][95]. Reakcję tę katalizują inne acylotransferazy alkoholowe – acylo-CoA/etanol O-acylotransferazy (AEATases) kodowane przez geny EEB1 i EHT1[87]. W warunkach tlenowych cząsteczki acylo-CoA mogą jednak ulec β-oksydacji, generując jednostki acetylo-CoA wchodzące do cyklu Krebsa. Synteza estrów w tych warunkach jest zahamowana. Również obecność nienasyconych kwasów tłuszczowych hamuje ich syntezę poprzez inhibicję acylotransferazy alkoholowej[86][96].
Choć w piwie możemy wykryć ponad 100 estrów[93], tylko sześć z nich uznaje się za najbardziej wpływowe dla kształtowania bukietu. Są to: octan etylu (aromat rozpuszczalnikowy), octan izoamylu (bananowy), octan izobutylu (owocowy), octan 2-fenyloetylu (różany, miodowy), heksanian etylu (słodkie jabłko, anyż) oraz oktanian etylu (kwaśne jabłko)[87][95]. W największych ilościach występuje octan etylu, którego stężenia dochodzą do 10–20 ppm. Stężenia innych estrów zazwyczaj nie przekraczają 1 ppm[86]. Drożdże górnej fermentacji produkują na ogół więcej estrów niż drożdże dolnej fermentacji. W piwach górnej fermentacji zwykle zarówno octan etylu, jak i heksanian etylu są wyczuwalne. W specyficznych piwach belgijskich typu lambic uzyskiwanych przez spontaniczną fermentację dzikimi drożdżami i bakteriami (enterobakterie, Kloeckera, Pediococcus, bakterie octowe, szczepy drożdży Saccharomyces, Dekkera – wcześniej Brettanomyces) występują znaczne ilości dekanianu etylu, niewystępującego w innych stylach piw[97].
Z czasem leżakowania profil estrowy piwa może się znacząco zmieniać, zarówno pod wpływem żywych drożdży (przy nieutrwalonym piwie), jak i przez spontaniczną kondensację kwasów organicznych z etanolem[92]. Kwasy organiczne pochodzące z utlenionych składników chmieli mogą tworzyć estry o winnym, słodkim charakterze, podczas gdy owocowe estry mogą z czasem ulec hydrolizie[87].
Suplementacja brzeczki ZnSO
4 może ponad dwukrotnie zwiększyć stężenie niektórych estrów[98]. Podobnie zwiększanie stężenia wolnego azotu aminowego (np. przez dodatek proteaz do brzeczki) skutkuje zwiększeniem finalnego stężenia estrów[99]. Wyższe temperatury sprzyjają tworzeniu się estrów, nie tylko wpływając na kinetykę reakcji, ale również na metabolizm drożdży i skład chemiczny piwa[98]. Zwiększone ciśnienie przy fermentacji powoduje nadmierne stężenie CO
2 i w konsekwencji rozregulowuje reakcje dekarboksylacji, istotne przy tworzeniu alkoholi oraz prekursora estrów octowych – acetylo-CoA[100].
Najskuteczniejszym narzędziem sterowania stężeniem alkoholi i estrów są modyfikacje genetyczne szczepów drożdży. Przykładowo szczepy drożdży pozbawione genu IAH1 kodującego esterazę hydrolizującą octan izoamylu mogą wytworzyć piwo nawet 19 razy bogatsze w ten ester[101]. Szczepy pozbawione genu BAT2, za to wykazujące nadekspresję genu ATF1 (kodującego acetylotransferazę alkoholową) skutecznie zmniejszają stężenie niepożądanych alkoholi wyższych i zwiększają stężenie pożądanych estrów[102].
Z powodzeniem można opracować system kontroli stężenia estrów i alkoholi fuzlowych oparty na powyższych zależnościach. Pozwala to na uzyskanie piw o pożądanych poziomach tych związków nawet przy stosowaniu dużej ilości surowców niesłodowanych lub przy stosowaniu niestandardowych temperatur podczas fermentacji[103].
Związki fenolowe
Związki fenolowe pochodzące ze słodu i chmielu wpływają na aromat, cierpkość, treściwość i przejrzystość piwa. Jako antyoksydanty przeciwdziałają niekorzystnym skutkom utlenienia, przedłużając trwałość piwa, a także wpływając korzystnie na jego zdrowotne właściwości[104]. W piwie możemy wyróżnić następujące klasy związków fenolowych:
- proste fenole (monofenole), które można podzielić na pochodne kwasu cynamonowego (kwas ferulowy, kumarowy, synapinowy, 4-winylofenol, 4-winylogwajakol) oraz pochodne kwasu benzoesowego (kwas wanilinowy, wanilina, kwas salicylowy, aldehyd salicylowy);
- flawonoidy, do których należą katechiny (inaczej flawan-3-ole takie jak: katechiny, epikatechiny, gallokatechiny i ich estry), proantocyjanidyny (di-, tri- i oligomeryczne produkty kondensacji monomerów flawan-3-olu, tzw. taniny skondensowane), chalkony (np. ksantohumol), flawanony (np. izoksantohumol), flawonole (kwercetyna, kemferol);
- inne związki fenolowe, np. stylbenoidy (resweratrol)[105][106].
Większość związków fenolowych występujących w piwie jest słabo wyczuwalna, ale mogą one wykazywać efekt synergistyczny[107]. Do stosunkowo najłatwiej rozpoznawalnych związków fenolowych w piwie można zaliczyć gwajakol, fenol, wanilinę, eugenol, 4-winylogwajakol, 4-winylofenol[108].
Aromat prostych związków fenolowych może być zarówno przyjemny (przypominający wanilię, wędzonkę, goździki), jak i nieprzyjemny (określany potocznie jako „apteczny”, „szpitalny”). Postrzeganie aromatu 4-winylogwajakolu zmienia się istotnie ze wzrostem jego stężenia: przy poziomach bliskich progowi wyczuwalności jest to wanilia, przy średnich wartościach – goździk, przy bardzo wysokich – mocna wędzonka lub aromaty „apteczne”[107]. Zjawisko to tłumaczy się występowaniem receptorów węchowych uaktywnianych dopiero przy wyższych stężeniach danej substancji[109].
Przemiany kwasów hydroksycynamonowych
Spośród wolnych kwasów fenolowych stosunkowo wysokie stężenia w brzeczce osiągają kwas ferulowy (FA) i kwas p-kumarowy (pCA). Te kwasy hydroksycynamonowe (HCA) są związane głównie z polisacharydami w ścianie komórkowej roślin. W ziarnach są one zestryfikowane przede wszystkim arabinoksylanami, które obok β-glukanów są najważniejszymi nieskrobiowymi polisacharydami ziaren[38]. Zdrowe ziarno jęczmienia zawiera 4–10% arabinoksylanów, przy czym najwięcej jest ich w ścianie komórek aleuronowych[37]. Kwasy hydroksycynamonowe połączone są z resztami arabinofuranozowymi w pozycji O5, natomiast odłączane są i rozpuszczane w brzeczce dzięki działaniu esterazy cynamonowej (EC 3.1.1.73[110]), występującej naturalnie w jęczmieniu i słodzie jęczmiennym, we współpracy z synergistycznymi hydrolazami arabinoksylanów[38].

Rozpuszczone enzymatycznie kwasy fenolowe są cenione za swoje właściwości antyoksydacyjne, dzięki czemu sprzyjają stabilności piwa[38]. Mając wysokie progi wyczuwalności, na ogół nie wpływają na aromat. Kwas ferulowy i kwas p-kumarowy może jednak ulec dekarboksylacji, tworząc związki silnie wpływające na bukiet piwa – odpowiednio 4-winylogwajakol i 4-winylofenol. Proces ten odbywa się przez:
- działanie wysokich temperatur (np. przy gotowaniu brzeczki, pasteryzacji piwa);
- enzymatyczną dekarboksylację podczas fermentacji przez aktywność dekarboksylazy kwasu fenyloakrylowego drożdży górnej fermentacji (enzym Pad1);
- działalność infekujących mikroorganizmów (Enterobacteriaceae, bakterie kwasu mlekowego, bakterie octowe, dzikie drożdże Dekkera)[108].
Termiczna dekarboksylacja kwasu ferulowego do 4-winylogwajakolu zachodzi głównie podczas gotowania brzeczki. Przemiany zaczynają się już w temperaturze 90 °C i ich poziom wzrasta wraz z czasem i intensywnością ogrzewania. Termiczna dekarboksylacja tłumaczy obecność 4-winylogwajakolu w ilości przekraczającej próg wyczuwalności w piwach fermentowanych z użyciem drożdży dolnej fermentacji[108].
Enzymatyczna dekarboksylacja regulowana jest przez gen PAD1 kodujący dekarboksylazę kwasu fenyloakrylowego (ang. phenylacrylic acid decarboxylase). Jest on aktywny tylko u drożdży górnej fermentacji i u dzikich. Aromaty, które tworzą te związki są niepożądane w jasnych piwach dolnej fermentacji, natomiast w piwach belgijskich i niemieckich weizenach tworzą charakterystyczne, przyjemne bukiety zapachowe[108].
Szczep drożdży jest najważniejszym czynnikiem determinującym finalną zawartość lotnych fenoli w piwie poprzez udział w dekarboksylacji, ale warunkiem podstawowym jest obecność ich prekursorów. Zawartość, jak i wydajność ekstrakcji kwasów hydroksycynamonowych zależy od warunków zacierania. Maksymalne enzymatyczne uwalnianie kwasu ferulowego zachodzi w temperaturze około 40 °C oraz pH 5,8, a zatrzymuje się niemal całkowicie w temperaturze 65 °C i pH poniżej 4[38][111]. W przypadku wodnej (nieenzymatycznej) ekstrakcji wartość pH nie wpływa na efektywność tego procesu. Ciągłe mieszanie brzeczki wyzwala go o 45% więcej niż w przypadku niemieszania brzeczki. Duże znaczenie ma też zasyp – wykazano, że brzeczka wyprodukowana z 50% niesłodowanej pszenicy zawiera 15–43% mniej wolnego kwasu ferulowego niż ta z 100% słodowanego jęczmienia[38].
W piwach poddawanych spontanicznej fermentacji drożdżami dzikimi winylofenole występują w nieznacznych ilościach, natomiast obecne są etylofenole: 4-etylofenol (4EP) i 4-etylogwajakol (4EG). Związki te normalnie nie występują w niezakażonych piwach dolnej i górnej fermentacji[108]. Zapach 4-etylowych pochodnych określany jest jako zapach „zagrody zwierzęcej” i „bandaża”[112], mają niższe progi wyczuwalności. Powstają w wyniku dekarboksylacji kwasu hydroksycynamonowego do winylofenolowej pochodnej przez enzym analogiczny do enzymu Pad1 drożdży S. cerevisiae, a następne redukcji do odpowiadającego etylofenolu przez reduktazę winylofenolową drożdży Dekkera spp.[108] Redukcja ta nie występuje u S. cerevisiae[113].
Właściwości przeciwutleniające związków fenolowych w piwie
Oszacowano, że związki fenolowe wraz z melanoidynami i dwutlenkiem siarki tworzą 22–68% aktywności antyoksydacyjnej piwa dolnej fermentacji, ale najważniejszymi przeciwutleniaczami piwa są właśnie związki fenolowe[114]. Przypisuje się im korzystny wpływ na zdrowie, ponieważ przeciwdziałają stresowi oksydacyjnemu komórki, wykazują działanie antykancerogenne i antymutagenne[115].
Choć całkowita zawartość polifenoli jest znacznie większa w winie białym niż w piwie, piwo posiada większą od niego aktywność przeciwutleniającą. Związane jest to z większą zawartością procyjanidyn, epikatechin i kwasu ferulowego w piwie. Nie wszystkie bowiem polifenole są biologicznie aktywne i biodostępne[116].
Współcześnie poziom tlenu w piwie często wynosi zaledwie 0,1 mg/dm³, ale nawet taka ilość wystarczy do wywołania z czasem objawów starzenia oksydacyjnego piwa. Antyoksydanty pełnią kluczową rolę w zapewnieniu stabilności fizyko-chemicznej i aromatycznej[114].
Polifenole pochodzące ze słodu rozpuszczają się w brzeczce podczas zacierania podobnie jak monofenole, ale wolniej. Wiele z nich traci się przez utlenianie, adsorpcję do wysłodzin oraz przez wytrącanie po związaniu w kompleksy z białkami[104]. Stosowanie surowców niesłodowanych w zasypie dodatkowo wpływa niekorzystnie na zawartość fenoli w brzeczce[115][117].
Największy wpływ na właściwości antyoksydacyjne jęczmienia mają katechiny – wśród nich procyjanidyna B3 i prodelfinidyna B3. Jednak po procesie słodowania i warzenia drastycznie zmniejsza się ich zawartość. Największy udział w tworzeniu antyoksydacyjnych właściwości piwa spośród składników pochodzenia słodowego mają proste fenole – kwas ferulowy i synapinowy, które ulegają stosunkowo niewielkim utratom podczas procesu produkcyjnego[117]. Po całym procesie technologicznym całkowita zawartość fenoli w piwie jest zredukowana o około połowę, zwłaszcza tanin (o około 90%) i flawonoidów (o około 75%)[115], głównie podczas filtrowania, warzenia (osad gorący, tzw. przełom), chłodzenia brzeczki i leżakowania (zimny osad).
Przeciwutleniające właściwości chmielu są w nowszych publikacjach opisywane jako niezależnie od zawartości w nim polifenoli. Wykazano, że antyoksydacyjne właściwości chmielu zależą przede wszystkim od humulonów (α-kwasów) i lupulonów (β-kwasów). W brzeczkach niechmielonych powstaje znacznie więcej rodników. Jednocześnie izomeryzacja α-kwasów do izo-α-kwasów podczas gotowania brzeczki zmniejsza jej pojemność przeciwutleniającą[118].
Duży wpływ na zawartość polifenoli ma dojrzewanie piwa w beczkach po winie, stosowane przy niektórych stylach piw rzemieślniczych. Wykazano, że tak produkowane piwa mają do 2,5 razy większą ogólną zawartość polifenoli w porównaniu do innych piw rzemieślniczych i 3,6 razy więcej niż piwa przemysłowe. Aktywność przeciwutleniająca jest z tym ściśle skorelowana[119].
Odpowiedni poziom siły redukcyjnej zapobiega tworzeniu się niepożądanych substancji zapachowych takich jak trans-2-nonenal. Związek ten nie ulega redukującej aktywności drożdży, ponieważ wiąże się do związków azotowych takich jak aminokwasy czy białka. Z czasem zostaje uwalniany przez kwaśną hydrolizę, zwłaszcza gdy pH piwa jest niskie, lub gdy piwo przechowywane jest w nieodpowiedniej temperaturze[120][121]. Duża zawartość fenoli przez zwiększanie siły redukcyjnej piwa poprawia stabilność organoleptyczną piwa przez hamowanie syntezy trans-2-nonenalu i utrudnianie wiązania się ze związkami azotowymi[120].
Tworzenie osadów i zmętnień przez związki fenolowe
Polifenole, choć poprawiają właściwości zdrowotne i stabilność oksydacyjną piwa, mogą źle oddziaływać na jego stabilność koloidalną. Duża ich zawartość sprzyja tworzeniu się kompleksów białkowo-polifenolowych, które są przyczyną zmętnień. Białka tworzące takie kompleksy pochodzą głównie z jęczmienia, mają wielkość 10–30 kD, są silnie glikozylowane, bogate w prolinę i kwas glutaminowy, stanowią 3–7% wszystkich białek piwa[122]. Z udziałem proliny tworzone są niekowalencyjne, odwracalne interakcje hydrofobowe i wiązania wodorowe między białkami a polifenolami[123][124]. Ponadto prolina zapobiega tworzeniu się alfa helisy i sprzyja kształtowaniu się bardziej otwartej struktury[123]. Zmętnienia wywołane przez te kompleksy powstają przy chłodzeniu piwa do temperatur bliskich 0 °C i znikają po ogrzaniu (zimny osad)[122]. Z czasem przechowywania piwa powstaje coraz więcej trwałych wiązań kowalencyjnych, co prawdopodobnie jest związane z utlenieniem polifenoli, a następnie ich polimeryzacją[125]. Im więcej monomerów fenolowych w takim spolimeryzowanym związku, tym większa aktywność w tworzeniu zmętnień[123].
W piwie występuje przewaga białek potencjalnie tworzących zmętnienia (ang. haze active proteins), mających duży udział proliny w łańcuchu, nad tworzącymi zmętnienia polifenolami (ang. haze active polyphenols), do których należą przede wszystkim flawanole, dlatego redukcja zawartości polifenoli wydawałaby się najskuteczniejszą metodą stabilizacji piwa[124]. Usuwa się je przez środki adsorbujące, m.in. poliwinylopolipirolidon (PVPP), związek podobny strukturalnie do poliproliny[123][124]. Środek ten usuwa jednakże tylko około połowę polifenoli tworzących zmętnienia, ponieważ ich cząsteczki są więzione między łączącymi się z nim białkami[124][126]. Co więcej, pozbawia to również piwo pożądanych polifenoli nietworzących zmętnień, o antyoksydacyjnych właściwościach[124]. By poprawić efektywność stabilizacji, usuwa się dodatkowo białka. Można to osiągnąć np. przy użyciu silikażelu, do którego grup hydroksylowych adsorbowane są białka bogate w prolinę, pozostawiając niskoprolinowe białka tworzące pianę w piwie[122]. Zawartość białek redukuje również użycie bentonitu, jednak nie zaleca się go stosować, ze względu na pogorszenie pienistości (usuwa wszystkie białka)[123]. Inną metodą jest zmiana stosunku białka-polifenole i wytrącanie kompleksów białkowo-polifenolowych w niskich temperaturach przez stosowanie białek bogatych w prolinę jak żelatyna, karuk lub odpowiednik piwnych polifenoli – gallotaninę (kwas taninowy).
Na tworzenie się kompleksów białkowo-fenolowych obok stężenia białek bogatych w prolinę i polifenoli ma wpływ pH i, w mniejszym stopniu, zawartość alkoholu[123].
Właściwości ściągające związków fenolowych
Polifenole, zwłaszcza flawonoidy mogą być przyczyną właściwości ściągających, cierpkości. Jest to złożone doznanie sensoryczne dające wrażenie wysuszania, ściągania, szorstkości na błonie śluzowej jamy ustnej[127][128]. Mechanizm chemiczny jego powstawania jest identyczny jak w przypadku zmętnień. Białka śliny pełniące rolę lubrykanta jamy ustnej, przede wszystkim te bogate w prolinę, wiążą się z polifenolami piwa, tworząc nierozpuszczalne kompleksy, co zmniejsza nawilżający potencjał śliny i wywołuje uczucie ściągania[127]. Powstawanie właściwości ściągających stymuluje tlen (utlenianie sprzyja polimeryzacji) oraz niskie pH piwa[129], natomiast temperatura przechowywania piwa nie ma większego znaczenia[127].
Lipidy
Lipidy wpływają na metabolizm drożdży i jakość piwa. Stężenia długołańcuchowych kwasów tłuszczowych są zwykle bardzo niskie w piwie, jednak mogą one wpływać na właściwości piwa. Zmętnienie brzeczki w dużym stopniu związane jest z obecnością kwasów tłuszczowych. Klarowanie się brzeczki pociąga za sobą zmniejszenie zawartości kwasów tłuszczowych, zwłaszcza długołańcuchowych oraz nienasyconych[130].
Kwas linolowy i kwas linolenowy tworzy w wyniku rozkładu niekorzystne związki związane ze starzeniem piwa, zwłaszcza przy nieodpowiednich warunkach przechowywania piwa (np. trans-2-nonenal)[131]. Rozkład ten polega na oksydacji enzymatycznej lub autoksydacji kwasów tłuszczowych. Ma to duży wpływ na tworzenie się związków karbonylowych. W enzymatycznym utlenianiu nienasyconych kwasów tłuszczowych biorą udział lipooksygenazy (LOX), których aktywność zależy od temperatury suszenia słodu, jego przechowywania oraz od warunków zacierania[132].
Lipidy wpływają niekorzystnie na stabilność piany. Ponadto nasycone kwasy tłuszczowe mogą przyczyniać się do występowania zjawiska gushingu. Jednakże w brzeczce fermentacyjnej lipidy, w tym długołańcuchowe nienasycone kwasy tłuszczowe, korzystnie wpływają na namnażanie się drożdży w warunkach beztlenowych i proces fermentacji[131].
Drożdże podczas fermentacji produkują średniołańcuchowe kwasy tłuszczowe takie jak kwas kapronowy, kaprylowy i kaprynowy. Są one źródłem nieprzyjemnego aromatu określanego jako zjełczały, kozi. Na ich produkcję wpływa szczep drożdży, ekstrakt początkowy, skład brzeczki i jej stopień napowietrzenia. Kwasy te wykazują efekt synergistyczny, więc ich niekorzystne działanie może ujawnić się nawet wtedy, gdy żaden nie przekroczy progu wyczuwalności[133][134]. Wyższe stężenia tych związków notuje się w piwach dolnej fermentacji[135].
Substancje pochodzenia chmielowego

W piwowarstwie wykorzystuje się żeńskie szyszki chmielu. Ich gruczoły wydzielnicze (lupulina) zawierają gorzkie żywice oraz olejki eteryczne, które wnoszą do piwa goryczkę i aromat[136][137]. Pogorszenie się z czasem aromatu, jak również pogorszenie się właściwości goryczki jest często głównym czynnikiem ograniczającym czas trwałości piwa i zdatności do jego przechowywania[138]. Tradycyjny podział chmieli wyróżnia chmiele goryczkowe i aromatyczne[136].
Substancje goryczkowe
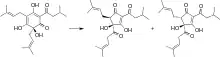
Żywice chmielowe zawierają α-kwasy i β-kwasy. Najważniejsze dla uzyskania goryczki są α-kwasy stanowiące 2–15% suchej masy chmielu, zależnie od odmiany i warunków uprawy. Pochodzi od nich na ogół około 80% goryczki piwa. Najważniejszymi związkami w grupie α-kwasów są humulon, kohumulon, adhumulon, a poza tym prehumulon i posthumulon. Różnią się one między sobą strukturą łańcucha bocznego[138].
α-kwasy muszą ulec izomeryzacji, aby przekształcić się w związki lepiej rozpuszczalne w wodzie[136][139]. Termiczna izomeryzacja α-kwasów do izo-α-kwasów (izohumulonu, izokohumulonu, izoadhumulonu) następuje podczas gotowania brzeczki. Tworzą się wówczas izomery cis i trans. Jednakże nie więcej niż 50% α-kwasów zostaje izomeryzowanych i nie więcej niż 25% początkowego potencjału goryczkowego pozostaje w piwie[138]. Izo-α-kwasy oprócz nadawania goryczki zwiększają stabilność mikrobiologiczną piwa, wykazując właściwości przeciwbakteryjne wobec bakterii gramdodatnich[140].
Podczas przechowywania piwa, spada udział trans-izo-α-kwasów, natomiast cis-izo-α-kwasy pozostają stabilne. Rozkład jest tym szybszy, im wyższa jest temperatura przechowywania piwa. Poziom goryczki również obniża się z czasem i staje się ona ostrzejsza, „zalegająca”. Substytutem izo-α-kwasów są dostępne na rynku ekstrakty zawierające zredukowane izo-α-kwasy, zapewniające goryczkę i większą stabilność. Mogą to być dihydro-, tetrahydro- lub heksahydroizo-α-kwasy[138].
β-kwasy to grupa związków, do których zalicza się lupulon, kolupulon, adlupulon, prelupulon i postlupulon. Są słabo rozpuszczalne w wodzie i nie ulegają izomeryzacji w przeciwieństwie do α-kwasów. W efekcie jedynie śladowe ich ilości są obecne w piwie[136].
Wbrew pozorom smak gorzki i smak słodki w piwie wykazują niską ujemną korelację, co oznacza, że dosładzanie gorzkich piw nie skutkuje zmniejszeniem wrażenia goryczki. Natężenie smaku gorzkiego wtedy się nie zmienia, zwiększa się jedynie wrażenie „pełni smaku”[94].
Olejki eteryczne
Chmiel zawiera 0,5–3% olejków eterycznych[136], których głównymi składnikami są terpeny i ich tlenowe pochodne[141]. W skład olejków wchodzą m.in.:
- monoterpeny, np. limonen (zapach cytryn), β-myrcen, α-pinen, p-cymen;
- alkohole terpenowe, np. linalol (zapach kwiatowy), geraniol, nerol (zapach róży), myrcenol;
- seskwiterpeny, np. farnezen, humulen, selinen, β-kariofilen;
- alkohole seskwiterpenowe, np. nerolidol, α-kadinol;
- aldehydy i ketony;
- estry;
- związki siarkowe, m.in. tioestry, siarczki[136].
Większość olejków eterycznych jest bardzo lotna i słabo rozpuszczalna w brzeczce. Ich obecność w piwie zależy od ich chemicznych właściwości i sposobu chmielenia. Przykładowo po 90 minutach gotowania 85–95% olejków wyparowuje, a reszta w dużej mierze polimeryzuje, tworząc żywice. Wiele traci się przez adsorpcję do komórek drożdży i filtrację. W rezultacie niewiele z nich występuje w piwie w niezmienionej formie[136]. W celu zwiększenia zawartości olejków w piwie stosuje się dodatkowo tzw. „chmielenie na zimno”, tj. dodawanie chmielu po fermentacji burzliwej. Należy jednak podkreślić, że zależność między zwiększaniem dawek chmielu a zawartością olejków eterycznych w finalnym piwie nie ma charakteru liniowego[142].
Związki siarkowe

Związki siarkowe wytworzone w wyniku metabolicznej aktywności drożdży mogą powstawać z przekształcania związków organicznych zawierających siarkę (aminokwasy siarkowe, witaminy) lub też mogą powstawać z nieorganicznych składników brzeczki (siarczany)[143]. Nielotne związki siarkowe mogą ulegać rozpadowi i przekształcać się w związki bardziej lotne, mające wpływ na aromat i jakość piwa. Źródłem niepożądanych związków siarkowych mogą być również infekcje bakteryjne[144]. Aromaty te opisywane są m.in. jako kapusta, czosnek, cebula, zgniłe jaja itp.[55] Poza tym lotnych związków siarkowych dostarczają słody oraz chmiele[145].
Dokładny mechanizm wytwarzania wielu związków siarkowych nie jest jeszcze dobrze poznany[146]. W dużym stopniu ich synteza wynika z enzymatycznych reakcji metabolizmu drożdży, dlatego istotny jest odpowiedni dobór szczepu drożdży[147].
Dwutlenek siarki
Dwutlenek siarki dobrze rozpuszcza się w wodzie i znajduje się tam w równowadze chemicznej pomiędzy SO
2·H
2O, SO−
3 i SO2−
3, która zależy od pH i temperatury. Obecność tych związków w piwie może wynikać z egzogennego dodatku siarczynów lub też mieć przyczynę w metabolizmie drożdży – siarczany obecne w środowisku mogą zostać przez nie zredukowane[148]. SO
2 ma właściwości antyoksydacyjne i przeciwbakteryjne dzięki czemu jest skutecznym środkiem konserwującym. Co więcej, może wiązać niepożądane związki karbonylowe (np. trans-2-nonenal), zmniejszając ich niekorzystny wpływ na właściwości sensoryczne piwa[149].
Wytwarzanie zarówno siarczynów SO2−
3, jak i siarczków S2−
jest zależne od szczepu drożdży, ale dokładne mechanizmy genetyczne tych przemian nie są znane[150]. Zazwyczaj szczepy S. cerevisiae produkują siarczyny w ilości 10–30 mg/l, ale niektóre mogą produkować je w stężeniu ponad 100 mg/l[151].
Siarkowodór
Siarkowodór jest niepożądanym produktem ubocznym metabolizmu drożdży o bardzo niskim progu wyczuwalności rzędu kilku ppb. Nadaje nieprzyjemny aromat zgniłych jaj[152]. Ponadto jest bardzo reaktywny i bierze udział w tworzeniu innych niepożądanych lotnych związków siarkowych[153], zatem nawet śladowe ilości tego związku chemicznego mogą mieć znaczny wpływ na jakość piwa[154]. U drożdży S. cerevisiae H
2S jest produkowany w szlaku SRS (ang. Sulfate Reduction Sequence)[55]. Jest ważnym metabolicznym prekursorem biosyntezy cysteiny i metioniny uruchamianej w warunkach niedoboru tych aminokwasów. Siarkowodór może również powstawać przez rozkład cysteiny bezpośrednio do siarczków przez desulfhydrazę cysteinową (ang. cysteine desulphydrase)[155] i uwalniać się podczas autolizy komórek[55]. Stężenie wyprodukowanego H
2S zależy od dostępności związków siarkowych, szczepu drożdży, warunków fermentacji i dostępności substancji odżywczych w środowisku[55][154].
Biosynteza aminokwasów siarkowych pochłania aniony siarczkowe. Kiedy jednak występuje niedobór azotu, zahamowana jest biosynteza aminokwasów, a aniony siarczkowe dyfundują z komórek w postaci siarkowodoru[156]. Na intensywność wytwarzania H
2S ma zatem wpływ obecność przyswajalnego azotu[155] oraz w mniejszym stopniu – kwasu pantotenowego w środowisku[152][157]. Kwas pantotenowy, przez uczestniczenie w syntezie koenzymu A, niezbędny jest do syntezy O-acetyloseryny (OAS) i O-acetylohomoseryny (OAH) – związków wiążących H
2S[55]. Dodatek azotu aminowego dostarcza drożdżom łatwo dostępnego źródła azotu i zmniejsza tworzenie się H
2S, jednakże duża ilość dostępnych aminokwasów siarkowych może zwiększać poziomy tego związku[151][158]. Pośrednio czynniki polepszające stan fizjologiczny drożdży jak wysoka zawartość tlenu, lipidów, zmniejszają produkcję H
2S. Nadmiar H
2S można usuwać przez umożliwienie kontaktu z miedzią, z którą związek ten tworzy nierozpuszczalny siarczek miedzi(II)[143][151].
Szlak SRS zapoczątkowuje transport siarczanów z medium do komórek drożdży przez permeazy siarczanowe (ang. sulfate permease). Siarczany są redukowane do siarczków przez ATP-sulfurylazę (EC 2.7.7.4[159]) i reduktazę siarczynową. Następnie O-acetyloseryna (OAS) i O-acetylohomoseryna (OAH) wiąże powstałe siarczki, tworząc odpowiednio cysteinę oraz homocysteinę, która to może dalej zostać przekształcona w metioninę. Enzym katalizujący reakcję wiązania siarczków przez O-acetyloserynę i O-acetylohomoserynę jest kodowany przez gen MET17. Inaktywacja tego genu powoduje zwiększenie wydzielania H
2S przez drożdże[153]. Nadekspresja tego genu powinna natomiast znacznie ograniczyć ilość uwalnianego H
2S, jednak nie we wszystkich szczepach zaobserwowano ten efekt[55][154].
Siarczek dimetylu
Siarczek dimetylu (DMS) to sulfid o zapachu gotowanych warzyw, zwłaszcza gotowanej kukurydzy lub kapusty. Próg wyczuwalności DMS wynosi około 30 µg/l[160]. Czasami jednak jego umiarkowane stężenia (poniżej 100 µg/l) są uznawane za korzystne[161].
Są dwie główne drogi powstawania DMS w piwie:
- S-metylometionina (SMM) zawarta w wielu roślinach, m.in. w kiełkującym jęczmieniu, pszenicy i owsie, rozpada się pod wpływem ciepła, uwalniając DMS. Ten sam mechanizm jest odpowiedzialny za uwalnianie tego związku w gotowanych warzywach. Poza tym niektóre grzyby i bakterie wytwarzają enzymy, które specyficznie hydrolizują związki sulfonowe do DMS.
- redukcja dimetylosulfotlenku (DMSO) do DMS przez mikroorganizmy[162].
Prekursory DMS – SMM i DMSO – pochodzą ze słodu. Niskiej zawartości prekursorów DMS w słodzie sprzyja niski stopień namoczenia, niska wilgotność oraz niska temperatura kiełkowania słodu i jego słabsze rozluźnienie[43]. SMM ulega rozkładowi termicznemu, dlatego jego stężenie jest niższe, kiedy podczas suszenia słodu używane są wyższe temperatury. W lagerach wyprodukowanych z jasnych, nieintensywnie suszonych słodów wada w postaci zbytniej wyczuwalności DMS w aromacie występuje częściej niż w innych rodzajach piw. DMS powstały na etapie suszenia słodu, podobnie jak ten uwalniający się w czasie gotowania brzeczki, ulatnia się[163]. Jeśli jednak DMS nie został do końca usunięty przy suszeniu ani w czasie gotowania brzeczki, lub jeśli w czasie klarowania brzeczki gorącej (w kadzi wirowej) ponownie został wytworzony z SMM, będzie on występował w piwie w stanie wolnym[164]. Część jednak ulotni się jeszcze podczas fermentacji wraz z innymi gazami[163]. Jeśli niedostatecznie usunięto DMS podczas wytwarzania słodu, nadrobienie tego podczas gotowania może okazać się niemożliwe, dlatego wymaga się, by zawartość SMM w słodzie jako prekursora DMS nie przekraczała 5 mg/kg[165].
Uwalniający się lotny DMS może utleniać się do nielotnego DMSO, który jest dobrze rozpuszczalny w wodzie i przechodzi do brzeczki podczas zacierania. Niektóre drożdże i bakterie są w stanie go potem zredukować z powrotem do DMS[163][164]. Zwykle drożdże redukują nie więcej niż 25% DMSO podczas fermentacji. Powstawanie DMS z DMSO jest zależne od wielu czynników, m.in. od szczepu drożdży, temperatury fermentacji (wydajniej w 8 °C niż 25 °C), pH (więcej powstaje w wyższym pH) i składu brzeczki. Piwo, które fermentuje w otwartych kadziach ma ostatecznie znacznie mniej DMS niż te fermentowane w zamkniętych tankofermentorach[162]. Wysokie stężenia łatwo przyswajalnego azotu utrzymują aktywność reduktaz DMSO na niskim poziomie[166]. Zakażenia bakteryjne sprzyjają znacznie podwyższonemu poziomowi DMS[162]. Sugeruje się, że enzymatyczne przekształcenie DMSO w DMS przez drożdże może być jego głównym źródłem w gotowym piwie[160].
Tiole

Chmiele są głównym źródłem tioli w piwie, ale spore ich ilości tworzą się również podczas gotowania brzeczki i fermentacji. Część występuje w formie związanej w postaci koniugatów cysteinowych, z których mogą uwalniać się lotne tiole przez aktywność β-liazy drożdży[167][168]. Rodzaj związanych tioli zależy od odmiany chmielu. Może to być m.in. 3-sulfanyloheksan-1-ol przypominający zapachem grejpfrut (występuje m.in. w odmianie Cascade, Amarillo, Citra, Mosaic, Saaz), 3-metylo-2-buten-1-tiol (3-MBT) przypominający zapach wydzieliny gruczołów skunksa (Tomahawk, Nelson Sauvin) oraz 4-metylopentan-2-on-4-tiol (4-metylo-4-merkaptopentan-2-on) (4-MMP), który przypomina koci mocz lub liście czarnej porzeczki[167][168].
W wyniku katabolizmu metioniny przez drożdże może powstawać metanotiol[169]. Ma on bardzo niskie progi wyczuwalności i przypomina zapachem zgniłe jaja lub kapustę[151]. W wyniku dekarboksylacji i redukcji metioniny powstaje metionol (3-(metylotio)-propan-1-ol)[169]. Ma on aromat określany jako cebulowy, bulionowy[170].
Wystawienie piwa na działanie promieniowania świetlnego może prowadzić do fotolizy izo-α-kwasów w obecności ryboflawiny oraz produkcji „skunksowego” aromatu – 3-metylo-2-buten-1-tiolu (3-MBT)[171]. Izo-α-kwasy ulegają rozpadowi najsilniej pod wpływem promieniowania UV w zakresie 280–320 nm lub pod wpływem światła niebieskiego (350–500 nm)[172]. Wiele polifenoli może ograniczać powstawanie tych niepożądanych związków[173], jak również częściową ochronę może stanowić brązowa butelka. Ochrony przed ich wytwarzaniem nie zapewnia jednak butelka przezroczysta i zielona. Jeśli jednak butelkuje się piwo do takich butelek, zaleca się używać w produkcji piwa zredukowanych izo-α-kwasów, które nie rozpadają się do związków tworzących nieprzyjemny aromat, bądź usunąć ryboflawinę z piwa[171]. Takie działania mogą zapobiegać powstawaniu 3-MBT, ale nadal pod wpływem światła mogą tworzyć się inne niekorzystne związki, przypominające w aromacie cebulę[172], m.in. metionol i 2-metylopropanal[174].
Tiole mogą wpływać zarówno pozytywnie, jak i negatywnie na aromat piwa; zależy to również od ich stężenia[175]. Są jednak niestabilnymi związkami zapachowymi w piwie. Mogą rozkładać się w bardzo dużym stopniu już w pierwszym roku przechowywania[168]. Ich dodatkowymi pozytywnymi właściwościami jest zwiększanie stabilności oksydacyjnej piwa i unieszkodliwianie rodnika hydroksyetylowego[176].
Przypisy
- ↑ Sohrabvandi S., Mortazavian A. M., Rezaei K. Advanced analytical methods for the analysis of chemical and microbiological properties of beer. „Journal of Food and Drug Analysis”. 19 (2), s. 202–222, 2011.
- ↑ Tian J. Determination of several flavours in beer with headspace sampling–gas chromatography. „Food Chemistry”. 123, s. 1318–1321, 2010. DOI: 10.1016/j.foodchem.2010.06.013.
- 1 2 Styger G., Prior B., Bauer F. F. Wine flavor and aroma. „Journal of Industrial Microbiology and Biotechnology”. 38 (9), s. 1145–1159, 2011. DOI: 10.1007/s10295-011-1018-4.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 Meussdoerffer F. G.: A Comprehensive History of Beer Brewing. W: Eßlinger H. M: Handbook of Brewing: Processes, Technology, Markets. Weinheim: Wiley-VCH, 2009, s. 1–33. DOI: 10.1002/9783527623488.ch1. ISBN 978-3-527-31674-8.
- ↑ Rasmussen S. C: The Quest for Aqua Vitae: The History and Chemistry of Alcohol from Antiquity to the Middle Ages. Springer International Publishing, 2014, s. 32–39. ISBN 978-3-319-06301-0.
- 1 2 Delyser D. Y., Kasper W. J. Hopped Beer: The Case For Cultivation. „Economic Botany”. 48 (2), s. 166–170, 1994. DOI: 10.1007/BF02908210.
- 1 2 3 4 Hornsey I. S: A History of Beer and Brewing. Cambridge: The Royal Society of Chemistry, 2003, s. 534–537. ISBN 0-85404-630-5.
- 1 2 3 4 Behre K. The history of beer additives in Europe – A review. „Vegetation History and Archaeobotany”. 8 (1), s. 35–48, 1999. DOI: 10.1007/BF02042841.
- 1 2 3 Rissanen M., Juha Tahvanainen J: Down Beer Street: History in a Pint Glass. Souvenir Press, 2016, s. 33–40. ISBN 978-0285643376.
- 1 2 Skene K. R., Sprent J. I., Raven J. A., Herdman L. Myrica gale L. „Journal of Ecology”. 88 (6), s. 1079–1094, 2000. DOI: 10.1046/j.1365-2745.2000.00522.x.
- 1 2 3 4 5 Unger R. W: Beer in the Middle Ages and the Renaissance. Philadelphia: University of Pennsylvania Press, 2007, s. 152–153. ISBN 978-0-8122-1999-9.
- 1 2 3 4 Jarząbek Z., Marczak J., Marczewski B. Skąd się w piwie wzięły drożdże?. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 4, s. 46–48, 2010.
- ↑ Hornsey I. S: A History of Beer and Brewing. Cambridge: The Royal Society of Chemistry, 2003, s. 621. ISBN 0-85404-630-5.
- ↑ Anselme Payen, [w:] Encyclopædia Britannica [dostęp 2017-04-23] (ang.).
- 1 2 3 4 5 6 7 Marjanowski J. Wymagania jakościowe wody do produkcji piwa oraz metody przygotowania wody w przemyśle piwowarskim. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 9, s. 10–12, 2011.
- 1 2 3 4 Grzech J. Uzdatnianie wody w browarnictwie. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 3, s. 17–19, 2010.
- 1 2 3 4 Water for Brewing. W: Lewis M. J., Young T. W: Brewing. New York: Springer US, 2001, s. 57–70. ISBN 978-1-4615-0729-1.
- 1 2 Krottenthaler M., Glas K: Brew Water. W: Eßlinger H. M: Handbook of Brewing: Processes, Technology, Markets. Weinheim: Wiley-VCH, 2009, s. 108–109. DOI: 10.1002/9783527623488.ch4. ISBN 978-3-527-31674-8.
- ↑ Brudzyński A. Znaczenie jakości wody w produkcji różnych gatunków piwa. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 7, s. 17, 1998.
- ↑ Summary of Target Water Profiles. Brewer’s Friend. [dostęp 2017-05-11]. (ang.).
- 1 2 Briggs i in. 2004 ↓, s. 65–68.
- ↑ Menz G., Aldred P., Vriesekoop F: Pathogens in Beer. W: Preedy V. R: Beer in Health and Disease Prevention. Elsevier Inc., 2008, s. 403–413. DOI: 10.1016/B978-0-12-373891-2.00039-0. ISBN 978-0-12-373891-2.
- ↑ Briggs i in. 2004 ↓, s. 610–628.
- ↑ Kunze 1999 ↓, s. 414–415.
- ↑ Buzrul S. A suitable model of microbial survival curves for beer pasteurization. „LWT – Food Science and Technology”. 40 (8), s. 1330–1336, 2007. DOI: 10.1016/j.lwt.2006.10.005.
- ↑ Kowalczyk R. I co dalej, branżo?. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 5–6, s. 7–8, 2013.
- ↑ Montanari L., Floridi S., Marconi O., Tironzelli M., Fantozzi P. Effect of mashing procedures on brewing. „European Food Research and Technology”. 221 (1), 2005. DOI: 10.1007/s00217-005-1166-8.
- 1 2 3 4 Rübsam H., Gastl M., Becker T. Determination of the influence of starch sources and mashing procedures on the range of the molecular weight distribution of beer using field-flow fractionation. „Journal of The Institute of Brewing”. 119 (3), s. 139–148, 2013. DOI: 10.1002/jib.69.
- 1 2 3 4 5 6 Ferreira I. M. P. L. V. O.: Beer Carbohydrates. W: Preedy V. R.: Beer in health and disease prevention. Burlington: Elsevier, 2009, s. 291–298. ISBN 978-0-12-373891-2.
- 1 2 van der Maarel M. J., van der Veen B., Uitdehaag J. C., Leemhuis H., Dijkhuizen L. Properties and applications of starch-converting enzymes of the alpha-amylase family. „Journal of Biotechnology”. 94 (2), s. 137–155, 2002. DOI: 10.1016/S0168-1656(01)00407-2.
- 1 2 3 4 5 6 Lewis M. J., Young T. W.: Piwowarstwo. Warszawa: Wydawnictwo Naukowe PWN, 2001, s. 104–118. ISBN 83-01-13472-0.
- 1 2 3 4 5 6 Pazera T., Rzemieniuk T.: Browarnictwo. Warszawa: Wydawnictwa Szkolne i Pedagogiczne, 1998, s. 118–128. ISBN 83-02-06930-2.
- 1 2 3 4 5 6 Gupta M., Abu-Ghannam N., Gallaghar E. Barley for brewing: Characteristic changes during malting, brewing and applications of its by-products. „Comprehensive Reviews in Food Science and Food Safety”. 9 (3), s. 318–328, 2010. DOI: 10.1111/j.1541-4337.2010.00112.x.
- 1 2 3 4 5 Kunze 1999 ↓, s. 172–173.
- ↑ Frank Vriesekoop F., Rathband A., MacKinlay J., Bryce J. H. The evolution of dextrins during the mashing and fermentation of all-malt whisky production. „Journal of The Institute of Brewing”. 116 (3), s. 230–238, 2010. DOI: 10.1002/j.2050-0416.2010.tb00425.x.
- ↑ Briggs i in. 2004 ↓, s. 409.
- 1 2 3 4 Cyran M., Izydorczyk M. S., A. W. MacGregor. Structural characteristics of water-extractable nonstarch polysaccharides from barley malt. „Cereal Chemistry Journal”. 79 (3), s. 359–366, 2002. DOI: 10.1094/CCHEM.2002.79.3.359.
- 1 2 3 4 5 6 Vanbenden N., Roey T. V., Willems F., Delvaux F., Delvaux F. R. Release of phenolic flavour precursors during wort production: Influence of process parameters and grist composition on ferulic acid release during brewing. „Food Chemistry”. 111 (1), s. 83–91, 2008. DOI: 10.1016/j.foodchem.2008.03.029.
- 1 2 3 Steiner E., Auer A., Becker T., Gastl M. Comparison of beer quality attributes between beers brewed with 100% barley malt and 100% barley raw material. „Journal of the Science of Food and Agriculture”. 92 (4), s. 803–813, 2012. DOI: 10.1002/jsfa.4651.
- 1 2 Steiner E., Gastl M., Becker T. Protein changes during malting and brewing with focus on haze and foam formation: a review. „European Food Research and Technology”. 232 (2), s. 191–204, 2011. DOI: 10.1007/s00217-010-1412-6.
- 1 2 3 Szwed Ł., Błażewicz J., Zembold-Guła A., Pelak M., Dawidowicz A. Wpływ frakcjonowania i czasu słodowania ziarna jęczmienia na liczbę Kolbacha słodów oraz zawartość wolnego azotu alfa-aminokwasowego w brzeczkach. „Żywność. Nauka. Technologia. Jakość”. 6 (67), s. 119–128, 2009.
- ↑ Baranowski K. Piana w piwie – to nie tylko parametr wizualny piwa!. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 6, s. 10, 2016.
- 1 2 Kunze 1999 ↓, s. 101–110.
- ↑ Ragot F., Guinard J. X., Shoemaker C. F., Lewis M. J. The contribution of dextrins to beer sensory properties part I. Mouthfeel. „Journal of The Institute of Brewing”. 95 (6), s. 427–430, 1989. DOI: 10.1002/j.2050-0416.1989.tb04650.x.
- 1 2 3 Kyselová L., Brányik T: Quality improvement and fermentation control in beer. W: Holzapfel W: Advances in Fermented Foods and Beverages. Elsevier Ltd., 2015, s. 477–500. DOI: 10.1016/B978-1-78242-015-6.00020-7. ISBN 978-1-78242-015-6.
- 1 2 3 Piddocke M. P., Kreisz S., Heldt-Hansen H. P., Nielsen K. F., Olsson L. Physiological characterization of brewer’s yeast in high-gravity beer fermentations with glucose or maltose syrups as adjuncts. „Applied Microbiology and Biotechnology”. 84, s. 453–464, 2009. DOI: 10.1007/s00253-009-1930-y.
- 1 2 Kunze 1999 ↓, s. 432–433.
- ↑ Salamon A. Jakość surowców i kontrola procesu w aspekcie zapewniania stabilności sensorycznej piwa, cz. 1. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 9, s. 12–14, 2012.
- ↑ Lambrechts M. G., Pretorius I. S. Yeast and its importance to wine aroma – a review. „South African Journal of Enology and Viticulture”. 21, s. 97–129, 2000.
- 1 2 Jackowetz J. N., Dierschke S., Mira de Orduña R. Multifactorial analysis of acetaldehyde kinetics during alcoholic fermentation by Saccharomyces cerevisiae. „Food Research International”. 44 (1), s. 310–316, 2011. DOI: 10.1016/j.foodres.2010.10.014.
- 1 2 Wang J., Shen N., Yin H., Liu C., Li Y., Li Q. Development of industrial brewing yeast with low acetaldehyde production and improved flavor stability. „Applied Biochemistry and Biotechnology”. 169 (3), s. 1016–1025, 2013. DOI: 10.1007/s12010-012-0077-y.
- ↑ Meilgaard M. C., Dalgliesh C. E., Clapperton J. F. Beer flavour terminology. „Journal of the Institute of Brewing”. 85 (1), s. 38–42, 1979. DOI: 10.1002/j.2050-0416.1979.tb06826.x.
- ↑ Briggs i in. 2004 ↓, s. 547.
- ↑ de Smidt O., du Preez J. C., Albertyn J. Molecular and physiological aspects of alcohol dehydrogenases in the ethanol metabolism of Saccharomyces cerevisiae. „FEMS Yeast Research”. 12 (1), s. 33–47, 2012. DOI: 10.1111/j.1567-1364.2011.00760.x.
- 1 2 3 4 5 6 7 Swiegers J. H., Bartkowsky E. J., Henschke P. A., Pretorius I. S. Yeast and bacterial modulation of wine aroma and flavour. „Australian Journal of Grape and Wine Research”. 11 (2), s. 139–173, 2005. DOI: 10.1111/j.1755-0238.2005.tb00285.x.
- ↑ Kucharczyk K., Tuszyński T. Aldehydy i wpływ wybranych czynników na ich zawartość w piwie. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 10, s. 8–10, 2011.
- ↑ Romano P., Suzzi G., Turbanti L., Polsinelli M. Acetaldehyde production in Saccharomyces cerevisiae wine yeasts. „FEMS Microbiology Letters”. 118 (3), s. 213–218, 1994.
- ↑ Bartowsky E. J., Pretorius I. S.: Microbial formation and modification of flavor and off-flavor compounds in wine. W: König H., Unden G., Fröhlich J.: Biology of microorganisms on grapes, in must and in wine. Heidelberg: Springer-Verlag, 2009, s. 209–231. ISBN 978-3-540-85462-3.
- ↑ Vanderhaegen B., Delvaux F., Daenen L., Verachtert H., Delvaux F. R. Aging characteristics of different beer types. „Food Chemistry”. 103 (2), s. 404–412, 2007. DOI: 10.1016/j.foodchem.2006.07.062.
- ↑ Kuchel L., Brody A. L., Wicker L. Oxygen and its reactions in beer. „Packaging Technology and Science”. 19 (1), s. 25–32, 2006. DOI: 10.1002/pts.705.
- ↑ Andersen M. L., Skibsted L. H. Electron spin resonance spin trapping identification of radicals formed during aerobic forced aging of beer. „Journal of Agricultural and Food Chemistry”. 46 (4), s. 1272–1275, 1998.
- ↑ Hashimoto N., Kuroiwa Y. Proposed pathways for the formation of volatile aldehydes during storage of bottled beer. „Proceedings of the American Society of Brewing Chemists”. 33, s. 104–111, 1975.
- ↑ Barker R. L., Gracey D. E. F., Irwin A. J., Pipasts P., Leiska E. Liberation of staling aldehydes during storage of beer. „Journal of the Institute of Brewing”. 89 (6), s. 411–415, 1983. DOI: 10.1002/j.2050-0416.1983.tb04216.x.
- ↑ Vanderhaegen B., Neven H., Verachtert H., Derdelinckx G. The chemistry of beer aging – a critical review. „Food Chemistry”. 95 (3), s. 357–381, 2006. DOI: 10.1016/j.foodchem.2005.01.006.
- 1 2 3 4 Bamforth C. W., Kanauchi M. Enzymology of vicinal diketone reduction in brewer’s yeast. „Journal of the Institute of Brewing”. 110 (2), s. 83–93, 2004. DOI: 10.1002/j.2050-0416.2004.tb00187.x.
- 1 2 Lodolo E. J., Kock J. L., Axcell B. C., Brooks M. The yeast Saccharomyces cerevisiae – the main character in beer brewing. „FEMS Yeast Research”. 8 (7), s. 1018–1036, 2008. DOI: 10.1111/j.1567-1364.2008.00433.x.
- 1 2 3 4 5 6 7 8 9 Krogerus K., Gibson B. R. 125th Anniversary Review: Diacetyl and its control during brewery fermentation. „Journal of the Institute of Brewing”. 119, s. 86–97, 2013. DOI: 10.1002/jib.84.
- ↑ Barton S., Slaughter J.C. Amino acids and vicinal diketone concentration during fermentation. „Master Brewers Association of The Americas Technical Quarterly”. 29 (2), s. 60–63, 1992.
- ↑ Bartowsky E. J., Henschke P. A. The ‘buttery’ attribute of wine–diacetyl–desirability, spoilage and beyond. „International Journal of Food Microbiology”. 96 (3), s. 235–252, 2004. DOI: 10.1016/j.ijfoodmicro.2004.05.013.
- ↑ Kobayashi K., Kusaka K., Takahashi T., Sato K. Method for the simultaneous assay of diacetyl and acetoin in the presence of α-acetolactate: application in determining the kinetic parameters for the decomposition of α-acetolactate. „Journal of Bioscience and Bioengineering”. 99 (5), s. 502–507, 2005. DOI: 10.1263/jbb.99.502.
- 1 2 Brányik T., Vicente A. A., Dostálek P., Teixeira J. A. Continuous beer fermentation using immobilized yeast cell bioreactor systems. „Biotechnology Progress”. 21 (3), s. 653–663, 2005. DOI: 10.1021/bp050012u.
- ↑ Lekkas C., Stewart G. G. Hill A. E., Taidi B., Hodgson J. Elucidation of the role of nitrogenous wort components in yeast fermentation. „Journal of the Institute of Brewing”. 113 (1), s. 3–8, 2007. DOI: 10.1002/j.2050-0416.2007.tb00249.x.
- 1 2 3 Krogerus K., Gibson B. R. Influence of valine and other amino acids on total diacetyl and 2,3-pentanedione levels during fermentation of brewer’s wort. „Applied Microbiology and Biotechnology”. 97 (15), s. 6919–6930, 2013. DOI: 10.1007/s00253-013-4955-1.
- ↑ Samaras T. S., Camburn P. A., Chandra S. X., Gordon M. H., Ames J. M. „Journal of agricultural and food chemistry”. 53 (20), s. 8068–8074, 2005.
- ↑ de Revel G., Bertrand A.: Dicarbonyl compounds and their reduction products in wine. Identification of wine aldehydes. W: Maarse H., van der Heij D. G.: Trends in Flavour Research. Amsterdam: Elsevier, 1994, s. 353–361. ISBN 978-0-444-81587-3.
- 1 2 Boulton C., Box W.: Formation and disappearance of diacetyl during lager fermentation. W: Smart K.: Brewing Yeast Fermentation Performance. Oxford: Blackwell Science, 2003, s. 183–195. DOI: 10.1002/9780470696040.ch18. ISBN 978-0-470-69604-0.
- ↑ Bamforth C. W. pH in brewing: an overview. „Master Brewers Association of The Americas Technical Quarterly”. 38 (1), s. 1–9, 2001.
- ↑ Briggs i in. 2004 ↓, s. 545.
- ↑ Lewis J., Young T. W.: Piwowarstwo. Warszawa: Wydawnictwo Naukowe PWN, 2001, s. 169. ISBN 83-01-13472-0.
- 1 2 Andrés-Iglesias C., Nešpor J., Karabín M., Montero O., Blanco C. A., Dostálek P. Comparison of carbonyl profiles from Czech and Spanish lagers: Traditional and modern technology. „LWT – Food Science and Technology”. 66, s. 390–397, 2016. DOI: 10.1016/j.lwt.2015.10.066.
- ↑ Clark R. A., Hewson L., Bealin-Kelly F., Hort J. The Interactions of CO2, Ethanol, Hop Acids and Sweetener on Flavour Perception in a Model Beer. „Chemosensory Perception”. 4 (1), s. 42–54, 2011. DOI: 10.1007/s12078-011-9087-3.
- ↑ Langstaff S. A., Lewis M. J. The mouthful of beer – a review. „Journal of the Institute of Brewing”. 99, s. 31–37, 1993.
- ↑ Perpète P., Collin S. Influence of beer ethanol content on the wort favour perception. „Food Chemistry”. 71 (3), s. 379–385, 2000.
- ↑ Scopes R. K.: Effects of ethanol on glucolytic enzymes. W: van Uden, N.: Alcohol toxicity in yeast and bacteria. Boca Raton: CRC Press, 1988, s. 89–109. ISBN 978-0-8493-5167-9.
- 1 2 Nedović V., Gibson B., Mantzouridou T. F., Bugarski B., Djordjević V., Kalušević A., Paraskevopoulou A., Sandell M., Smogrovičová D., Yilmaztekin M. Aroma formation by immobilized yeast cells in fermentation processes. „Yeast”. 32 (1), s. 173–216, 2015. DOI: 10.1002/yea.3042.
- 1 2 3 4 5 Briggs i in. 2004 ↓, s. 459–462.
- 1 2 3 4 5 6 7 8 9 10 Pires E. J., Teixeira J. A., Brányik T., Vicente A. A. Yeast: the soul of beer’s aroma--a review of flavour-active esters and higher alcohols produced by the brewing yeast. „Applied microbiology and biotechnology”. 98 (5), s. 1937–1949, 2014. DOI: 10.1007/s00253-013-5470-0.
- ↑ Hazelwood L. A., Daran J. M., van Maris A. J. A., Pronk J. T., Dickinson J. R. The Ehrlich Pathway for fusel alcohol production: a century of research on Saccharomyces cerevisiae metabolism. „Applied and Environmental Microbiology”. 74 (8), s. 2259–2266, 2008. DOI: 10.1128/AEM.02625-07.
- ↑ Pietruszka, M. Pielech-Przybylska, K. Szopa, J. S. Synthesis of higher alcohols during alcoholic fermentation of rye mashes. „Zeszyty Naukowe. Chemia Spożywcza i Biotechnologia”. 74, s. 51–64, 2010.
- ↑ Boer V. M., Tai S. L., Vuralhan Z., Arifin Y., Walsh M. C., Piper M. D., de Winde J. H., Pronk J. T., Daran J. M. Transcriptinal responses of Saccharomyces cerevisiae to preferred and nonpreferred nitrogen sources in glucose-limited chemostat cultures. „FEMS Yeast Research”. 7 (4), s. 604–620, 2007.
- ↑ Romano P., Suzzi G., Comi G., Zironi R. Higher alcohol and acetic acid production by apiculate wine yeasts. „Journal of Applied Bacteriology”. 73 (2), s. 126–130, 1992. DOI: 10.1111/j.1365-2672.1992.tb01698.x.
- 1 2 Saison D., De Schutter D. P., Uyttenhove B., Delvaux F., Delvaux F. R. Contribution of staling compounds to the aged flavour of lager beer by studying their flavour thresholds. „Food Chemistry”. 114 (4), s. 1206–1215, 2009. DOI: 10.1016/j.foodchem.2008.10.078.
- 1 2 Meilgaard M. C. Flavour chemistry of beer. Part 1: Flavour interactions between principle volatiles. „Master Brewers Association of The Americas Technical Quarterly”. 12, s. 107–117, 1975.
- 1 2 Chołdrych M. Zależności sensoryczne – analiza korelacji pomiędzy wyróżnikami sensorycznymi w różnych gatunkach piwa, cz.1. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 9, s. 13, 2011.
- 1 2 3 Saerens S., Thevelein J., Delvaux F. Ethyl ester production during brewery fermentation: a review. „Cerevisia”. 33 (2), s. 82–90, 2008.
- ↑ Mason A. B., Dufour J.P. Alcohol acetyltransferases and the significance of ester synthesis in yeast. „Yeast”. 16 (14), s. 1287–1298, 2000.
- ↑ Spaepen M., Vanoevelen D., Verachtert H. Fatty-acids and esters produced during spontaneous fermentation of lambic and gueuze. „Journal of the Institute of Brewing”. 84, s. 278–282, 1978.
- 1 2 Hiralal L., Olaniran A. O., Pillay B. Aroma-active ester profile of, ale beer produced under different fermentation and nutritional conditions. „Journal of Bioscience and Bioengineering”. 117 (1), s. 57–64, 2014. DOI: 10.1016/j.jbiosc.2013.06.002.
- ↑ Lei H., Zheng L., Wang C., Zhao H., Zhao M. Effects of worts treated with proteases on the assimilation of free amino acids and fermentation performance of lager yeast. „International Journal of Food Microbiology”. 161 (2), s. 57–64, 2014. DOI: 10.1016/j.ijfoodmicro.2012.11.024.
- ↑ Landaud S., Latrille E., Corrieu G. Top pressure and temperature control the fusel alcohol/ester ratio through yeast growth in beer fermentation. „Journal of the Institute of Brewing”. 107 (2), s. 107–117, 2001. DOI: 10.1002/j.2050-0416.2001.tb00083.x.
- ↑ Kiyoshi Fukuda K. Yamamoto N., Kiyokawa Y., Yanagiuchi T., Wakai Y., Kitamoto K., Inoue Y., Kimura A. Brewing properties of sake yeast whose EST2 gene encoding isoamyl acetate-hydrolyzing esterase was disrupted. „Journal of Fermentation and Bioengineering”. 85 (1), s. 101–106, 1998. DOI: 10.1016/S0922-338X(97)80362-5.
- ↑ Zhang C. Y., Liu Y. L., Qi Y. N., Zhang J. W., Dai L. H., Lin X., Xiao D. G. Increased esters and decreased higher alcohols production by engineered brewer’s yeast strains. „European Food Research and Technology”. 236 (6), s. 1009–1014, 2013. DOI: 10.1007/s00217-013-1966-1.
- ↑ Kobayashi M., Shimizu H., Shioya S. Beer volatile compounds and their application to low-malt beer fermentation. „Journal of Bioscience and Bioengineering”. 106 (4), s. 317–323, 2008. DOI: 10.1263/jbb.106.317.
- 1 2 Collin S., Jerkovic V., Bröhan M., Callemien D.: Polyphenols and beer quality. W: Ramawat K. G., Mérillon J. M.: Natural Products. Heidelberg: Springer Verlag, 2013, s. 2333–2359. ISBN 978-3-642-22143-9.
- ↑ Gerhäuser C., Becker H.: Phenolic Compounds in Beer. W: Preedy V. R.: Beer in health and disease prevention. Burlington: Elsevier, 2009, s. 124–144. ISBN 978-0-12-373891-2.
- ↑ Pereira D. M., Valentão P., Pereira J. A., Andrade P. B. Phenolics: From chemistry to biology. „Molecules”. 14, s. 2202–2211, 2009. DOI: 10.3390/molecules14062202.
- 1 2 Sterckx F. L., Missiaen J., Saison D., Delvaux F. R. Contribution of monophenols to beer flavour based on flavour thresholds, interactions and recombination experiments. „Food Chemistry”. 126 (4), s. 1679–1685, 2011. DOI: 10.1016/j.foodchem.2010.12.055.
- 1 2 3 4 5 6 Vanbenden N., Gils F., Delvaux F., Delvaux F. R. Formation of 4-vinyl and 4-ethyl derivatives from hydroxycinnamic acids: Occurrence of volatile phenolic flavour compounds in beer and distribution of Pad1-activity among brewing yeasts. „Food Chemistry”. 107 (1), s. 221–230, 2008. DOI: 10.1016/j.foodchem.2007.08.008.
- ↑ Breslin P. A. S. Human gustation and flavour. „Flavour and Fragrance Journal”. 16 (6), s. 439–456, 2001. DOI: 10.1002/ffj.1054.
- ↑ Enzyme entry: EC 3.1.1.73, [w:] Enzyme nomenclature database, SIB Swiss Institute of Bioinformatics (ang.).
- ↑ McMurrough I., Madigan D., Donnelly D., Hurley J., Doyle A., Hennigan G., McNulty N. Control of ferulic acid and 4-vinyl guaiacol in brewing. „Journal of the Institute of Brewing”. 102 (5), s. 327–332, 1996. DOI: 10.1002/j.2050-0416.1996.tb00918.x.
- ↑ Harris V., Ford C. M., Jiranek V., Grbin P. R. Survey of enzyme activity responsible for phenolic off-flavour production by Dekkera and Brettanomyces yeast. „Applied Microbiology and Biotechnology”. 81 (6), s. 1117–1127, 2009. DOI: 10.1007/s00253-008-1708-7.
- ↑ Edlin D. A. N., Narbad A., Dickinson J. R., Lloyd D. The biotransformation of simple phenolic compounds by Brettanomyces anomalus. „FEMS Microbiology letters”. 125 (2–3), s. 311–315, 1995. DOI: 10.1016/0378-1097(94)00516-T.
- 1 2 Zhao H., Li H., Sun G., Yang B., Zhao M. Assessment of endogenous antioxidative compounds and antioxidant activities of lager beers. „Journal of the science of food and agriculture”. 93 (4), s. 910–917, 2013. DOI: 10.1002/jsfa.5824.
- 1 2 3 Fumi M. D., Galli R., Lambri M., Donadini G., De Faveri D. M. Effect of full-scale brewing process on polyphenols in Italian all-malt and maize adjunct lager beers. „Journal of Food Composition and Analysis”. 24 (4–5), s. 568–573, 2011. DOI: 10.1016/j.jfca.2010.12.006.
- ↑ Gorinstein Sh., Caspi A., Zemser M., Trakhtenberg S. Comparative contents of some phenolics in beer, red and white wines. „Nutrition Research”. 20 (1), s. 131–139, 2000. DOI: 10.1016/S0271-5317(99)00145-1.
- 1 2 Leitao C., Marchioni E., Bergaentzlé M., Zhao M., Didierjean L., Miesch L., Holder E., Miesch M., Ennahar S. Fate of polyphenols and antioxidant activity of barley throughout malting and brewing. „Journal of Cereal Science”. 55 (3), s. 318–322, 2012. DOI: 10.1016/j.jcs.2012.01.002.
- ↑ Philip Wietstock, Thomas Kunz, Thomas Shellhammer, Thore Schön i inni. Behaviour of Antioxidants Derived from Hops During Wort Boiling. „Journal of the Institute of Brewing”. 116 (2), s. 157–166, 2010. Wiley. DOI: 10.1002/j.2050-0416.2010.tb00412.x. ISSN 0046-9750. (ang.).
- ↑ Sanna V., Pretti L. Effect of wine barrel ageing or sapa addition on total polyphenol content and antioxidant activities of some Italian craft beers. „International Journal of Food Science & Technology”. 50 (3), s. 700–707, 2015. DOI: 10.1111/ijfs.12666.
- 1 2 Lermusieau G., Liégeois C., Collin S. Reducing power of hop cultivars and beer ageing. „Food Chemistry”. 72 (4), s. 413–418, 2001. DOI: 10.1016/S0308-8146(00)00247-8.
- ↑ Liégeois C., Meurens N., Badot C., Collin S. Release of deuterated (E)-2-nonenal during beer aging from labeled precursors synthesized before boiling. „Journal of Agricultural and Food Chemistry”. 50 (26), s. 7634−7638, 2002. DOI: 10.1021/jf020617v.
- 1 2 3 Leiper K. A., Stewart G. G., McKeown I. P., Nock T., Thompson M. J. Optimising beer stabilisation by the selective removal of tannoids and sensitive proteins. „Journal of the Institute of Brewing”. 111 (2), s. 118–127, 2005. DOI: 10.1002/j.2050-0416.2005.tb00657.x.
- 1 2 3 4 5 6 Siebert K. J. Haze formation in beverages. „LWT – Food Science and Technology”. 39 (9), s. 987–994, 2006. DOI: 10.1016/j.lwt.2006.02.012.
- 1 2 3 4 5 Mikyška A., Hrabák M., Hašková D., Šrogl J. The role of malt and hop polyphenols in beer quality, flavour and haze stability. „Journal of the Institute of Brewing”. 108 (1), s. 78–85, 2002. DOI: 10.1002/j.2050-0416.2002.tb00128.x.
- ↑ McMurrough I., O’Rourke T. New insight into the mechanism of achieving colloidal stability. „Master Brewers Association of The Americas Technical Quarterly”. 34 (1), s. 271–277, 1997.
- ↑ Siebert K. J., Lynn P. Y. Mechanisms of beer colloidal stabilization. „Journal of the American Society of Brewing Chemists”. 55 (2), s. 73–78, 1997. DOI: 10.1094/ASBCJ-55-0073.
- 1 2 3 François N., Guyot-Declerck Ch., Hug B., Callemien D., Govaerts B., Collin S. Beer astringency assessed by time–intensity and quantitative descriptive analysis: Influence of pH and accelerated aging. „Food Quality and Preference”. 17 (6), s. 445–452, 2006. DOI: 10.1016/j.foodqual.2005.05.008.
- ↑ Kleopatra Chira, Michael Jourdes, Pierre-Louis Teissedre. Cabernet sauvignon red wine astringency quality control by tannin characterization and polymerization during storage. „European Food Research and Technology”. 234 (2), s. 253–261, 2011-11-30. Springer Nature. DOI: 10.1007/s00217-011-1627-1. ISSN 1438-2377. (ang.).
- ↑ Callemien D., Bennani M., Counet C., Collin S. Which polyphenols are involved in aged beer astringency? Assessment by HPLC and time-intensity method. „European Brewery Convention”. 90, s. 809–814, 2005.
- ↑ Gibson B. R. 125th Anniversary Review: Improvement of Higher Gravity Brewery Fermentation via Wort Enrichment and Supplementation. „Journal of The Institute of Brewing”. 117 (3), s. 268–284, 2011. DOI: 10.1002/j.2050-0416.2011.tb00472.x.
- 1 2 Bravi E., Benedetti P., Marconi O., Perretti G. Determination of free fatty acids in beer wort. „Food Chemistry”. 151, s. 374–378, 2014. DOI: 10.1016/j.foodchem.2013.11.063.
- ↑ Michałowska D. Lipooksygenazy a stabilność sensoryczna piwa. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 3, s. 18–19, 2012.
- ↑ Bravi E., Marconi O., Sileoni V., Perretti G. Determination of free fatty acids in beer. „Food Chemistry”. 215 (15), s. 341–346, 2017. DOI: 10.1016/j.foodchem.2016.07.153.
- ↑ Horák T., Čulík J., Jurková M., Čejka P., Kellner V. Determination of free medium-chain fatty acids in beer by stir bar sorptive extraction. „Journal of chromatography A”. 1196–1197, s. 96–99, 2008. DOI: 10.1016/j.chroma.2008.05.014.
- ↑ Clapperton J. F., Brown D. G. W. Caprylic flavour as a feature of beer flavour. „Journal of The Institute of Brewing”. 84 (2), s. 90–92, 1978. DOI: 10.1002/j.2050-0416.1978.tb03844.x.
- 1 2 3 4 5 6 7 Caballero I., Blanco C. A., Porras M. Iso-a-acids, bitterness and loss of beer quality during storage. „Trends in Food Science & Technology”. 26, s. 21–30, 2012. DOI: 10.1016/j.tifs.2012.01.001.
- ↑ Kunze 1999 ↓, s. 18–19.
- 1 2 3 4 Almaguer C., Schönberger C., Gasti M., Arendt E. K., Becker T. Humulus lupulus – a story that begs to be told. A review. „Journal of The Institute of Brewing”. 120 (4), s. 289–314, 2014. DOI: 10.1002/jib.160.
- ↑ Kunze 1999 ↓, s. 22–36.
- ↑ Sakamoto K., Konings W. N. Beer spoilage bacteria and hop resistance. „International Journal of Food Microbiology”. 89 (2–3), s. 105–124, 2003. DOI: 10.1016/S0168-1605(03)00153-3.
- ↑ Kovačevič M., Kač M. Determination and verification of hop varieties by analysis of essential oils. „Food Chemistry”. 77 (4), s. 489–494, 2002. DOI: 10.1016/S0308-8146(02)00114-0.
- ↑ Baranowski K. Wpływ różnych parametrów technologicznych na proces chmielenia piwa na zimno. „Przemysł Fermentacyjny i Owocowo-Warzywny”. 5–6, s. 6, 2013.
- 1 2 Briggs i in. 2004 ↓, s. 462–465.
- ↑ Hill P. G., Smith R. M. Determination of sulphur compounds in beer using headspace solid-phase microextraction and gas chromatographic analysis with pulsed flame photometric detection. „Journal of Chromatography A”. 872 (1–2), s. 203–213, 2000. DOI: 10.1016/S0021-9673(99)01307-2.
- ↑ Anderson R. J., Howard G. A. The origin and occurrence of volatile sulphur compounds in british ales and lagers. „Journal of The Institute of Brewing”. 80 (4), s. 357–370, 1974. DOI: 10.1002/j.2050-0416.1974.tb03630.x.
- ↑ Suárez-Lepe J. A., Morata A. New trends in yeast selection for winemaking. „Trends in Food Science & Technology”. 23 (1), s. 39–50, 2012. DOI: 10.1016/j.tifs.2011.08.005.
- ↑ Nikolaou E., Soufleros E. H., Bouloumpasi E., Tzanetakis N. Selection of indigenous Saccharomyces cerevisiae strains according to their oenological characteristics and vinification results. „Food Microbiology”. 23 (2), s. 205–211, 2006. DOI: 10.1016/j.fm.2005.03.004.
- ↑ Guido L. F. Sulfites in beer: reviewing regulation, analysis and role. „Scientia Agricola”. 73 (2), s. 189–197, 2016. DOI: 10.1590/0103-9016-2015-0290.
- ↑ Ilett D. R. Aspects of the analysis, role and fate of sulphur dioxide in beer – a review. „Master Brewers Association of The Americas Technical Quarterly”. 32 (4), s. 213–221, 1995.
- ↑ Noble J., Sanchez I., Blondin B. Identification of new Saccharomyces cerevisiae variants of the MET2 and SKP2 genes controlling the sulfur assimilation pathway and the production of undesirable sulfur compounds during alcoholic fermentation. „Microbial Cell Factories”. 14 (68), s. 1–16, 2015. DOI: 10.1186/s12934-015-0245-1.
- 1 2 3 4 Rauhut D.: Yeasts – Production of sulfur compounds. W: Fleet G. H.: Wine microbiology and biotechnology. Padstow: Taylor & Francis, 1993, s. 183–213. ISBN 978-0-415-27850-8.
- 1 2 Fugelsang K. C., Edwards C. G.: Wine microbiology. Practical applications and procedures. Fresno: Springer, 2007, s. 128–129. ISBN 978-0-387-33341-0.
- 1 2 Kinzurik M. I., Herbst-Johnstone M., Gardnerb R. C., Fedrizzi B. Hydrogen sulfide production during yeast fermentation causes the accumulation of ethanethiol, S-ethyl thioacetate and diethyl disulfide. „Food Chemistry”. 209, s. 341–347, 2016. DOI: 10.1016/j.foodchem.2016.04.094.
- 1 2 3 Spiropoulos A., Bisson L. F. MET17 and hydrogen sulfide formation in Saccharomyces cerevisiae. „Applied and Environmental Microbiology”. 66 (10), s. 4421–4426, 2000.
- 1 2 Moreira N., Mendes F., Pereira O., Guedes de Pinho P., Hogg T., Vasconcelos I. Volatile sulphur compounds in wines related to yeast metabolism and nitrogen composition of grape musts. „Analytica Chimica Acta”. 458 (1), s. 157–167, 2002. DOI: 10.1016/S0003-2670(01)01618-X.
- ↑ Jiranek V., Langridge P., Henschke P. A. Determination of sulphite reductase activity and its response to assimilable nitrogen status in a commercial Saccharomyces cerevisiae wine yeast. „The Journal of Applied Bacteriology”. 81 (3), s. 329–336, 1996. DOI: 10.1111/j.1365-2672.1996.tb04335.x.
- ↑ X.D. Wang, J.C. Bohlscheid, C.G. Edwards. Fermentative activity and production of volatile compounds by Saccharomyces grown in synthetic grape juice media deficient in assimilable nitrogen and/or pantothenic acid. „Journal of Applied Microbiology”. 94 (3), s. 349–359, 2003. Wiley. DOI: 10.1046/j.1365-2672.2003.01827.x. ISSN 1364-5072. (ang.).
- ↑ Winter G., Cordente A. G., Curtin C. Formation of hydrogen sulfide from cysteine in Saccharomyces cerevisiae BY4742: genome wide screen reveals a central role of the vacuole. „PloS One”. 9 (12), 2014. DOI: 10.1371/journal.pone.0113869.
- ↑ Enzyme entry: EC 2.7.7.4, [w:] Enzyme nomenclature database, SIB Swiss Institute of Bioinformatics (ang.).
- 1 2 Hansen J., Bruun S. V., Bech L. M., Gjermansen C. The level of MXR1 gene expression in brewing yeast during beer fermentation is a major determinant for the concentration of dimethyl sulfide in beer. „FEMS Yeast Research”. 2 (2), s. 137–149, 2002. DOI: 10.1111/j.1567-1364.2002.tb00078.x.
- ↑ Zhao F. J., Fortune S., Barbosa V. L., McGrath S. P., Stobart R., Bilsborrow P. E., Booth E. J., Brown A., Robson P. Effects of sulphur on yield and malting quality of barley. „Journal of Cereal Science”. 43 (3), 2006. DOI: 10.1016/j.jcs.2005.12.003.
- 1 2 3 Anness B. J., Bamforth C. W. Dimethyl sulphide – a review. „Journal of The Institute of Brewing”. 88 (4), s. 244–252, 1982. DOI: 10.1002/j.2050-0416.1982.tb04101.x.
- 1 2 3 Bamforth C. W.: Beer. W: Bamforth C. W.: Food, Fermentation and Micro-organisms. Oxford: Blackwell Science, 2005, s. 82–83. DOI: 10.1002/9780470995273.ch2. ISBN 978-0-632-05987-4.
- 1 2 Kunze 1999 ↓, s. 123–127.
- ↑ Kunze 1999 ↓, s. 236–237.
- ↑ Hansen J. Inactivation of MXR1 abolishes formation of dimethyl sulfide from dimethyl sulfoxide in Saccharomyces cerevisiae. „Applied and Environmental Microbiology”. 65 (9), s. 3915–3919, 1999.
- 1 2 Gros J., Tran T. T. H., Collin S. Enzymatic release of odourant polyfunctional thiols from cysteine conjugates in hop. „Journal of The Institute of Brewing”. 119 (4), s. 221–227, 2013. DOI: 10.1002/jib.80.
- 1 2 3 Tran T. T. H., M. L. K. Cibaka, Collin S. Polyfunctional thiols in fresh and aged Belgian special beers: Fate of hop S-cysteine conjugates. „Journal of the American Society of Brewing Chemists”. 73 (1), s. 61–70, 2015. DOI: 10.1094/ASBCJ-2015-0130-01.
- 1 2 Perpète P., Duthoit O., De Maeyer S., Imray L., Lawton A. I., Stavropoulos K. E., Giyonga V. W., Hewlins M. J. E., Dickinson J. R. Methionine catabolism in Saccharomyces cerevisiae. „FEMS Yeast Research”. 6 (1), s. 48–56, 2006. DOI: 10.1111/j.1567-1356.2005.00005.x.
- ↑ Etschmann M. M. W., Kötter P., Hauf J., Bluemke W., Entian K. D., Schrader J. Production of the aroma chemicals 3-(methylthio)-1-propanol and 3-(methylthio)-propylacetate with yeasts. „Applied Microbiology and Biotechnology”. 80 (4), s. 579–587, 2008. DOI: 10.1007/s00253-008-1573-4.
- 1 2 Bamforth C. W. 125th Anniversary Review: The Non-Biological Instability of Beer. „Journal of The Institute of Brewing”. 117 (4), s. 488–497, 2011. DOI: 10.1002/j.2050-0416.2011.tb00496.x.
- 1 2 Gros J., Collin S. Identification of a new light-struck off-flavour in “light-stable” beers. „Cerevisia”. 37 (1), s. 10–14, 2012. DOI: 10.1016/j.cervis.2012.04.003.
- ↑ Schönberger C., Kostelecky T. 125th Anniversary Review: The Role of Hops in Brewing. „Journal of The Institute of Brewing”. 117 (3), s. 259–267, 2011. DOI: 10.1002/j.2050-0416.2011.tb00471.x.
- ↑ Munoz-Insa A., Gastl M., Becker T. Variation of sunstruck flavor-related substances in malted barley, triticale and spelt. „European Food Research and Technology”. 242 (1), s. 11–23, 2016. DOI: 10.1007/s00217-015-2513-z.
- ↑ Swiegers J. H., Pretorius I. S. Modulation of volatile sulfur compounds by wine yeast. „Applied Microbiology and Biotechnology”. 74 (5), s. 954–960, 2007. DOI: 10.1007/s00253-006-0828-1.
- ↑ Lund M. N., Lametsch R., Sørensen M. B. Increased protein–thiol solubilization in sweet wort by addition of proteases during mashing. „Journal of The Istitute of Brewing”. 120 (4), s. 467–473, 2014. DOI: 10.1002/jib.155.
Bibliografia
- W. Kunze: Technologia piwa i słodu. Warszawa: Piwochmiel, 1999. ISBN 978-3-921690-49-9.
- D.E. Briggs, C.A. Boulton, P.A. Brookes, R. Stevens: Brewing science and practice. Cambridge: Woodhead Publishing, 2004. ISBN 1-85573-490-7.