| Andrias davidianus[1] | |||
| (Blanchard, 1871) | |||
 Salamandra olbrzymia chińska w zoo | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Rząd | |||
| Podrząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek |
salamandra olbrzymia chińska | ||
| Synonimy | |||
| |||
| Kategoria zagrożenia (CKGZ)[10] | |||
 | |||
| Zasięg występowania | |||
 | |||
Salamandra olbrzymia chińska[11] (Andrias davidianus) – gatunek płaza ogoniastego z rodziny skrytoskrzelnych (Cryptobranchidae), największy (lub jeden z największych) żyjący współcześnie płaz świata. Opisywany w chińskich legendach i księgach od czasów starożytnych, dla świata zachodniego zbadany i opisany po raz pierwszy w 1869 roku przez Armanda Davida. Pozycja taksonomiczna gatunku jest niepewna, potencjalnie stanowi zbiór kilku gatunków bliźniaczych. Płaz ten osiąga rozmiary do 1,8 metra długości i masę ponad 60 kilogramów. Cechuje się mocno zbudowanym, spłaszczonym ciałem i długim ogonem, a także prymitywną budową szkieletu. Gatunek diploidalny, liczba chromosomów 2n = 60, występuje potencjalnie system determinacji płci ZW. W przeszłości spotykany był w 18 chińskich prowincjach, obecnie zasięg jest znacząco zmniejszony i poszatkowany. Introdukowany został m.in. w Japonii. Zasiedla głównie górzyste potoki, w których zamieszkuje nory. Drapieżnik – odżywia się rozmaitymi kręgowcami (w tym osobnikami własnego gatunku) i bezkręgowcami, które zasysa wraz z wodą. Gatunek jest aktywny głównie nocą, wykazuje silny terytorializm. Okres godowy rozpoczyna się późną wiosną lub wczesnym latem, a do zapłodnienia dochodzi zazwyczaj w sierpniu w norze samca. Samica składa jednorazowo 10-100 jaj, z których po 31-50 dniach wylęgają się larwy, nad którymi opiekę sprawuje samiec. Dojrzałość płciowa osiągana jest zazwyczaj w wieku 5-6 lat, a długość życia na wolności wynosi co najmniej 50-60 lat. Jest to gatunek krytycznie zagrożony – populacja znacząco maleje począwszy od lat 50. XX wieku. Zagraża mu głównie gospodarka rabunkowa, a także utrata i modyfikacja środowiska oraz zmiany klimatu. Do najważniejszych działań ochronnych należą reintrodukcja oraz ochrona in situ polegająca głównie na tworzeniu rezerwatów przyrody. Gatunek hodowany na farmach w celach ochronnych i konsumpcyjnych. W związku z niewłaściwymi warunkami hodowlanymi obserwuje się regularnie występujące epidemie wirusowe.
Nazewnictwo
Nazwa rodzajowa (Andrias) pochodzi od gr. ανδρειος andreios „silny, odważny”, od ανηρ anēr, ανδρος andros „mężczyzna”[12]. Gatunek ten natomiast nazwany został na cześć francuskiego misjonarza i przyrodnika Jeana Pierre’a Amanda Davida (1826 – 1900), który jako pierwszy Europejczyk zbadał A. davidianus w zachodnich Chinach w 1869 roku[13].
W Chinach zwierzę to posiada standardową nazwę Zhongguo („chiński”) da ni („Andrias”) – 中国大鲵[14]. Znane jest również jako po prostu da ni, na yu albo neiyu[13]. Ludność mająca styczność z tym płazem często nie zna jego pozycji taksonomicznej i błędnie postrzega go jako rybę, przez co znany jest jako Wawayu (娃娃鱼), co przetłumaczyć można jako „ryba-dziecko” z powodu dźwięku rzekomo wydawanego przez złapanego osobnika A. davidianus, który przypomina płacz dziecka[13][15]. W powiecie Feng (patrz Podział administracyjny Chińskiej Republiki Ludowej) gatunek ten nazywany jest 猪不吃 (zhu bu chi) – „Świnia nie je”, jako że podczas chińskiej Rewolucji Kulturalnej braki żywności spowodowały, że świnie karmione były salamandrami olbrzymimi chińskimi, których jednakowoż rzekomo nie chciały jeść[15]. W badaniu Turvey i in. (2021) odnotowano 27 różnych lokalnych nazw, z których najpopularniejsze były gouyu – „ryba-pies" – i inne podobne nazwy, wawayu, sijiaoyu – „czworonożna ryba" – a także laoyanyu – „ryba-stary kamień”[16].
Dane historyczne
Starożytność i pierwsze wzmianki o A. davidianus w literaturze i sztuce
Gatunek ten figuruje na ceramice reprezentującej Kulturę Yangshao datowanej na 3000 – 4000 lat p.n.e.[14] Wzmianki o tym płazie pojawiają się również w książkach uczniów Konfucjusza (551-479 p.n.e.), w których opisywany jest jako jaszczurka (terminy salamandra, gekon, scynk, jaszczurka używane były wymiennie)[18]. Opis salamandry olbrzymiej chińskiej znajduje się również w Księdze Gór i Mórz (napisanej przez anonimowego autora w około 600 roku p.n.e.), w której porównywana jest w kształcie ciała do węża[18]. A. davidianus pojawia się także w relacji z pogrzebu Qin Shi Huanga (259-210 p.n.e.) – pierwszego władcy cesarstwa chińskiej, podczas którego używano świec zrobionych z tłuszczu tego gatunku[14]. W 100 r. p.n.e. Sima Qian, najbardziej rozpoznawalny autor dynastii Han zauważył, że salamandra olbrzymia chińska występuje w prowincji Shaanxi, w której nazywana była Renyu (człowiek-ryba)[18]. W 300 roku naszej ery Guo Pu zilustrował A. daviidanus i opisał jako Sum z czterema stopami – tylne przypominające stopy małpy, a przednie stopy psa[18].
Dalsze opisy w średniowiecznu i nowożytności
Około 840 roku naszej ery przyrodnik Tau-haun-tsin zauważył obecność A. davidianus w prowincjach Hunan, Hubei i Anhui[18]. 500 lat później opis tego płaza w prowincji Guangdong pojawił się w encyklopedii dynastii Song[18]. W 1070 roku Cai Bian w swoim dziele Mao shi ming wu jie (Interpretacja obiektów zawartych w Księdze Pieśni) poprawnie oddzielił salamandrę olbrzymią chińską od jaszczurek używając jako kryterium siedliska – wodnego dla A. davidianus, lądowego dla jaszczurek[18]. Około 1120 roku Koen-tzeun-pi dokonał pierwszej sekcji tego gatunku i zauważył, że jego ciało ma podobny kształt do ciała wydry, a także zaliczył salamandrę do tej samej grupy zwierząt co ryby[18]. W 1569 Li Shizhen opisał obecność tego zwierzęcia w prowincjach Syczuan, Henan i Shaanxi[18].
Opisanie salamandry olbrzymiej chińskiej przez Europejczyków
Doniesienia o istnieniu tego gatunku w Chinach zaczęły napływać do Europy około 1837 roku[18]. W księdze Fauna Japonica Coenraad Jacob Temminck i Hermann Schlegel stwierdzili, że francuski kupiec i uczony Chrétien-Louis-Joseph de Guignes zawarł termin Neiyu (jedna z chińskich nazw A. davidianus) w wydanym przez siebie w 1813 roku słowniku języka chińskiego[18]. W 1869 roku ojciec Arman David opisał ten gatunek płaza w zachodnich Chinach (dokładna lokalizacja odkrycia nieznana) podczas swojej drugiej podróży do Chin[18]. David miał również styczność z A. davidianus w prowincji Shanxi podczas swojej trzeciej podróży do Chin[18].
Pozycja taksonomiczna
Pozycja taksonomiczna do końca XX wieku
Wielu badaczy XIX i pierwszej połowy XX wieku uważało A. daividianus i A. japonicus za ten sam gatunek, niektórzy natomiast uznawali A. davidianus za podgatunek A. japonicus[18]. Inni jeszcze, tacy jak amerykański ornitolog Leonhard Hess Stejneger (1851-1943), zaliczali je do oddzielnych gatunków[18]. W 1924 roku brytyjski zoolog i dyrektor Zoo Londyńskiego Edward George Boulenger zaliczył okaz pochodzący prawdopodobnie z północnego Guangdong do nowo utworzonego gatunku Megalobatrachus sligoi, który na podstawie różnic anatomicznych oddzielił od gatunku Megalobatrachus maximus (w którym z kolei zawarł M. japonicus i M. davidianus)[19]. W 1940 roku zoolożka Alice Middleton Boring i herpetolog Clifford Hillhouse Pope stwierdzili, że M. sligoi jest w rzeczywistości synonimem M. davidianus i do opisania salamander olbrzymich używali nazw M. japonicus davidianus i M. j. japonicus[18].
Westphal (1958) natomiast zaliczył A. davidianus i A. japonicus do podgatunków wymarłego A. scheuchzeri[20]. W najnowszych artykułach naukowych roku A. davidianus uznawany był do 2018 roku za pojedynczy gatunek, oddzielny od A. japonicus[14].

Pierwsze dowody na wysoką różnorodność genetyczną populacji
W 2000 roku Murphy i in. użyli mitochondrialniego DNA (mtDNA) oraz analizy elektroforetycznej allozymów do przeprowadzenia analizy filogenetycznej badanych osobników i wykazali, że sześć badanych populacji pochodzących z trzech głównych sieć rzecznych Chin – Rzeki Perłowej, Huang He oraz Jangcy nie tworzy kladów odpowiadających ich geograficznym lokalizacjom, co spowodowane jest prawdopodobnie przenoszeniem osobników A. davidianus przez ludzi między różnymi regionami Chin[21]. Badanie to wykazało również, że populacja z Huangshan jest genetycznie odmienna od pozostałych populacji, jednakowoż autorzy zaznaczyli, że różnice te nie są wystarczająco znaczące, żeby uznać tę populację za oddzielny gatunek[21].
Tao i in. (2005) dokonali analizy mitochondrialnej pętli D i wykazali znaczące różnice genetyczne pomiędzy populacjami z Rzeki Perłowej oraz Jangcy oraz między populacjami z Rzeką Perłowej i Huang He (a także brak istotnych różnic pomiędzy populacjami z Rzeki Perłowej i Jangcy)[22]. Tao i in. (2006) zbadali z kolei sekwencje mitochondrialnego cytochromu b i wykazali niewielkie różnice genetycznie między populacjami z Rzeki Perłowej i Jangcy, a także między populacjami z Jangcy i Huang He[22]. Różnice te były jednakowoż znacząco większe między populacjami z Rzeki Perłowej i Huang He. Używając markerów genetycznych AFLP, Yang i in. (2011) potwierdzili, że różne populacje A. davidianus są znacząco odmienne genetycznie i że rozprzestrzeniły się z północnych części Chin do południowych[22].
Potencjalnie nowe gatunki chińskich Andrias
W 2018 roku Yan i in. dokonali analizy 23 159 polimorfizmów pojedynczego nukleotydu oraz mtDNA 70 dziko żyjących osobników oraz 1000 zwierząt z hodowli oraz wykazali, że A. davidianus jest w rzeczywistości gatunkiem bliźniaczym[23]. Według ich badań takson ten składa się potencjalnie pięciu różnych gatunków zamieszkujących różne dorzecza[23]. Liang i in. (2019) użyli w swojej analizie mtDNA 19 dziko żyjących salamander olbrzymich chińskich i otrzymali drzewo filogenetyczne składające się z 7 różnych kladów[22].
W 2019 roku Turvey i in. pobrali DNA z wątroby, kości i mięśni z okazów muzealnych (w tym holotypu A. davidianus i M. sligoi) oraz z próbek pochodzących z osobników czystych genetycznie z końca XX wieku[24]. W swoim badaniu naukowcy ci wykorzystali sekwencjonowanie nowej generacji i wykazali istnienie trzech różnych kladów będących według ich analizy oddzielnymi gatunkami[24]:
- Klad odpowiadający północnej części Chin (od Jangcy do Syczuanu), do którego należy holotyp A. davidianus
- Klad południowozachodni (od Rzeki Perłowej do Gór Południowochińskich), do którego należy holotyp M. sligoi oraz próbki pochodzące z okazów z Rzeki Perłowej i Gór Południowochińskich). Dla kladu tego zaproponowano nową nazwę gatunkową A. sligoi i nazwę zwyczajową South China Giant Salamander (dosłownie salamandra olbrzymia południowochińska).
- Klad południowowschodni (Huangshan), dla którego nie zaproponowano nazwy gatunkowej. Z racji braku żyjących osobników należących do tego kladu nie poddano go głębszej analizie
W 2022 roku Chai et al. opisali nowy gatunek Andrias jiangxiensis spotykany jedynie w rezerwacie przyrody Jiulingshan (ang. Jiulingshan National Nature Reserve) w chińskiej prowincji Jiangxi. Jest to jedyny czysty genetycznie gatunek Andrias występujący w Chinach[25].
Do taksonów zasiedlających Chiny używana jest czasami nazwa klad chińskich Andrias[14]. Należy zauważyć, że w celach komercyjnych, a także podczas ustalania strategii ochrony tego gatunku wszystkie klady nadal traktowane są jako pojedynczy gatunek – A. davidianus[14].
Ewolucja
Specjacja wśród skrytoskrzelnych
Salamandra olbrzymia chińska uznawana jest za formę przejściową pomiędzy zwierzęciem wodnym i naziemnym[26].

Rodzina skrytoskrzelnych, do których zalicza się A. davidianus, oddzieliła się od spokrewnionych kątozębnych (z którymi tworzy klad bazalny Cryptobranchoidea) co najmniej 160 milionów lat temu w Azji[27]. Szkielet prymitywnego przedstawiciela skrytoskrzelnych Chunerpeton tianyiensis znaleziony w Mongolii Wewnętrznej datowany jest na Baton i posiada wiele cech synapomorficznych w stosunku do obecnie żyjących przedstawicieli skrytoskrzelnych, takie jak żebra z jedną główką na kręgach przedkrzyżowych[27]. Sugeruje to, że u salamandry olbrzymiej chińskiej jak i u innych skrytoskrzelnych doszło do niewielu zmian ewolucyjnych przez ostatnich 160 milionów lat, w związku z czym nazywane są żywymi skamieniałościami[27].
Według różnych analiz filogenetycznych rodzaje Andrias i Cryptobranchus (do którego należy skrytoskrzel) oddzieliły się od siebie w paleogenie lub w kredzie późnej, około 55-70 milionów lat temu[13]. Od spokrewnionego gatunku A. japonicus A. davidianus oddzielił się najprawdopodobniej około 8 milionów lat temu w miocenie lub w pliocenie – różne analizy pokazują przedział czasowy od 4,3 milionów do 17,18 milionów lat temu[22][23][24]. Proces ten nie był spowodowany odłączeniem się Japonii od Azji, a raczej ponownym przyłączeniem niektórych wysp Japonii do Półwyspu Koreańskiego, co spowodowało, że Morze Japońskie, otoczone przez ląd, przekształciło się w duże jezioro, co umożliwiło migrację naziemną i wodną salamandrom skrytoskrzelnym, tym samym doprowadzając do specjacji[24].
Ewolucja chińskich kladów Andrias

Analiza dokonana przez Yan i in. (2018) pokazała, że różne klady wśród chińskich Andrias oddzieliły się od siebie od 10,25 milionów do 4,71 milionów lat temu[23].
Liang i in. (2018) wykazali z kolei, że najstarszy klad A. davidianus oddzielił się od pozostałych 11,05 milionów lat temu, a pozostałe 8,1-6,38 milionów lat temu w miocenie, podczas podnoszenia się Wyżyny Tybetańskiej[22].
W badaniu Turvey i in. (2019) klad południowozachodni (zamieszkujący tereny od Rzeki Perłowej do Gór Południowochińskich) oddzielił się od pozostałych kładów 3,1 miliona lat temu[24]. Klady północne (od Jangcy do Syczuanu) oraz południowowschodnie (Huanghsan) tworzą klad siostrzany w stosunku do kladu południowozachodniego[24]. Klady północne i południowowschodnie oddzieliły się od siebie 2,6 milionów lat temu[24].
Wśród czynników, które doprowadziły do oddzielenia się od siebie poszczególnych kladów, wymienia się:
- Aktywność tektoniczną – okresy oddzielenia się od siebie poszczególnych taksonów zbiegają się w czasie z podnoszeniem Wyżyny Tybetańskiej, a także z orogenezą gór Huangshan (specjacja allopatryczna) – jest to bardziej prawdopodobna możliwość według Turvey i in. – jako że gorące punkty różnorodności biologicznej (ang. biodiversity hotspots) chińskich płazów znajdują się w regionach górzystych, co sugeruje, że siedlisko to sprzyja specjacji płazów[22][24]. Ponadto większość populacji żyjących w górach centralnych Chin cechuje się dużym podobieństwem genetycznym[24].
- Izolację systemów rzecznych – Liang i in. (2019) wykazuje z kolei, że niektóre gatunki żyjące w tym samym pasmie górskim (Wuling Shan) należą do różnych kladów otrzymanych w przeprowadzonej przez nich analizie filogenetycznej, ponieważ zasiedlają różne cieki wodne po przeciwnych stronach gór[22].
- Ogólnie specyficzne wymagania środowiskowego a także mała zdolność do przemieszczenia się pomiędzy siedliskami[22].
Należy zauważyć, że w związku z rozległa hybrydyzacją (spowodowaną przenoszeniem tych płazów między różnymi regionami Chin) osobników pochodzących z różnych populacji mogło dojść do nieodwracalnego spadku różnorodności genetycznej i zaniku czystych genetycznie populacji należących do większości lub wszystkich taksonów zidentyfikowanych we wszystkich wcześniej wymienionych badaniach[24].
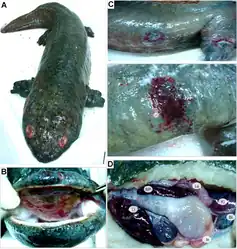
Wygląd
Rozmiary
Największy (lub drugi co do wielkości) gatunek płaza na świecie[24]. W latach 20 XX wieku w prowincji Kuejczou złapano największy zmierzony okaz, którego długość wynosiła 1,8 metra[24]. Niedawno łapane okazy A. davidianus w tejże prowincji należą do kladu D (czyli kladu południowo-zachodniego u Turvey i in. (2019)) uzyskanego w analizie Yan i in. (2018), co sugeruje, że to A. sligoi, a nie A. davidianus jest (lub był) największym gatunkiem płaza[23][24]. Browne i in. (2014) informują również o hodowli w Zhangjiajie (prowincja Hunan), na której w 2007 roku opisano osobnika mierzącego 180 cm i ważącego 59 kg[28]. Przeciętne osobniki osiągają długość 1 metra i masę około 11 kilogramów[29][30], chociaż spotyka się również osobniki ważące ponad 60 kilogramów[21]. Obecnie największym okazem z potwierdzonymi wymiarami jest samiec Karlo trzymany w ogrodzie zoologicznym w Pradze, który w 2015 roku mierzył 158 cm długości i ważył 35 kilogramów[31]. Niepotwierdzone informacje donoszą o trzymetrowym osobniku ważącym 70 kilogramów sprzedanym na lokalnym rynku w Chinach w 1983 roku[32].
Ogólna budowa ciała
Dobrze zbudowany płaz[29][33]. Ciało po wyjęciu z wody wydaje się spłaszczone[33]. Skóra gładka i śluzowata w dotyku, obecne liczne zmarszczki, fałdy oraz guzki[29][33]. Dymorfizm płciowy słabo zaznaczony[30]. Jedynie podczas okresu godowego zaobserwować można różnice między płciami, kiedy to gruczoły kloakalne samca puchną[30]. Gatunek ten posiada duże parzyste guzki na tylnogrzbietowej części głowy[18]. Mniejsze guzki występują w wyraźnych rzędach i parach na grzbietowobocznej części głowy, a najmniejsze guzki na brzegach szczęki[18]. Środkowa część głowy gładka[18]. Jeszcze mniejsze guzki występują w parach i rzędach na gardle równolegle do żuchwy[18]. Ponadto guzki występują nieregularnie na prawie całym ciele ciele – głównie wzdłuż fałdy grzbietowo-bocznej[18]. Brak ich natomiast na kończynach i brzuchu[18]. Młode osobniki mogą zostać omyłkowo wzięte za przedstawicieli rodzaju Paramesotriton[33]


Głowa
Głowa duża, szeroka, mocno spłaszczona, pysk tępo zaokrąglony, nozdrza niewielkie, zaokrąglone, usytuowane blisko krawędzi górnej wargi[29]. Odstęp między nozdrzami wynosi mniej niż połowę odstępu między oczami[29]. Oczy niewielkie, okrągłe, usytuowane grzbietowo-boczne[29]. Brak powiek[29]. Wzrok słabo rozwinięty – brakuje m.in. dołka środkowego siatkówki odpowiedzialnego za najostrzejsze widzenie[33][34]. Obecne dwie wypukłości na płacie skroniowym nad i za oczami[29]. Zęby lemieszowe, usytuowane w łukowatych rzędach, równoległych do rzędów kości szczękowych, są małe i spiczaste (co pomaga w przytrzymywaniu ofiary)[29][33]. Występują fałdy wargowe (ang. labial folds) biegnące od środkowego obszaru pomiędzy oczami i oczami do kącika ust[29].
Tułów i ogon
Tułów mniej spłaszczony niż głowa[29]. Występuje około 15 niezbyt wyraźnie zaznaczonych bruzd żebrowych (ang. costal grooves)[29]. Na bokach ciała widoczne są dobrze zaznaczone fałdy skórne[29]. Ogon, służący jako magazyn tłuszczu spłaszczony bocznie, stanowi około 60% całego ciała[33]. Zakończenie cienkie i płaskie, zaokrąglone[33]. Płetwa ogonowa grzbietowa dochodzi do tułowia[29].
Kończyny

Kończyny przednie krótkie, spłaszczone grzbietowo-brzusznie z fałdami skóry na tylnej części[18][29]. Występują cztery palce[18]. Zewnętrzny palec spłaszczony i rozszerzony z obecnym fałdem skóry łączącym się z fałdem ramiennym[18]. Pozostałe palce mniej spłaszczone z okrągłymi zakończeniami. Brak błony pławnej pomiędzy palcami[18]. Opuszki palców jasnobrązowe, zrogowaciałe[18]. Kończyny tylne krótkie i spłaszczone, również pokryte wyraźnie zaznaczonymi fałdami skóry[18]. Palce u stop spięte słabo rozwiniętą błoną pławną[18]. Występuje pięć palców u stóp[18]. Opuszki palców zaokrąglone z jasnobrązowym zrogowaciałym naskórkiem[18].
Ubarwienie
Ubarwienie zmienne – od ciemnobrązowego przez czarny do zielonkawego i jasnoróżowego[29][33]. Występują nieregularne ciemne i brązowe plamki[29][33]. W hodowli uzyskano również inne warianty kolorystyczne – spotykane są np. albinosy, a także osobniki pomarańczowe i srokate[35]. Kolor w alkoholu: umbry (Saccardo umber)[18].
Różnice między A. davidianus i innymi taksonami Andrias
Od spokrewnionej salamandry olbrzymiej japońskiej salamandra olbrzymia chińska różni się głównie układem guzków na głowie i gardle[29]. Guzki A. davidianus są parzyste, mniejsze i mniej liczne od guzków A. japonicus[29]. Ponadto pysk salamandry olbrzymiej chińskiej jest mniej zaokrąglony, a ogon proporcjonalnie dłuższy[29].
Holotyp Andrias sligoi z kolei posiadał dłuższą i bardziej płaską głowę oraz wyraźniej zaznaczone oczy[19]. W przeciwieństwie do A. davidianus holotyp ten nie miał również guzków na ciele[19]. Ponadto dystans między nozdrzami jest mniejszy u A. davidianus niż w holotypie A. sligoi[19].
Anatomia i fizjologia
Układ pokarmowy
Szpara ustna szeroka[36]. Język słabo rozwinięty, przylega do dna jamy ustnej[37]. Przełyk krótki i szeroki, obecne podłużne pofałdowania[36]. Struktura nabłonka przełyku nie jest pewna[38]. Żołądek długi, w kształcie wrzeciona, wpust (cardia) duży[36]. Podczas głodówki długość i obwód żołądka i jelita zmniejszają się[39]. Występuje dobrze rozwinięta odbytnica[36]. Wątroba cechuje się unikalną budową, jako że brak zrazika wątrobowego[40]. Obecne są natomiast komórki Browicza-Kupffera i komórki magazynujące tłuszcz[40]. Za główny magazyn tłuszczu służy długi ogon[33]. Płaz ten może przetrwać kilka lat bez pożywienia[41]. Podczas głodówki wzrasta ekspresja genów biorących udział w m.in. metabolizmie tłuszczów, oksydacji aminokwasów, glukoneogenezie, ketogenezie i cyklu ornitynowym[41]. Spada za to ekspresja genów odgrywających role w szlaku pentozofosforanowym i syntezie białek w wątrobie[41]. Podczas zimy spada ogólna aktywność a także poziom podstawowej przemiany materii[33]. Gatunek ten cechuje się wyższą i bardziej zróżnicowaną aktywnością proteaz w narządach układu pokarmowego niż niektóre ssaki (szczury i makaki królewskie)[42].

Układ krwionośny
Serce zlokalizowane pod kością kruczą (coracoid), leży na przedniej części linii środkowej ciała[43]. Przedsionki znajdują się po lewej stronie od linii środkowej i mają kształt półkuli[43]. Oddzielone są od siebie przegrodą międzyprzedsionkową (septum interatriale), w której obecne są dziury[43]. Ściany przedsionków bardzo cienkie[43]. Komora znajduje się po prawej stronie od linii środkowej ciała, ma grubsze ściany, a jej kształt jest kulisty[43]. Zawartość erytrocytów w jednym mililitrze krwi wynosi około 7,6·104, a białych krwinek około 1,9·103[44]. Gatunek ten posiada również dwa rodzaje hemoglobiny[45].
Układ oddechowy
Gatunek ten posiada dwa płuca w kształcie stożka[36], o cienkich ścianach[36]. Do oddychania osobniki dorosłe używają głównie płuc, przez co muszą co jakiś czas podpływać do powierzchni wody w celu zaczerpnięcia powietrza[46]. U osobników dorosłych brak skrzeli[46]. W dobrze rozwiniętej wymianie gazowej poprzez skórę pomagają rozległe fałdy skórne zwiększające powierzchnię dostępną do absorpcji tlenu[33]. Gatunek ten cechuje się rzadko spotykaną mikrobiotą płuc, w której skład wchodzi proporcjonalnie dużo przedstawicieli Archaea (obecne również w mikrobiocie jelit)[47].
Układ kostny
Prymitywna budowa szkieletu[48]. Czaszka podzielona na mózgoczaszkę (chondrocranium) i dermatocranium, które nie są ze sobą połączone[48]. Czaszka jest bardzo szeroka i płaska, co pomaga w zasysaniu ofiary[49]. Górna szczęka zbudowana z kości przedszczękowej (premaxillia), szczękowej (maxilla) i lemieszowej (vomer)[49]. Niemalże półokrągły rząd zębów osadzony jest na kości szczękowej i przedszczękowej, drugi rząd natomiast na lemieszowej[49]. Szkliwo nie zawiera enameloidu (substancji szkliwopodobnej) ani pryzmatów[50]. Czaszę domyka kość potyliczna, która łączy się z dźwigaczem za pomocą kłykci potylicznych[49]. Larwy posiadają jedną parę łuków gnykowych i cztery pary łuków skrzelowych zbudowanych z tkanki chrzęstnej[48]. U dorosłych osobników występuje jedna para łuków gnykowych i dwie pary łuków skrzelowych[48]. Kręgosłup podzielony na cztery części – obejmujące kręgi szyjne, kręgi tułowia, kręgi krzyżowe (słabo zaznaczone) oraz kręgi ogonowe[48][51]. Kręgi są dwuklęsłe (amficeliczne)[48]. Mostek zbudowany jest z tkanki chrzęstnej, nie kostnieje w trakcie życia płaza[48]. Brak skostnienia w nadgarstku i stępie[48].
Skóra
Skóra bogata w kolagen, z dobrze rozwiniętymi gruczołami śluzowymi[52]. Naskórek składający się z 2-5 warstw pełni ważną rolę w wymianie gazowej[53]. Pobudzona lub złapana salamandra olbrzymia chińska wydziela mętną klejącą wydzielinę o cierpkim zapachu składającą się z lepkich glikoprotein i włókien[53]. Podobnie jak u innych płazów, gatunek ten nie posiada łusek, a także przeprowadza proces linienia, czyli nieustannej odnowy warstwy rogowej naskórka w celu ochrony przed urazami, patogenami oraz utratą wody[53].

Układ dokrewny i moczowo-płciowy
Tkanka nadnercza podobna do nadnerczy płazów bezogonowych, komórki nadnercza i komórki chromochłonne wymieszane[54]. Nerki podłużne, w kształcie filaru. Moczowody nie dochodzą bezpośrednio do pęcherza[36]. U samców brak wyspecjalizowanego nasieniowodu, sperma transportowana jest przez moczowód[36]. U samic występują dwa jajniki w kształcie paska, które dochodzą bezpośrednio do jajowodu[36].
Układ nerwowy
Mózg A. davidianus cechuje się niewielką specjalizacją[55].
Gatunek ten posiada linię boczną pozwalająca na wyczucie ruchów wody, która składa się z mechanoreceptorów[33][56]:
- Neuromast – narządów czuciowych usytuowanych w naskórku wrażliwych na ruch i kierunek prądu wody
- Narządów jamkowych (ang. pit organs)
Ponadto w skład linii bocznej wchodzą również elektroreceptory – narządy ampułkowe (ang. ampullary organs)[56].
Narządy jamkowe i neuromasty występują zarówno u larw jak i osobników dorosłych[57]. Narządy ampułkowe, natomiast, obecne jedynie u larw, którym mogą pomagać w zlokalizowaniu ofiary[33][57]. Narządy jamkowe i neuromasty salamandry olbrzymiej chińskiej różnią się anatomicznie od tychże narządów u innych płazów ogoniastych[58]. Do różnic należy np. brak kopułki (łac. copula), będącej osłonką wytwarzaną przez komórki podporowe neuromastów u A. davidianus[58]. Na głowie i w okolicach pyska występują liczne komórki czuciowe pozwalające na wykrycie i złapanie ofiary, a także na dokładne poruszanie się w wodnym środowisku podczas żerowania[33].
Olshanskii i in. (2016) wykazali również, że u płaza tego występują również wyładowania elektryczne, do których dochodzi zarówno spontanicznie, jak i poprzez działanie bodźca zewnętrznego (dotyku)[59]. Rola tego mechanizmu nie jest jednakowoż znana[59].
Genetyka i proteomika
Informacje ogólne
Salamandra olbrzymia chińska cechuje się bardzo dużym genomem, którego długość wynosi około 50 Gb (1 Gigabase odpowiada miliardowi nukleotydów, dla porównania genom ludzki ma długość 3,2 Gb[60])[61]. Szacuje się, że genom składa się z około 26 000 genów kodujących białka przypisanych do ponad 12 tysięcy rodzin genów[61]. Duży rozmiar genomu spowodowany jest zapewne ekspansją transpozonów, a także małym tempem utraty genów[61]. Zsekwencjonowano również genom mitochondrialny, którego długość wynosi około 16500 par zasadowych, a sam genom składa się z 13 genów kodujących białka, 2 genów kodujących rRNA (12S i 16S rRNA) i 22 genów kodujących tRNA, w czym przypomina genom mitochondrialny innych kręgowców[62][63]. Obecny jest również jeden region kontrolny – pętla D[62]. Tak jak u innych kręgowców, genom ten cechuje się duża proporcjonalną zawartością adeniny i tyminy (odpowiednio 31,9 i 32,6%)[63]. Do badania diagnostycznego genetycznego można używać skóry, którą płaz ten zrzucił podczas linienia[64].

Kariotyp
Jest to gatunek diploidalny, liczba chromosomów 2n = 60[65][66]. Kariotyp u A. davidianus jest asymetryczny i składa się z dwóch rodzajów chromosomów – dużych metacentrycznych oraz małych telocentrycznych[65]. Obecność mikrochromosów wskazuje na bardzo prymitywny kariotyp[65]. Szacuje się, że występuje 16 par makrochromosomów i 14 par mikrochromosomów[66]. Zaobserwowany heteromorficzny chromosom u samicy sugeruje, że w gatunku tym może występować system determinacji płci ZW (co nie zostało natomiast w tym badaniu jednoznacznie potwierdzone)[66]. Wyniki badania genomicznego przeprowadzonego przez Hime i in. (2019) sugerują, że u wszystkich skrytoskrzelnych (w tym u A. davidianus) od co najmniej 60 milionów lat to samica jest płcią heterogametyczną[67].
Charakterystyka genomu i proteomu
Brak genomu referencyjnego[24]. Stworzone zostały natomiast biblioteki cDNA dla narządów takich jak skóra[68] czy wątroba[69], a także biblioteki genowe dla genów kodujących m.in. prolaktynę[70]. Duża część sekwencji genetycznych słabo zbadana[71]. Wiadomo natomiast, że genom salamandry olbrzymiej chińskiej cechuje się dużą liczbą genów biorących udział w szlakach sygnałowych jak np. FoxO, HIF-1, MAPK, Hippo, Wnt, które regulują między innymi długowieczność i poziom głodu, a także biorą udział w rozwoju zarodkowym[55][71][72]. Salamandra olbrzymia chińska jest również pierwszym gatunkiem płaza, u którego opisano działanie czynnika transkrypcyjnego Nrf2 biorącego udział w ochronie przed stresem oksydacyjnym[73][74].
Badanie proteomiczne w 11 tkankach wykryło 2153 białek o masie 10–100 kDa, z których 922 wykrytych zostało tylko w jednym rodzaju tkanki lub kilku spokrewnionych rodzajach[55]. Białka wykryte w badaniu regulowane są głównie przez czynniki transkrypycjne MYC, RB1, PPARGC1A[55]. W analizie proteomicznej skóry wykryto 249 białek w skórze, których skład porównywalny jest do innych gatunków płazów oraz 155 białek w śluzie[53].
Niekodujący RNA
W genomie opisano występowanie co najmniej 553 znanych miRNA, a także co najmniej 44 potencjalnie nowych[75][76]. Długość miRNA, podobnie jak u innych kręgowców, wynosi zazwyczaj 20-24 nukleotydy[75][76]. Sekwencje należą do przynajmniej 196 rodzin, głównie rodziny miR-10[76]. Transkrypty regulowane przez działalność miRNA biorą udział głównie w rozwoju, a także w metabolizmie i odpowiedziach immunologicznych[75][77]. Opisano również obecność innych typów niekodującego RNA, takich jak piRNA czy tsRNA (tRNA-derived small RNA)[78].
Genetyka populacyjna

Populacje A. davidianus cechują się większą różnorodnością genetyczną niż populacje spokrewnionego gatunku A. japonicus[21]. Różnorodność ta jest jednocześnie mniejsza niż u większości naziemnych gatunków płazów ogoniastych[21]. Badanie Tao i in. (2005) dowiodło, że wewnątrz niektórych badanych regionów (w szczególności w regionie Jangcy) różnorodność nukleotydowa i haplotypowa jest niewielka[79]. Liang i in. (2019) wykazali z kolei, że populacja A. davidianus podzielona jest na 7 kladów występujących w następujących lokalizacjach[22]:
- Klad A – Góra Mao’er
- Klady B,C,D, G – występujące odpowiednio w 3,4,3 i 7 różnych łańcuchach górskich
- Klad G – Qin Ling (Qinling)
Badanie to dowiodło również, że całkowita różnorodność haplotypowa (h = 0,870) oraz nukleotydowa (θπ = 0,230) jest wysoka, a także że występują znaczące różnice genetyczne pomiędzy populacjami[22]. Wykazano natomiast również, że u 12 z 23 populacji, a także u 3 kladów (C,D,G) różnorodność genetyczna spada[22]. Yan i in. (2018) dowiedli istnienia 7 głównych kladów, z czego 5 odpowiada dzikim populacjom, a 2 (U1 oraz U2) osobnikom pochodzącym z hodowli:
- Klad A – Obszar Rzeki Perłowej w Kuangsi
- Najbardziej rozprzestrzenione klady B i C odpowiadają regionom leżącym wzdłuż Huang He
- Klad D – Dorzecze Jangcy w Chongqing i Kuejczou
- Klad E – dorzecze Qiantang Jiang (obszar Huang Shan)
Autorzy badania zasugerowali, że klad chińskich salamander składał się kiedyś z 8 różnych gatunków[23]. Dowiedziono również braku czystych genetycznie populacji hodowanych na większość farm[23]. W 2022 roku Chai et al. opisali nowy gatunek A. jiangxiensis odpowiadający kladowi U2 w badaniu Yan et al. (2018)[25].
Gatunek ten charakteryzuje się dużym przepływem genów pomiędzy poszczególnymi populacjami, co spowodowane jest w dużym stopniu przenoszeniem osobników pomiędzy poszczególnymi regionami przez ludzi (w związku z zastosowaniami medycznymi, a także wykorzystaniem jako pożywienie, które mogło się rozpocząć ponad 3700 lat temu[22][37]. Nieznany jest dokładny wpływ przenoszenia ludzkiego na różnorodność genetyczną i strukturę populacji[22]. Możliwym jest, że wypuszczanie osobników z obcymi genotypami może doprowadzić do utraty lokalnych adaptacji oraz różnorodności genetycznej[22]. Podobnie wypuszczenie osobników urodzonych w niewoli może prowadzić do tzw. efektu Rymana-Laikre’a, który cechuje się spadkiem efektywnej wielkości miejscowej populacji, kiedy to niewielka grupa osobników wydaje na świat liczne potomstwo[22][80].
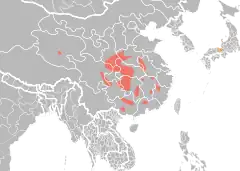
Zasięg występowania
Zmiany w zasięgu i historyczny zasięg występowania
Gatunek niegdyś występował powszechnie w środkowych i górnych dopływach Jangcy, Huang He i Rzeki perłowej w co najmniej 18 prowincjach na obszarze szerokości geograficznej 23,5-35°N i długości geograficznej 100–120°E[81][82][83]. Od lat 50. XX wieku zasięg występowania oraz liczebność populacji zaczęły gwałtownie spadać w związku z nadmiernym połowem w celach handlowych (gospodarka rabunkowa) oraz utratą środowiska[82]. Spadek ten był szczególnie widoczny między latami 50. i 70. XX wieku[82].
Według badań z 2002 roku gatunek ten występował w 17 prowincjach, głównie w górzystych obszarach środkowego Jangcy[82]. Wang i in. (2004) wyróżnili z kolei 12 populacji występujących w niewielkich rzekach rejonów górskich[84]. W dolnym odcinku Jangcy gatunek ten spotkać można było m.in. w górach Dabie Shan, Huang Shan[84]. W górnym biegu Huang He A. davidianus zasiedlał powiat Tianshui w prowincji Gansu, powiaty Lishan i Luonan w prowincji Shanxi, powiat Lushan w prowincji Henan[84]. Występuje również w rzekach tworzących górny bieg Rzeki Perłowej – Bei Jiang oraz Liu Jiang[84]. Płaz ten pojawia się w gazeterach 145 powiatów (około 5% wszystkich chińskich powiatów) należących do 18 prowincji[81]. Największa liczba powiatów, w których występowanie salamandry olbrzymiej chińskiej odnotowane zostało w gazeterze, przypada na prowincję Kuejczou (30 powiatów)[81].
Należy pamiętać, że niedawno przeprowadzone analizy filogenetyczne wykazały, że takson ten może być w rzeczywistości gatunkiem bliźniaczym[85]. W związku z tym niektóre obszary, tradycyjnie uważane za część zasięgu A. davidianus, mogą w rzeczywistości być zasiedlane przez potencjalnie inne gatunki takie jak A. sligoi czy nieopisany jeszcze gatunek w Huang Shan[85].
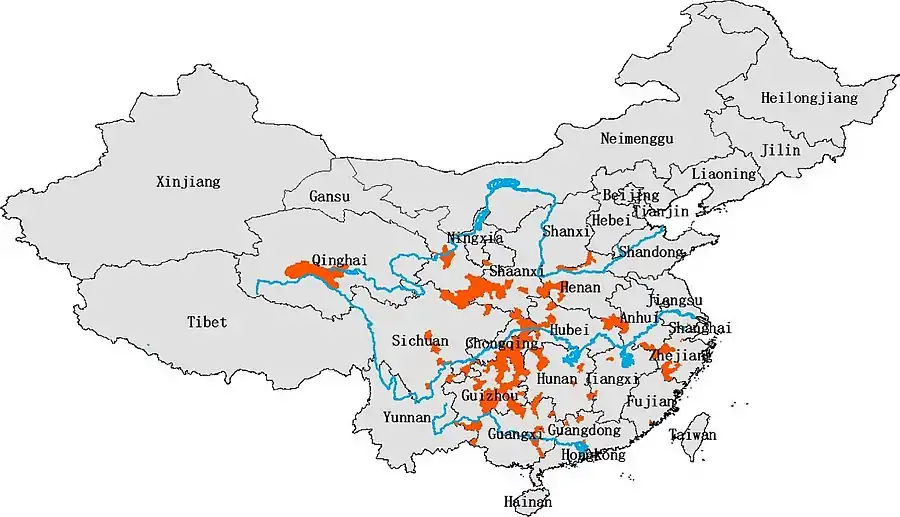
Obecny zasięg występowania
Płaz ten występuje na wysokościach bezwzględnych 100–1500 metrów n.p.m. (najczęściej 300–900 m n.p.m.)[86]. Osobniki widywane były również na wysokościach bezwzględnych 2500 m n.p.m. oraz 4200 m n.p.m.[86]. Obecnie populacje A. davidianus mają poszatkowany zasięg i występują w górskich obszarach Huang He, Rzeki Perłowej i Jangcy od prowincji Qinghai i Syczuan na zachodzie do Kuangsi, Guangdong i Jiangsu na wschodzie[28]. Na obszarach równinnych większość rzek jest mocno zmodyfikowana przez działalność człowieka. Na tych terenach salamandra olbrzymia chińska występuje głównie w odizolowanych dorzeczach, jeziorach i strumieniach[28].
W latach 2013-2016 przeprowadzone zostały badania terenowe w 97 powiatach należących do 16 prowincji mające na celu zbadanie aktualnego statusu dzikich populacji[87]. Populacje A. davidianus wykryte zostały w 4 z 97 lokalizacji, a autorzy spekulowali, że widywane osobniki mogły w rzeczywistości pochodzić z hodowli, w związku z czym możliwym jest, że w badaniu tym nie został wykryty ani jeden dziki osobnik[87]. Ponadto w ramach rządowego programu ochrony przyrody płazy te często przenoszone są pomiędzy różnymi regionami Chin i wypuszczane w powiatach nienależących do nominalnego zasięgu danej populacji, przez co dochodzić może do mieszania się różnych taksonów i zaniku lokalnej różnorodności genetycznej[24].
Szacuje się, że na terenach należących do historycznego zasięgu występowania występują obecnie populacje reliktowe[88]. Obecnie uważa się, że zasięg gatunku podzielony jest na 12 odseparowanych regionów, pomiędzy którymi nie dochodzi do migracji osobników z różnych populacji, również dlatego że gatunek ten ma ograniczone możliwości przemieszczania się pomiędzy poszczególnymi ciekami wodnymi[89][90].
Introdukcja oraz niepewne lokalizacje
Introdukowana populacja A. davidianus, prawdopodobnie pochodząca z nielegalnego importu na jedzenie, zasiedla obecnie rzekę Katsura (obecność salamandry olbrzymiej chińskiej potwierdzono w 9 z 37 badanych lokalizacji) w japońskiej prefekturze Kioto, gdzie dochodzi do mieszania z miejscowym gatunkiem – A. japonicus[91]. Pojawiają się również niepotwierdzone informacje o populacjach na Tajwanie, w pasmie górskim Czin w Mjanmie, a także w pobliżu Władywostoku w Rosji[14][24][92]. Ponadto w 1966 roku w źródle Jangcy w prowincji Qinghai złapany został pojedynczy osobnik A. davidianus[88]. Jako że zasiedlał on teren znajdujący się na wysokości bezwzględnej 4200 m n.p.m. (o ponad 2000 metrów wyżej niż jakakolwiek inna populacja salamandry olbrzymiej chińskiej), podejrzewać można, że należał on do populacji o odrębnym statusie taksonomicznym niż salamandra olbrzymia chińska[88]. Jednakowoż przeprowadzone w 2012 roku badania terenowe nie wykryły obecności owych płazów na tym terenie[88].
Habitat
Informacje ogólne
Gatunek ten zasiedla głównie górzyste potoki charakteryzujące się przejrzystą i chłodną wodą[84]. Wang i in. (2004) wyróżnili cztery główne typy siedlisk wybieranych przez A. davidianus[84]:
- Stosunkowo małe strumienie (szerokość < 10 m i głębokość wody < 1m) z wolno płynącą wodą oraz błotnistym korytem i dnem zazwyczaj pokrytym żwirem
- Rzeki o szybko płynącej wodzie z dużą ilością głębokich plos oraz brzegów pokrytych dużymi kamieniami – preferowany habitat
- Rzeki z mała ilością plos, płaskim korytem oraz stosunkowo wolno płynącą wodą o głębokości wynoszącej zazwyczaj powyżej 5 metrów. Brzeg pokryty jest kamieniami i żwirem, a szerokość rzeki wynosi 6-30 metrów.
- Rzeki podziemne płynące w górskich jaskiniach krasów z obecnymi plosami. W niektórych regionach Chin (np. w prowincjach Zhangjiajie i Jiangsu) płaz ten zasiedla głównie ten typ habitatu, o czym świadczy regularne wypływanie larw ze źródeł prowadzących do podziemnych rzek[28].
Sporadycznie A. davidianus migruje z potoku lub rzeki do większych jezior[30]. Gatunek ten zazwyczaj wymaga zalesienia na brzegach rzek lub strumieni, w związku z czym nie występuje w krajobrazach zmodyfikowanych przez działalność ludzką, takich jak użytki rolne czy obszary miejskie (czym różni się od salamandry olbrzymiej japońskiej)[81].
_Figure_5.jpg.webp)
Preferowane obszary w cieku wodnym
W cieku wodnym salamandra olbrzymia chińska zamieszkuje nory (ang. den) znajdujące się na brzegach rzek i strumieni oraz w rzekach podziemnych[93]. Kamieniste nory mają zazwyczaj szerokość 0,4-4,0 metra, a przy ich wyborze salamandra olbrzymia chińska kieruje się głównie szerokością, a także prędkością strumienia wody (przepływ wody w norach jest zazwyczaj stosunkowo niewielki[94]) oraz typem podłoża[28]. Nory te zapewniają ochronę przez drapieżnikami i działaniem promieni słonecznych[86]. Mają one również dostęp do powierzchni wody, co umożliwia płazowi zaczerpnięcia powietrza (co ten robi sporadycznie, większość czasu spędzając odpoczywając pod wodą)[86]. Składają się zazwyczaj z dwóch 'pięter' – dolnego zanurzonego w wodzie na głębokości 1-2 metra i górnego znajdującego się wzdłuż powierzchni wody, mającego większą powierzchnię i niższą temperaturę[95]. A. davidianus można również spotkać w szczelinach między dużymi kamieniami, jak i pod samymi kamieniami. Wykazano, że większa liczba osobników spotykana jest w głębokiej wodzie w niewielkiej odległości od dużych głazów[86][96].
Właściwości chemiczne wody
Woda w potoku lub rzece zasiedlanych przez A. davidianus ma zazwyczaj pH 6,0–7,0[84]. Temperatura wody waha się między 10 °C zimą a 25 °C latem w strumieniach położonych na stosunkowo niewielkiej wysokości bezwzględnej[28]. W strumieniach znajdujących się na większych wysokościach bezwzględnych temperatura przyjmuje wartości od 3 °C zimą do 20 °C latem[28]. Największą aktywność płazy te wykazują w temperaturze wody 20-22 °C[28]. Aktywność znacznie spada w temperaturze 28-30 °C, a przy temperaturze wody powyżej 35 °C zaczyna dochodzić do zgonów[28]. W prowincji Zhangjiajie odcinki strumieni zasiedlanych przez salamandrę olbrzymią chińską cechowały się dużym stężeniem tlenu (~7,2 mg/L), niskim chemicznym zapotrzebowaniem tlenu (~4,0 mg/L), niską zawartością azotu (~0,1 mg/L) oraz umiarkowaną twardością wody (~140 mg/L)[28]. Dowiedziono również, że płaz ten może z powodzeniem zasiedlać cieki wodne o stężeniu tlenu 4 mg/L bez oznak niedotlenienia[28]. Natomiast stężenie 3 mg/L powodowało spowolnienie tempa wzrostu, a 2 mg/L prowadziło do zgonu po 48 godzinach[28].
Odżywianie
Dieta
Dieta w środowisku naturalnym nie jest dokładnie zbadana[33]. Pierwszej sekcji żołądka dokonano w 1120 roku naszej ery[33]. W jego świetle wykryto wówczas małe ryby i kraby[33]. Spożycie pokarmu jest niewielkie w porównaniu do masy ciała, co sugeruje niski poziom podstawowej przemiany materii oraz niewielkie wymagania kaloryczne[28]. Wśród badanych osobników 40% miało puste żołądki[28]. Salamandra olbrzymia chińska może przetrwać kilka lat bez pożywienia, w czym pomagają zapasy tłuszczu zgromadzone w wątrobie[41]. Według dotychczas przeprowadzonych badań w środowisku naturalnym A. davidianus żywi się m.in.[33]:
- słodkowodnymi krabami i krewetkami
- owadami
- rybami
- małymi ssakami (np. ryjówkami)
- pierścienicami
- jaszczurkami
- płazami
- wężami
- planktonem (stadium larwalne)

Z pożywieniem połykane są również często gałązki i żwir[28]. Po złapaniu obiektu niebędącego pożywienie, jak np. drewno, płaz ten zazwyczaj wypluwa go i zmienia miejsce polowania[95]. Badanie Song (1994) pokazało, że A. davidianus ma silne skłonności kanibalistyczne – 27% (wagowo) diety stanowiły inne osobniki tego samego gatunku, następnie kraby (23%), płazy bezogonowe (12%), ryjówki (9%, dokładnie wodosorki), ryby (9% – głównie karpiowate i piskorzowate), bezkręgowce (6% – krocionogowate, motyle, ważki, Locusta, chrząszcze, a także Gordioidea – rząd nitnikowców)[28]. Gałązki, liście i żwir stanowiły 9% masy treści żołądkowej[28]. Luo i Kang (2009) wykazali z kolei, że w prefekturze Zhangjiajie najważniejszym źródłem pożywienia były słodkowodne kraby, a tuż po nich krewetki[28]. Opisano również przypadki żywienia się padliną[95].
W niewoli gatunek ten karmiony jest głównie rybami oraz płazami bezogonowymi[33]. Wykazano, że w hodowlach na obszarach nadmorskich można z powodzeniem używać ryb morskich jako karmy[97]. Dowiedziono również, że zawartość białka w diecie A. davidianus powinna wynosić 42-45,8%, a tłuszczy 2-3%[98]. Odchody mają kształt ziaren, a ich średnica wynosi 3 milimetry[95].
Sposób polowania
Płazy te polują głównie z zasadzki[28]. Czasami wodne zwierzęta, takie jak ryby, same wpływają do nory A. davidianus, gdzie są zjadane[95]. Zazwyczaj jednak zwierzę to o zmierzchu opuszcza norę, chowa się na dnie strumienia z głową skierowaną w stronę przeciwną do kierunku pływu wody i w tej pozycji czeka na nadpływające zwierzęta[95]. Po wykryciu ofiary salamandra olbrzymia chińska zbliża się do niej powoli i zasysa poprzez bardzo szybkie i mocne otwarcie jamy ustnej[49]. Zasysanie rozpoczyna się otwarciem jamy ustnej, po której następuje znaczące opuszczenie kości gnykowej oraz natychmiastowe zamknięcie jamy ustnej[49]. Cały cykl trwa około 155 milisekund (ms) u większych osobników oraz około 100 ms u mniejszych. Ofiara zassana jest do jamy ustnej już po mniej więcej 57 ms od początkowego otwarcia[49].
Po schwytaniu pokarm musi zostać przytrzymany oraz zmiażdżony przed połknięciem, w czym pomaga mocny zgryz cechujący ten gatunek płaza[99]. W przeciwieństwie do większości innych kręgowców największy nacisk wywierany jest w przednim odcinku jamy ustnej[99].
Gatunek ten jest również w stanie zassać ofiarę zbliżającą się z boku – dochodzi wówczas do nierównomiernego otwarcia jamy ustnej, w czym pomagają jednostronne ruchy żuchwy oraz kości gnykowej[99][100]. Jest to bardzo rzadko spotykany sposób polowania wśród kręgowców[99].
Cheng (1998) opisał również przypadki opuszczania cieku wodnego i polowania na małe kręgowce i bezkręgowce w lesie 5-10 metrów od brzegu rzeki[95].
Ekologia
Rytm biologiczny
Gatunek głównie nocny – za dnia odpoczywa w norach, które opuszcza wieczorem lub późnym popołudniem w celu żerowania[101]. W prefekturze Zhangjiajie podczas okresu godowego osobniki wypływały z nory pomiędzy 17:22 i 19:03 miejscowego czasu (samce nieco wcześniej niż samice), po czym największą aktywność obserwowano między godziną 21 i 23 dla samic i 21 i 1 dla samców[102]. Samice powracały do nor między 23:01 i 01:02, a samce między 06:19 i 08:38[102]. Liang i Wu (2010) zbadali z kolei rytm dobowy A. davidianus w niewoli i zaobserwowali, że żerowanie rozpoczynało się od 20:30 i było najbardziej nasilone tuż po 21:00[28]. Do końca polowania dochodziło między 01:00 i 03:00[28]. Jeżeli nora zajmowana jest przez parę, osobniki te wymieniają swoją pozycję – rankiem wejście do nory strzeżone jest przez samca (samica schowana głębiej), a wieczorem to samica znajduje się bliżej wejścia do nory[95].
Płaz ten jest najbardziej aktywny podczas okresu godowego[28]. Wtedy to również zwiększa się jego aktywność za dnia[101]. Zimą dochodzi do spadku temperatury wody, co skutkuje mniejszą aktywnością[101]. Gatunek ten wykazuje dużą odporność na zmiany temperatury i jest w stanie funkcjonować w wodzie o temperaturze 3-25 °C[101]. Podczas dłuższego przebywania w wodzie o wysokiej temperaturze (30 °C) dochodzi do stresu oksydacyjnego, a także do zmian fizjologicznych – m.in. w strukturze hepatocytów[73]. Powoduje to wzrost ekspresji enzymów przeciwutleniających, a proces ten kontrolowany jest przez czynnik transkrypcyjny Nrf2[73]. Przed nadejściem zimy pod skórą w okolicach kloaki gromadzona jest warstwa tłuszczu[95]. Tłuszcz ten chroni przed niskimi temperaturami, a także zapewnia źródło pożywienia[95]. Podczas zimy dochodzi do hibernacji, kiedy to para lub kilka par salamander olbrzymich chińskich przechodzi w stan pół-snu na dolnym piętrze nory[95]. Niski poziom przemiany materii utrzymywany jest m.in. przez słabe oddychanie przez skórę[95].

Terytorium i migracje
Gatunek terytorialny, szczególnie podczas okresu godowego[101]. Zaobserwowano częste walki pomiędzy osobnikami różnych płci, które prowadzić mogą do obrażeń lub śmierci[30][28]. Struktura społeczna jest słabo poznana – nory mogą być zajmowane przez pojedynczego osobnika, parę, ale także przez kilka par[101]. Badania demograficzne w powiecie Lushi wykazały istnienie 8 różnych grup wiekowych, natomiast według badań przeprowadzonych w niewoli istnieje 5 grup wiekowych[28]. W okresie godowym stosunek liczby samic do samców wynosi mniej więcej 1:0,9[103]. Terytorium ma zazwyczaj niewielki rozmiar (średnio około 35 m²)[104]. Po wypuszczeniu płazów urodzonych w niewoli osobniki płynęły w górę rzeki przez średnio 300 metrów w celu poszukiwania nory; obszar poszukiwania wynosił przeciętnie 1150 m²[104]. Do przemieszczania dochodziło głównie w ciągu nocy, za dnia zwierzęta odpoczywały w tymczasowych kryjówkach[104]. Do znalezienia stałej kryjówki dochodziło średnio po 10 dniach, a powierzchnia terytorium leżącego w pobliżu nory wynosiła średnio 40 m² dla samców i 30 m² dla samic[104]. W przypadku zniszczenia nory A. davidianus płynie zazwyczaj w górę rzeki w poszukiwaniu nowego schronienia[104].
Jest to mało ruchliwy gatunek, a przemieszczanie się zarejestrowano przez 70% dni[105]. W ciągu doby salamandra olbrzymia chińska przepływa zazwyczaj niewielkie odległości, chociaż zaobserwowano również osobniki pokonujące dystans 880 metrów w ciągu jednego dnia[105]. U dorosłych osobników zaobserwowano większą aktywność w okresie pełni Księżyca[106]. A. davidianus rzadko zmienia nory, co prowadzić może do zmniejszonego przepływu genów pomiędzy poszczególnymi populacjami[105]. Podczas pływania płaz ten używa ogona jako wiosła, a także odpycha się od kamieni. Nie jest jednakowoż sprawnym pływakiem[101].
Komunikacja

Słabo zbadana[101]. Złapany osobnik rzekomo wydaje dźwięk podobny do płaczu ludzkiego dziecka[101]. Pieśń godowa samca opisywana jest jako dźwięk ‘łuła-łuła’ (ang. wuwa-wuwa)[101]. Ponadto gatunek ten wydaje również dźwięk przypominający brzmieniem ‘a-a’ o częstotliwości 1,5-8,5 kHz[108]. Płaz ten ma słaby wzrok, w związku z czym bada środowisko głównie poprzez guzki czuciowe na bokach ciała pozwalające na odczuwanie wibracji wody, co pomaga w polowaniu oraz namierzaniu innych osobników A. davidianus[30].
Zachowania obronne
Zaniepokojony, płaz ten przenosi się do głębszych wód[101]. Chowa się również w szczelinach między kamieniami[101]. Zachowania obronne są również agresywne, dochodzić może do zwracania resztek jedzenia, a także ruchów ciała powodujących zmętnienie wody, co pozwala na szybką ucieczkę[95][101]. Po złapaniu salamandra olbrzymia chińska wydziela lepką mleczną ciecz, a także gryzie, co może spowodować głębokie rany na ręce osoby trzymającej płaza[95][101].
Rola ekologiczna
Na wielu obszarach salamandra olbrzymia chińska jest drapieżnikiem szczytowym, dzięki czemu kontroluje liczebność słodkowodnych skorupiaków, owadów, płazów bezogonowych i ryb, których nadmierna ilość mogłaby mieć negatywny wpływ na cały ekosystem[30]. Na A. davidianus polują zazwyczaj inne osobniki tego samego gatunku, ludzie, a także górskie drapieżniki takie jak wydra europejska, łasica syberyjska, lis rudy czy balizuar obrożny[30][109]. Na młode osobniki polują głównie węgorze japońskie[95].
Płaz ten może służyć jako gatunek wskaźnikowy w związku z dużą wrażliwością na zanieczyszczenia wody[110].
Jest to również gatunek inwazyjny, a badanie przeprowadzone w 2012 roku w japońskiej rzece Katsura dowiodło, że spośród 125 złapanych Andrias 25 należało do gatunku A. japonicus, 76 było mieszańcami, a 6 A. davidianus (18 osobników nie zidentyfikowano)[91]. Osobniki te pochodzącą najprawdopodobniej z nielegalnego importu w celach kulinarnych[28].
Rozród i rozwój
Okres godowy

Okres godowy rozpoczyna się zazwyczaj w okresie od maja do końcówki lipca, kiedy temperatura wody osiągnie wartość 20 °C[28]. Wzrastająca temperatura wody stymuluje rozwój narządów płciowych – u samców skóra wokół kloaki nabrzmiewa, a u samic jajowód różnicuje się na trzy części: strzępki jajowodu, środkową część jajowodu oraz w macicę łączącą się bezpośrednio z kloaką[95][111]. U samców zaobserwowano również wieczorne obmywanie całego ciała bieżącą wodą, co indukuje rozwój jąder, a także wydzielanie gonadoliberyny przez podwzgórze, która z kolei uaktywnia wydzielanie gonadotropiny przez przysadkę mózgową (stymulowane jest to głównie poprzez obmywanie pyska)[93][112]. Gonadotropina następnie indukuje wydzielanie hormonów płciowych przez gonady[93][112].
Do rozrodu dochodzi w norach zlokalizowanych pod kamieniami lub na brzegu rzeki, których wejście skierowane jest w dół strumienia[109]. Przed godami samiec przez około tydzień czyści norę, usuwając żwir i piasek głównie za pomocą kończyn lub ogona[93]. Dzięki temu dno nory staje się czystsze i gładsze, a także zwiększa się głębokość wody wewnątrz nory, co prowadzi do większej przeżywalności jaj[93]. Samiec posiadający własną norę, która może zwabić samicę, nazywany jest władcą nory (ang. den master)[93].
U gatunku tego występuje zarówno monogamia, jak i poliginia[28]. Podczas okresu godowego samiec zazwyczaj czeka przy wejściu do nory, do której następnie samica wpływa lub jest przez samca zaganiana[93]. Podczas zalotów występuje kilka typów zachowań[93]:
- samiec i samica znajdują się koło siebie stykając się głowami
- samiec puka brzuch samicy za pomocą pyska
- samiec wspina się na plecy samicy lub opiera głowę na jej plecach
- samiec i samica dotykają się ustami
- samiec aktywnie zagania samicę do nory
- samiec kilkakrotnie wpływa i wypływa z nory zachęcając samicę do wpłynięcia
- samiec obraca ciałem pokazując je samicy
- samiec i samica wspólnie zamieszkują tę samą norę
Zdarza się również, że samica z widocznym sznurem jaj wystającym z kloaki goniona jest przez kilka samców, po czym jeden z nich kopuluje z nią w norze[28].
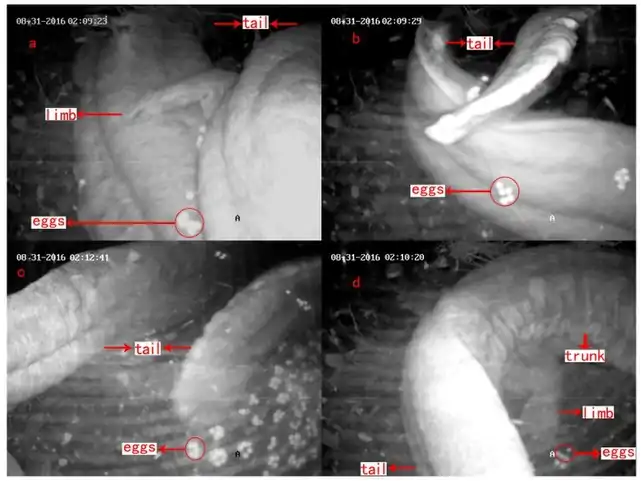
Kopulacja i zapłodnienie
W sierpniu samica składa sznur jaj w norze samca, co poprzedzone jest skurczami brzucha samicy, a także kontaktem fizycznym pomiędzy partnerami, takim jak splatanie się ogonami, co może ułatwiać samcowi przekazywanie feromonów z gruczołów skórnych do ciała samicy[93]. Proces składania jaj trwa jednorazowo około 1-3 minut i może zostać powtórzony do 7 razy, a cała kopulacja trwać może do 3 godzin[93][109]. Podczas całego okresu godowego samica składa 400-500 jaj, w tym 10-100 podczas danej kopulacji[93][95][109]. Jaja złotego koloru składane są głównie na dolnym piętrze nory. Ich średnica wynosi 7-8 mm[95]. Zapłodnienie jest zewnętrzne – samiec polewa jaja spermą, co prowadzi do zmętnienia wody[93]. Zapłodnione jaja są białe, a dzięki hydratacji ich średnica wzrasta do 15-20 mm[28]. W gatunku tym dochodzi być może do poliembronii, która u płazów ogoniastych obserwowana jest rzadko[113]. Najwięcej jaj zapładnianych jest w temperaturze wody 20-25 °C[114]. Po zakończonej kopulacji samica opuszcza norę, a samiec opiekuje się potomstwem[93].
Embriogeneza
Jian i in. (2007) zbadali embriogenezę salamandry olbrzymiej chińskiej i dokonali następujących obserwacji[115]:
- Bruzdkowanie – pierwszy podział zygoty rozpoczyna się 18-22 godzin od zapłodnienia, drugi 22-26 godzin, a trzeci 26-30. Wszystkie powstałe bruzdy przebiegają południkowo. 30-48 godzin po zapłodnieniu pojawia się blastocel. W porównaniu do innych płazów oraz doskonałokostnych salamandra olbrzymia chińska cechuje się wolnym tempem podziału komórkowego w początkowym okresie embriogenezy.
- Blastula – faza ta rozpoczyna się w trzecim dniu po zapłodnieniu i trwa od 48 do 128 godziny po zapłodnieniu. Cechuje się powstaniem jamy na szczycie bieguna animalnego, zwanej blastocelem. Na obrzeżach bieguna wegetatywnego pojawiają się liczne rowki.
- Gastrulacja – W szóstym dniu po zapłodnieniu tworzy się warga grzbietowa, która w następnych dniach wydłuża się i tworzy łuk. W tym samym czasie gastrocel powiększa się, a blastocel stopniowo zanika. Pod koniec gastrulacji tworzy się czop żółtkowy, który obrasta łuk wargi grzbietowej, a następnie przesuwa się w kierunku ogona i zanika podczas neurulacji. Faza ta trwa od 128 do 240 godziny po zapłodnieniu.
- Neurulacja – w fazie tej pojawia się płyta nerwowa, a także fałdy nerwowe na krańcach obu boków płyty nerwowej. Rozwijają się również somity, a także pęcherzyki oczne, gardło, nefrydium oraz jelito, dochodzi do różnicowania przodomózgowia i tyłomózgowia. Faza ta trwa od 240 do 300 godziny po zapłodnieniu.
- Organogeneza – w fazie tej obserwuje znaczący rozwój narządów i struktur takich jak serce, soczewki, tarczyca, żuchwa, żołądek, a także wydłużanie kończyn i tułowia (zwiększa się liczba somitów). Pojawiają się ruchy ogona. Serce zaczyna bić – początkowo około 25 razy na minutę, a w końcowym etapie 50-55 razy na minutę. Pod koniec organogenezy może dojść do wyklucia. Faza ta trwa od 300 do 676 godziny po zapłodnieniu.
Opieka rodzicielska i wylęg

Nad zapłodnionymi jajami i larwami opiekę sprawuje samiec, dopóki młode osobniki nie zaczną odżywiać się same, co zazwyczaj następuje po 4 miesiącach[109]. Samiec nie pożywia się podczas początkowego okresu ochrony potomstwa i wykonuje kilka czynności mających na celu zwiększenie sukcesu wylęgowego[93]:
- wachlowanie ogonem, co zwiększa przepływ wody i stężenie tlenu rozpuszczonego w wodzie, tym samym zapewniając jajom odpowiednie warunki do rozwoju,
- przesuwanie jaj oraz potrząsanie nimi, co zmniejsza szansę na infekcję przez lęgniowce,
- zjadanie jaj – zjawisko to różni się od kronizmu występującego u ryb, jako że samiec salamandry olbrzymiej chińskiej zjada głównie niezapłodnione i zainfekowane jaja, co zmniejsza z kolei prawdopodobieństwo przeniesienia się infekcji na sąsiadujące jaja.
Wszystkie te zachowania były najczęściej obserwowane podczas fazy organogenezy rozwoju zarodkowego[93]. Ich częstotliwość może natomiast zwiększać się podczas okresu spadku jakości wody w celu zwiększenia stężenia tlenu w wodzie[116]. Do wylęgu dochodzi według różnych źródeł od 31 do 50 dni po zapłodnieniu, zazwyczaj w październiku[93][109][115]. Młode osobniki są niekiedy omyłkowo zjadane przez samca[95]. Na tempo rozwoju jaj wpływają[109]:
- proporcja zapłodnionych jaj,
- temperatura wody (w temperaturze 18,5 °C wylęg następuje po 45-50 dniach),
- przepływ wody – niewystarczający przepływ wody ułatwia występowanie infekcji bakteryjnych. Zaobserwowano, że w środowisku naturalnym około 5% jaj było zainfekowanych, a w hodowli do 35%[117]. Za infekcję odpowiadało 6 różnych gatunków bakterii (m.in. Cetobacterium somerae i Hafnia alvei) pochodzących z jelita dorosłych osobników składających jaja[117].
W gatunku tym płeć determinowana jest przez środowisko rozwoju organizmu jak i przez środowisko hormonalne[118]. Przy inkubacji jaj w temperaturze 20 °C wylęga się mniej więcej tyle samo samców co samic[118]. Przy wyższych temperaturach natomiast rodzi się proporcjonalnie więcej samców – w temperaturze wody 28 °C około 2/3 nowo narodzonych osobników to samce[119]. W naturze sukces wylęgowy wynosi około 30%, a przeżywalność młodych osobników jest bardzo niska[95]. Larwa wydostaje się z jaja poprzez skręty ciała, w czym pomaga również rozszerzenie i rozluźnienie zewnętrznej osłonki jaja[115].

Dojrzewanie i wzrost
Nowo wyklute larwy mierzą według różnych doniesień 2-3,5 cm. długości i ważą 0,27-0,7 grama[28][109][120]. Posiadają również dobrze rozwinięte skrzela o długości około 1 cm[115]. 8-dniowe larwy mierzą 3,3-4,0 cm., a te w wieku około 26-28 dni 3,9-4,5 cm[109][121]. W pierwszym miesiącu życia górna część ciała ma jaskrawy czerwonoczarny kolor, a dolna, na której obecny jest pęcherzyk żółtkowy – złotożółty[109]. Następnie kolor grzbietu zmienia się na brązowy, a brzucha na żółtawobiały[109]. Miesiąc po wykluciu u larw wyodrębniają się palce i znacznie wydłużają kończyny[115]. Dochodzi wtedy również do hibernacji, a hibernujące larwy mierzą 4-5 cm długości[28]. Przez pierwsze miesiące życia larwy odżywiają się głównie substancjami odżywczymi zawartymi w pęcherzyku żółtkowym oraz w pewnym stopniu pokarmem zwierzęcym (podobnie jak osobniki dorosłym, robią to głównie w nocy), jednakowoż ich dieta nie jest dobrze poznana – wiadomo natomiast, że część diety stanowi plankton[95][109]. Występuje różnica w tempie wzrostu pomiędzy płciami – samce zazwyczaj rosną szybciej[119]. Około 100 dni po wykluciu u larw zaczynają rozwijać narządy płciowe, na co wpływa temperatura i hormony płciowe (jako że podanie młodym osobnikom estradiolu doprowadziło do zaburzenia struktury płci i populacji, w której 81-100% osobników stanowiły samice). Zidentyfikowano wiele genów regulujących szlaki sygnałowe odpowiedzialne za rozwój gonad:
| Samice | Samce |
|---|---|
| Lhx9 – proporcjonalnie większa ekspresja w jajnikach niż w jądrach[122] | UCH-L1 – odpowiedzialny za zsynchronizowany rozwój jąder i plemników[123] |
| 15 z 21 zbadanych genów Fox, np. Foxl2 biorący udział w rozwoju jajowodu i oocytów[124][125] | 3 z 21 zbadanych genów Fox[124] |
| Niektóre geny CYP, np. Cyp19a, Cyp26a[118][126][127] | Niektóre geny CYP[126] |
| Gen PRLR (receptor prolaktyny), którego ekspresja u samic zwiększa się pomiędzy 1. a 6. rokiem życia, kiedy to osiągana jest dojrzałość płciowa[128] | Star – bierze udział w spermatogenezie[129] |
| Pozostałe geny, takie jak ZP3, czynnik transkrypcyjny TFIII, WNT2B[118] | Wt1 – bierze udział we wczesnym rozwoju jąder[129] |
| Pozostałe geny takie jak gen kodujący hormon antymüllerowski (Amh), Dmrt1, FGF17, GATA4, Sf1[118] |
W rozwoju narządów płciowych bierze również udział niekodujący RNA – głównie miRNA, piRNA i tsRNA[78]. Wśród 6-miesięcznych osobników nie ma istotnych różnic anatomicznych pomiędzy dwiema płciami[130]. W wieku 6 miesięcy rozpoczyna się regularne linienie, do którego dochodzi raz na miesiąc lub częściej (skóra jest następnie zjadana przez młodego osobnika)[109]. Po osiągnięciu długości 6 cm, co następuje mniej więcej w 9 miesiącu życia, płazy te rosną około 10 cm na rok i osiągają następujące rozmiary[28]:
- 40 cm długości i 3,5 kg 4 lata po wykluciu
- 50 cm długości i 4,0 kg 5 lat po wykluciu
- 100 cm długości i 6 kg 8 lat po wykluciu
Po osiągnięciu długości odpowiadającej 60% ostatecznej długości tempo wzrostu maleje[28]. Do przeobrażenia w osobnika dorosłego dochodzi przy długości ciała 20-25 cm[109]. Dokładny wiek zależy od dostępności pożywienia, a także od temperatury wody (salamandry olbrzymie chińskie trzymane w zimniejszej wodzie później przechodzą przeobrażenie)[109]. U 2-3-letnich osobników następuje zanik skrzeli – zamykają się szczeliny skrzelowe, a skrzela zastępowane są przez płuca[49][109]. Proces ten jest w dużej mierze regulowany przez miRNA[131]. Zmienia się wówczas budowa anatomiczna głowy i otworu gębowego, a także struktura przewodu pokarmowego, w którym zaczynają wyodrębniać się narządy takie jak dwunastnica i odbytnica[109][132]. Zmienia się również flora bakteryjna przewodu pokarmowego i wzrasta proporcjonalny udział Firmicutes[132]. Na wolności młode osobniki zaczynają pożywiać się krabami i krewetkami w wieku 3-4 lat[109].

Dojrzewanie płciowe rozpoczyna się w 4. roku życia, kiedy to u samców pojawiają się gamety, spermatocyty I i II rzędu oraz nasienie w kanalikach nasiennych, a u samic pęcherzyki Graafa w jajnikach[78][95]. Pełna dojrzałość płciowa osiągana jest w wieku 5-6 lat, możliwe, że w niektórych populacjach później – około 8. roku życia[109]. Płeć można rozpoznać za pomocą ultrasonografii dopplerowskiej, która pozwala zaobserwować jajniki lub jądra w ciele płaza, a także za pomocą markerów genetycznych takich jak sekwencje adf431 czy adf340 występujące wyłącznie u samic[133][134].
| Wiek w latach | Długość ciała w centymetrach | Waga w gramach | Cechy fizyczne |
| 1 | 5 | 25-30 | Obecne zewnętrzne skrzela |
| 2 | 15 | 50 – 70 | Stopniowe zanikanie zewnętrznych skrzeli |
| 3 | 30 | 175-200 | Brak zewnętrznych skrzeli |
| 4 | 40 | 500 – 600 | Rozpoczyna się dojrzewanie płciowe |
| 5 | 50 | 1250-1500 | Osiągnięcie dojrzałości płciowej |
Długość życia
Jeden z najdłużej żyjących płazów świata[109]. Szacuje się, że na wolności gatunek ten może żyć 50-60 lat lub dłużej[109]. W niewoli długość życia wynosi co najmniej 25 lat[109].
Rozmnażanie w hodowli
W niewoli zwierzętom tym w celach rozrodczych buduje się niekiedy specjalne betonowe komnaty połączone ze sztucznym strumieniem siecią podwodnych tuneli[113]. W hodowli rozród zazwyczaj indukowany jest zastrzykami hormonalnymi, które stymulują rozwój plemników i owulację[135]. Dzięki utrzymaniu prawidłowej temperatury (18-21 °C), poziomu natlenienia (>5mg/L), natężenia oświetlenia (300 luksów) oraz poprzez wstrzykiwanie hormonów takich jak gonadotropina kosmówkowa i analog gonadoliberyny sukces wylęgowy może zostać zwiększony do ponad 76%[136]. Wykonuje się również wstrzykiwanie oksytocyny oraz sztuczne unasienianie[137]. Coraz popularniejszy jest również rozród metodami naturalnymi[109]. W związku z częstymi infekcjami bakteryjnymi niezapłodnione i zainfekowane jaja powinny być regularnie usuwane[93]. Na farmach w pierwszym roku życia młode osobniki odżywiają się wyłącznie substancjami zawartymi w pęcherzyku żółtkowym. W drugim roku życia zaczynają również pożywiać się bezkręgowcami, takimi jak kompostowce różowe dostarczanymi przez pracowników hodowli[132]. W trzecim roku życia młode osobniki odżywiają się wyłącznie pokarmem zwierzęcym, głównie krewetkami i krabami[132]. W warunkach hodowlanych wzrost larw jest znacznie szybszy niż na wolności i mogą one osiągać długość 24–30 cm rok po wykluciu[28]. Jednocześnie osobniki te są lżejsze niż dzikie płazy o tej samej długości ciała[138].
Choroby

Infekcje wirusowe
Gatunkowi temu zagrażają głównie infekcje wirusowe często występujące na farmach[109]. Za infekcje odpowiadają wirusy z rodziny Iridoviridae – rodzaje Ranavirus i Iridovirus, które przenoszą się głównie poprzez transmisję poziomą[109][141]. Pierwsze zakażenia stwierdzono w 2009 roku, kiedy to w prowincji Shaanxi doszło do epidemii chorób wywoływanych przez ranawirusy[15]. Rozwój epidemii ułatwiają niewłaściwe warunki hodowlane, w tym duże bardzo duże zagęszczenie osobników w jednym zbiorniku na farmach, a także handel płazami pomiędzy różnymi farmami[15].
Dotychczas epizootię zaobserwowano w prowincjach Hubei, Hunan, Syczuan, Shaanxi i Zhejiang, a epidemie prowadzą do znaczących strat finansowych na farmach[109][142]. Wirusy infekujące salamandrę olbrzymią chińską należą do kilku blisko spokrewnionych gatunków, którym zostały nadane wstępne nazwy takie jak Chinese giant salamander iridovirus (GSIV)[142]. Wirusy te spokrewnione są z wirusami infekującymi żabę Lithobates grylio, co może sugerować, że doszło do międzygatunkowego przenoszenia się wirusów podczas karmienia osobników A. davidianus zainfekowanymi żabami na farmach[15]. Infekcje często prowadzą do śmierci salamandry olbrzymiej chińskiej, a śmiertelność na farmach wynosi 60-95% i jest wyższa u młodych osobników i larw[109]. Zakażone osobniki umierają zazwyczaj po 1-2 tygodniach od początkowej infekcji[109]. Wykazano, że osobniki, u których liczba wirusów w ciele utrzymywana była na niskim poziomie, mogły przetrwać infekcję[143].
Biologia molekularna wirusów atakujących A. davidianus jest przedmiotem licznych badań badań. Wiadomo, że długość genomu Andrias davidianus ranavirus (ADRV) wynosi ponad 106 000 bp i że genom ten koduje około 95 białek[144]. Podczas infekcji komórek ADRV wiąże się z siarczanem heparanu obecnym na powierzchni komórki[145]. Spokrewniony GSIV wnika do wnętrza komórki poprzez endocytozę, do której dochodzi około godzinę po początkowej infekcji[139]. Następnie rdzeń wirusa transportowany jest do jądra komórkowego, w którym dochodzi do syntezy wirusowych białek, następnie zwijanych w cytoplazmie[139].
Po 12-24 godzinach od początku infekcji część wirionów, już po syntezie nukleokapsydu, wydostaje się z komórki poprzez pączkowanie[139]. Po 24-48 godzinach od początku infekcji dochodzi do lizy komórki (za którą odpowiada głównie działanie kaspaz[146]). Dzięki niej pozostała część wirionów może wydostać się i przeniknąć do następnych komórek[139]. Wirusy te infekują głównie nerki, wątrobę, śledzionę i płuca, a niektóre tkanki, takie jak jądra, nie są infekowane[141][147]. Na poziomie komórkowym dochodzi m.in. do obumierania hepatocytów, a także przesunięcia się jądra bliżej błony komórkowej[140]. Do najbardziej powszechnych objawów należą[109]:
- obrzęk
- krwawienie
- wrzody
- martwica tkanek i organów
- letarg
- wymioty
- krwawe stolce
- utrata wagi.
W zależności od najbardziej widocznych objawów można wyróżnić kilka miejscowych nazw chorób wywoływanych przez wirusy – jeżeli występuje obrzęk i krwawienie w obrębie głowy, choroba nazywana jest chorobą wielkiej głowy (ang. big head disease), jeżeli podobne symptomy występują na stopie – chorobą wielkiej stopy (ang. big foot disease)[15]. Przy martwicy nabłonka jamy ustnej choroba nazywana jest chorobą złej buzi (ang. bad mouth disease), a przy martwicy ogona chorobą złego ogona (ang. bad tail disease)[15].
Inne patogeny
Dochodzi również do infekcji bakteryjnych przez m.in. następujące bakterie:
- Aeromonas hydrophila – Gram-ujemna bakteria często infekująca wodne zwierzęta[148]
- A. veronii – infekcje te mogą prowadzić do patologicznych zmian w wielu narządach, a także do śmierci zwierzęcia[149]
- Citrobacter freundii[150]
- Edwardsiella tarda[151]
- Pseudomonas fluorescens[152]
- Morganella morganii – infekcja może prowadzić do owrzodzeń na skórze i śmierci płaza[153]
Odnotowano również infekcje przez orzęski z rodzaju Balantidium – B. sinensis i B. andianusis[154], lęgniowce z rodzaju Saprolegnia[155] oraz przywry z gatunków Liolope copulans[14] i Neoandrincola muchuanensis[156]. W okazie muzealnym wykryto również Batrachochytrium dendrobatidis – gatunek grzyba wywołujący chytridiomikozę, która dziesiątkuje populacje płazów na świecie[157]. Jednakowoż wpływ tego gatunku grzyba na naturalne populacje A. davidianus nie jest znany[157]. W badaniu Tapley i in. (2021) u 20 dziko żyjących osobników nie wykryto obecności ranawirusów ani Batrachochytrium dendrobatidis[158].
Ochrona przed patogenami
Gatunek ten cechuje się proporcjonalnie większą liczbą genów odpowiadającą za regulację odpowiedzi immunologicznej niż ryby i ssaki[71]. Zbadano dotychczas funkcje receptorów rozpoznających wzorce, cytokin, czynników biorących udział w regulacji działania dopełniacza, receptorów limfocytów T i B, a także białka regulujące szlaki sygnałowe JAK-STAT lub kinazy aktywowane mitogenami[159]. Salamandra olbrzymia chińska posiada również dodatkowe kopie niektórych receptorów toll-podobnych jak np. TLR2 czy TLR5, co związane jest z życiem w dwóch środowiskach – wodnym i lądowym i tym samym narażeniem na działanie bardziej zróżnicowanej grupy patogenów[160]. Ważną rolę w odpowiedzi immunologicznej odgrywają również receptory NOD-podobne (NLR) oraz receptory RIG-I-podobne (RLR)[160]. Układ odpornościowy posiada kilka różnic w porównaniu z innymi płazami[161]:
- przeciwciało IgD posiada mniej regionów stałych; ponadto salamandra olbrzymia chińska jest jedynym zbadanym gatunkiem zwierzęcia niebędącym ssakiem, u którego IgD posiada region zawiasowy,
- przeciwciało IgY nie posiada regionu Fc,
- zwierzę to jest pierwszym płazem, u którego opisano obecność białka IFI6. Jego dokładna rola nie jest znana.

Do obrony przed wirusami A. davidianus wykorzystuje głównie odpowiedź odpornościową nieswoistą[163]. Odpowiedź ta regulowana jest w dużej mierze przez interferony typu I, które stymulują np. ekspresję genu Mx, hamujcego syntezę wirusowego kapsydu poprzez zmniejszenie ilości wirusowego białka major capsid protein, MCP, które spełnia istotną rolę w replikacji wirusa[164]. Ponadto do obrony przed infekcjami wirusowymi wykorzystywane są receptory TLR7[165] i TLR9[166], miRNA[167], białko galektyna 1[163], autofagia[143], apoptoza[143] i egzosomy zawierające enzym UCHL1[141]. Ważną rolę odgrywa również główny układ zgodności tkankowej, MHC, który u tego gatunku cechuje się dużą różnorodnością[168]. Ponadto częstość epidemii na farmach może zostać zmniejszona poprzez poddawanie kwarantannie nowo przybywające osobniki, a także poprzez dezynfekcję wody stosowanej na farmach, która często spuszczana jest do pobliskich zbiorników, co może prowadzić do epidemii wśród dzikich populacji[15]. Możliwe jest również wykorzystanie szczepionek, w których głównym białkiem wirusa jest zazwyczaj MCP[169]. Przetestowano dotychczas m.in. szczepionki DNA, szczepionki rekombinowane i szczepionki inaktywowane[170]. Wszystkie rodzaje szczepionek zmniejszyły częstość infekcji i doprowadziły do przeżywalności osobników A. davidianus na poziomie 67-84%[170].
W obronie przeciwko infekcjom bakteryjnym wykorzystywane są m.in. katelicydyny, peptydy obecnie głównie w skórze, które niszczą błonę komórkową bakterii[171]. Inne białka wykorzystywane do obrony przeciwko bakteriom to interleukina 18 (w genomie A. davidianus obecne dwa loci, co jest rzadko spotykane wśród zwierząt[172]), ferrytyny zmniejszające ilość żelaza dostępną dla mikroorganizmów[173], a także proteazy katepsyny – katepsyna C[162] oraz katepsyna A[174].
Ochrona
Stan populacji
Populacja salamandry olbrzymiej chińskiej malała stopniowo w związku z gospodarką rabunkową od co najmniej roku 200 p.n.e. do lat 50. XX wieku[14]. Tempo kurczenia się zasięgu oraz rozmiarów populacji zwiększyło się znacznie, począwszy od lat 50. XX wieku, kiedy to zaczęła postępować fragmentacja siedliska[84]. Polowania na większą skalę rozpoczęły się w latach 60. XX wieku, a w latach 70. XX wieku w niektórych prowincjach (np. Henan) zanotowano spadek w liczbie i masie wyławianych osobników[82][84]. W niektórych regionach spadek populacji rozpoczął się później – w pasmie górskim Qin Ling gatunek ten występował licznie do końcówki lat 70. XX wieku, kiedy to w roku 1978 ludność z południa (uznająca salamandrę olbrzymią chińską za przysmak) zaczęła migrować na północ, gdzie żywiła się napotkanymi osobnikami A. davidianus[14]. Szacuje się, że między rokiem 1950 i 2000 w całych Chinach zasięg jak i rozmiar populacji skurczyły się o 60-90%[82]. Do roku 2012 obecne były małe i średnie populacje, a liczebność niektórych z nich stopniowo rosła[14]. Jednakowoż od około 2014 do 2018 roku liczba dziko żyjących osobników po raz kolejny zaczęła dramatycznie spadać[14]. Obecnie odkrywane są co jakiś czas nowe populacje, jednakowoż większość populacji całkowicie zanika, a ich rozmiar, w szczególności tych zasiedlających jaskinie, jest bardzo mały[175]. W badaniu terenowym autorstwa Turvey i in. (2018) obecność salamandry olbrzymiej chińskiej stwierdzona została w 4 z 97 przebadanych lokalizacji i możliwym jest, że napotkane osobniki były uciekinierami z hodowli, a nie dziko żyjącymi zwierzętami[87]. W niektórych regionach obecność A. davidianus potwierdzają jedynie zeznania miejscowej ludności[88]. Populacje różnią się między sobą różnorodnością genetyczną, która w niektórych populacjach cały czas jest stosunkowo wysoka[175]. Jednakowoż w większości populacji różnorodność ta maleje[175].
Status prawny
Płaz ten zalicza się do tzw. gatunków EDGE (ang. EDGE species, Evolutionary Distinct and Globally Endangered), co oznacza, że posiada wysoki wynik wskaźnika EDGE, który łączy status ochronny ze stopniem odrębności genetycznej danego taksonu[176]. Gatunek ten ma drugi najwyższy wynik EDGE ze wszystkich płazów, na pierwszym miejscu znajduje się nowozelandzki płaz bezogonowy, liopelma Archeya (Leiopelma archeyi)[177]. W czerwonej księdze gatunków zagrożonych wymieniony jako pojedynczy gatunek – Andrias davidianus[175]. W 1996 roku posiadał status DD (brak danych), a od 2004 roku jest gatunkiem krytycznie zagrożonym (CR)[178]. Gatunek ten znajduje się również w załączniku I konwencji o międzynarodowym handlu dzikimi zwierzętami i roślinami gatunków zagrożonych wyginięciem (CITES)[15], w aneksie A rozporządzenia Unii Europejskiej dotyczącego handlu dziką fauną i florą, odpowiadającemu w dużym zakresie załącznikowi I CITES[179][180] oraz w amerykańskiej ustawie Endangered Species Act, w której ma status gatunku zagrożonego[175]. W 1988 roku rząd Chin wydał dokument o ochronie dzikich zwierząt China's Wild Animal Protection Act, w którym salamandrze olbrzymiej chińskiej nadany został grade (stopień) II, w związku z czym odłów osobników z obszarów chronionych jest nielegalny[175]. Dziko złapane osobniki są chronione prawnie, ale ich potomstwo urodzone w hodowli może być legalnie sprzedawane, np. do restauracji[175]. Farmy, na których płazy te są hodowane, są prawnie zobowiązane do posiadania licencji zezwalającej na hodowlę i sprzedaż A. davidianus, istnieje natomiast wiele nielegalnych farm działających bez licencji[175]. Niektóre samorządy i firmy zajmujące się hodowlą salamander olbrzymich chińskich prowadzą kampanie mające na celu zniesienie statusu gatunku chronionego prawnie[175].
Zagrożenia
Gatunkowi temu zagrażają głównie gospodarka rabunkowa, utrata środowiska, a także zanieczyszczenia środowiska i zmiany klimatu[15]. Największe zagrożenie stanowi nielegalny odłów, który przeprowadzany jest przez miejscową ludność jak i przez profesjonalnych kłusowników, którzy zazwyczaj wyłapują wszystkie osobniki zasiedlające dany potok[84]. Płazy te często wyłapywane są również na obszarach chronionych, m.in. w rezerwacie Kuejczou[181]. Do polowań na salamandry olbrzymie chińskie stosuje się następujące metody[175]:
- Haki bow-hooks (najczęściej stosowana metoda) – haczyki, na które nadziane są ryby lub płazy bezogonowe służące jako przynęta. Pułapka następnie zostawiana jest przy wejściu do nory salamandry olbrzymiej chińskiej[84]. Metoda ta pozwala na złapanie wielu osobników i widywane były łodzie canoe posiadające około 150 bow-hooks[84].
- Łapanie w sieć rybacką, co przeprowadzane jest często w nocy, kiedy to płazy namierzane są przy użyciu latarek[84][181].
- Łapanie ręczne
- Łowienie A. davidianus poprzez rażenie go prądem (ang. Electrofisihing)
- Używanie trucizn takich jak wapno lub insektycyd fenpropatryna, który był ceniony ze względu na fakt, że unieruchamiał zwierzę bez powodowania natychmiastowej śmierci, dzięki czemu płaz mógł być transportowany żywy i świeży[14][181].
- Materiały wybuchowe[181]
- Osuszanie zbiorników wodnych – metodę tę stosuje się zazwyczaj dla wyłapania osobników zasiedlających jaskinie

Ponadto larwy rozwijające się w jaskiniach mogą być wyłapywane podczas opuszczania jaskiń[175]. Wraz z nadejściem wolnego rynku pod koniec lat 80 XX wieku cena mięsa salamandry olbrzymiej chińskiej znacząco się zwiększyła, co spowodowało zmianę sposobu łapania z ręcznego na łapanie z wykorzystaniem trucizn[181]. Fenpropatryna stosowana w latach 1992–1998 doprowadziła do znacznego spadku liczebności A. davidianus, a także zwierząt, którymi płaz ten się żywi. Po 2004 roku straty w populacjach salamandry olbrzymiej chińskiej były tak znaczące, że zaniechano stosowania trucizn i bow-hooks z powodów finansowych[110]. Płazy te często są również przemycane drogą lądową i powietrzną[14]. Złapane osobniki są wykorzystywane w następujących celach:
- W branży kulinarnej, jako że płaz ten uznawany jest za przysmak i za najsmaczniejsze zwierzę przez wielu Chińczyków[175]. Należy podkreślić również, że mięso dzikich osobników jest często bardziej cenione[175]. W prowincji Kuejczou cena mięsa wzrosła od 5 dolarów/kg w latach 80. XX wieku do 100 dolarów/kg w roku 1998[84]. W 2004 roku w niektórych prowincjach cena ta wynosiła 150 dolarów/kg, co napędzało rozwój czarnego rynku[84]. Jednakowoż cena mięsa za kilogram zmalała od 200 dolarów w 2009 roku do 20-30 dolarów w 2014 roku w związku ze zwiększoną wydajnością farma hodujących A. davidianus i zmniejszonym popytem[14][155]. W związku z tym zmniejszył się również poziom kłusownictwa[14][155]. Konsumpcja na obszarach wiejska maleje od lat 80 XX wieku[16].
- W tradycyjnej medycynie chińskiej, jako że produkty otrzymane z salamandry olbrzymiej chińskiej są wykorzystywane w leczeniu anemii i malarii, a także innych dolegliwości od co najmniej 2300 lat[175]. Produkty te wykorzystywane są również w niektórych kosmetykach[175].
- (Rzadko) jako zwierzę domowę[175]
- Do hodowli na farmach. Perspektywa zysku finansowego płynącego z hodowli płaza prowadzi do powstawania wielu nielegalnych hodowli prowadzonych przez miejscową ludność oraz do odłowu salamander olbrzymich chińskich ze środowiska naturalnego, również z obszarów chronionych[181]. W związku z dużymi korzyściami finansowymi powiązanymi z handlem A. davidianus dochodzi również niekiedy do przestępstw jak np. w powiecie Liuba, kiedy to w 2009 roku zabita została osoba strzegąca farmy, a wszystkie hodowane larwy skradzione[110]. W związku z niewłaściwymi metodami hodowlanymi wiele farm jest niezdolnych do rozrodu osobników z drugiego pokolenia – jest to spowodowane m.in. niewielką zmiennością genetyczną hodowanych osobników, jako że często jeden samiec zapładnia wiele samic[83]. W związku z powyższym, a także innymi cechami takimi jak większa odporność na choroby i szybszy wzrost dzikich osobników właściciele farm często decydują się na odłów osobników dzikich w celu wzbogacenia inwentarza rozpłodowego[16][175]. Zyski finansowe powiązane z hodowlą A. davidianus prowadzą do paradoksalnej sytuacji, kiedy to płazy te praktycznie nie występują na wolności, a farmy przepełnione są hodowanymi osobnikami – w 2015 roku na farmach hodowanych było łącznie 12,5 miliona osobników[26][182]. Ponadto na farmach salamandrom olbrzymim chińskim zagrażają również epidemie chorób wirusowych, które spowodowane są w dużej mierze brakiem kwarantanny dla nowo nabytych osobników oraz brakiem badań przesiewowych[175]. Co więcej, woda wykorzystywana na farmach często spuszczana jest do pobliskich zbiorników wodnych, co zwiększa szanse przeniesienia się chorób na dzikie populacje[175]. Ponadto zwierzęta te często transportowane są pomiędzy różnymi hodowlami (cena za młodego osobnika ważącego ponad 2 kilogramy może przekroczyć 1500 dolarów) oraz niekiedy wypuszczane na wolność w ramach programów ochrony bez uprzedniego zbadania stanu zdrowia – szacuje się, że w latach 2008-2018 co najmniej 72000 salamander olbrzymich chińskich zostało wypuszczonych z farm na wolność[23]. Brak testów genetycznych sprawia, że osobniki z poszczególnych kladów A. davidianus mogą być wypuszczane w środowisku niebędącym częścią ich natywnego zasięgu, co prowadzić może do hybrydyzacji i introgresji pomiędzy różnymi taksonami, tym samym zmniejszając różnorodność genetyczną oraz prowadząc do wymarcia niektórych taksonów Andrias (np. A. sligoi), co widoczne jest w szczególności w populacjach z Huang He[23][175]. Właściciele farm nie są zainteresowani utrzymaniem czystości genetycznej przetrzymywanych osobników, a skupiają się jedynie na pożądanych cechach, takich jak szybkie tempo wzrostu, tym samym potencjalnie łącząc ze sobą niespokrewnione klady[15].

Do innych zagrożeń należą:
- Utrata i modyfikacja środowiska naturalnego – spowodowane jest to przekształceniem ziemi na cele rolnicze, wylesianiem, a także rozwojem przemysłu oraz budową tam, dróg i mostów[175]. Udowodniono, iż budowa tam, jak np. w 10 powiatach w prowincji Hunan, mająca na celu usprawnienie działalności elektrowni, ma negatywny wpływ na rzeczny ekosystem i zamieszkujące go gatunki[84]. Pokazano również, że górnictwo, a także wydobycie piasku i żwiru w pobliżu rzek, prowadzi do zanieczyszczenia wody, która dostaje się następnie do podwodnych kryjówek płaza, a także zmniejsza ilość dostępnego pożywienia[175]. Ponadto do niektórych podziemnych rzek zasiedlanych przez A. davidianus odprowadzane są ścieki, co znacznie obniża jakość wody[110]. Fragmentacja siedliska może z kolei zwiększyć tempo wymierania miejscowych populacji[175]. Według modelu P. Zhang i in. (2020) w przyszłości to postępująca urbanizacja i wzrastająca gęstość zaludnienia, a nie zmiany klimatyczne doprowadzą do największego zmniejszenia się zasięgu[183]. Należy zauważyć, że to najprawdopodobniej nadmierny odłów, a nie degradacja środowiska naturalnego jest głównym powodem spadku w liczebności populacji[158].
- Zmiany klimatu – płaz ten wrażliwy jest również na wysokie (>24 °C) temperatury wody, w związku z czym zagrażać mu będzie również globalne ocieplenie[28][175]. Wzrost temperatury wody i powietrza może doprowadzić do wcześniejszego wybudzania się z hibernacji oraz wolniejszego wzrostu podczas okresu zimowania[183]. Model Z. Zhang i in. (2020) wykazał, że w 2050 roku ocieplenie klimatu doprowadzi do zmniejszenia liczby odpowiednich siedlisk o 55,1-83,0%, w związku z czym gatunek ten będzie migrował na wyższe wysokości bezwzględne i będzie również kolonizował niektóre nowe regiony[184]. Model ten wykazał, że do roku 2070 zasięg może się skurczyć o 53,1-92,6%[184].
- Turystyka – wykazano, że przy rocznej liczbie turystów przekraczającej 100 000 może dojść do negatywnych zmian w ekosystemie, takich jak większe natężenie dźwięku, a także większe zanieczyszczenie wody azotem, fosforem oraz mikroorganizmami[185].
Działania ochronne
Portal EDGE of Existence informuje, że w ochronie A. davidianus kluczowe będą następujące działania: praca z interesariuszami, poprawa stanu wiedzy o gatunku oraz przeznaczanie większej ilości środków na działania ochronne[186]. Obecnie w niektórych prowincjach takich jak Shaanxi urzędy rybackie zajmują się przechwytywaniem nielegalnie złapanych osobników, które następnie dostarczane są do licencjonowanych farm[175]. Jednakowoż kłusownicy rzadko pociągani są do odpowiedzialności karnej, a niektórzy z nich otrzymują rekompensatę[175]. Wśród najważniejszych działań ochronnych wymienia się:
- Reintrodukcję – osobniki hodowane na farmach wypuszczane są na wolność od 1972 roku[22]. Każdego roku chińskie ministerstwo rolnictwa wyłania 28 licencjonowanych farm, które zobowiązane są do wypuszczenia 13% osobników mierzących ponad 21 cm na wolność, za co następnie otrzymują rekompensatę z funduszów rządowych i samorządowych[15]. W badaniu z wykorzystaniem nadajników śledzących wypuszczone płazy wykazano, że część takich osobników jest w stanie przeżyć na wolność przez co najmniej 5 miesięcy[155]. Jednakowoż wiele wypuszczonych osobników pada ofiarą kłusowników, a także umiera w związku ze stresem i ranami powiązanymi z operacją wszczepiania nadajnika[155][175]. Przed wypuszczeniem salamander olbrzymich chińskich należy poddać je badaniom genetycznym, które potwierdzą, że na wolności nie dojdzie do mieszania się niespokrewnionych taksonów[175]. Zhang i in. (2014) sugerują, że należy wypuszczać osobniku w wieku 4-5 lat, kiedy to osiągają one wagę zbliżoną do masy dzikich płazów w tym samym wieku (młodsze hodowlane osobniki są lżejsze od ich dzikich rówieśników)[138]. Ponadto wypuszczaniu płazów na wolność towarzyszyć powinny ceremonie medialne zwiększające społeczne zainteresowanie tym gatunkiem[155].
- Ochronę naturalnych siedlisk gatunku. W 2015 roku w Chinach istniało 21 rezerwatów przyrody stworzonych wyłącznie w celu ochrony A. davidianus, a w 2009 roku zarejestrowanych było również 38 rezerwatów, w których płaz ten był jednym z kilku najważniejszych chronionych gatunków[26][110]. Większość z rezerwatów natomiast zmaga się problemami takimi jak niewystarczające fundusze oraz kłusownictwo[84]. Obecnie największą uwagę powinno poświęcić się ochronie siedlisk, w których dochodzi do rozrodu, a także jaskiń, w których populacje cechują się niską efektywną wielkością populacji w związku z niedawnym efektem wąskiego gardła[84][187]. Populacjom zasiedlającym jaskinie należy również ułatwić przemieszczanie się pomiędzy różnymi podziemnymi rzekami, co pomoże zwiększyć ich różnorodność genetyczną[110]. Powinno się również zakazać tworzenia farm w rezerwatach oraz w ich pobliżu, co zmniejszyłoby ilość osobników nielegalnie odławianych na obszarach chronionych, a także zwiększyć kary (które obecnie są za niskie lub nie są egzekwowane) za nielegalny odłów i hodowlę[16][182]. Ponadto należy ograniczyć napływ zanieczyszczeń chemicznych do wody, a także zakazać stosowania trucizn i materiałów wybuchowych podczas polowania i wspierać rozwój zrównoważonej gospodarki leśnej[175]. Akcje ochronne powinny działać na zasadzie współpracy pomiędzy sektorem rolniczym, policją, leśnictwem oraz rządem[84]. Niektóre programy ochrony skupiają się również na odbudowie populacji będących pożywieniem dla salamandry olbrzymiej chińskiej, a także testują sztuczne nory rozrodcze zwiększające sukces rozrodczy[14]. Dzięki plastyczności fenotypowej niektóre populacje mogą być w stanie przystosować się do niekorzystnych warunków panujących na niektórych obszarach zasięgu[14].
- Lepsze zbadanie biologii salamandry olbrzymiej chińskiej. Płaz ten wymaga badań przez wyspecjalizowanych biologów konserwacyjnych, którzy monitorowaliby długoterminową sytuację gatunku na wolności, a także identyfikowaliby potencjalne zagrożenia[84]. Należy przeprowadzić również standaryzację protokołów badań wykonywanych na tym gatunku, a także rozwinąć działalność zakładów hodowlanych zarządzanych przez ogrody zoologiczne, organizacje ochrony przyrody i organizacje rządowe[84][175]. Obecnie istnieje grupa badawcza Chinese Giant Salamander International zrzeszająca naukowców z Zoological Society of London (ZSL), a także z instytutów i uniwersytetów z chińskich miast Kunming, Shaanxi oraz Guiyang mająca na celu promowanie ochrony salamandry olbrzymiej chińskiej[89]. Ponadto należy również zaktualizować status gatunku w Czerwonej Księdze Gatunków Zagrożonych[16]
- Utrzymanie czystości genetycznej gatunku. Szczególne znaczenie ma w tym wypadku ochrona ex situ i genetyka konserwatorska zakładająca ochronę czystych genetycznie taksonów w hodowlach, a także badania genetyczne osobników trzymanych w ogrodach zoologicznych i na farmach[87][89]. Należy także utworzyć bank spermy, w którym przetrzymywane byłoby nasienie osobników czystych genetycznie[14]. Powinno się również kontrolować strategie reintrodukcji osobników hodowanych w niewoli, jako że w hodowli może dojść do szybkiej akumulacji alleli szkodliwych (ang. deleterious alleles), co zmniejszy dostosowanie wypuszczanych osobników[14].
- Kampanie mające na celu zwiększenie wiedzy społeczeństwa o statusie A. davidianus – ankieta przeprowadzona w prowincji Kuejczou wykazała, że mniej niż połowa respondentów wiedziała o tendencji spadkowej populacji salamandry olbrzymiej chińskiej[181]. W związku z powyższym do ochrony tego gatunku należy zaangażować miejscowych przywódców i ludność, co zwiększyłoby zainteresowanie miejscowej ludności sytuacją tego płaza[175]. Płaz ten powinien być również wykorzystywany jako gatunek sztandarowy w ekoturystyce, co zmieniłoby nastawienie miejscowej ludności, jako że obecnie większe korzyści finansowe czerpane są z odłowu niż z ochrony płaza[15]. Przeprowadzane są również warsztaty z ochrony płaza, jak np. w 2010 roku, kiedy to ZSL zorganizował w Shaanxi Normal University warsztaty International Conservation Workshop for the Chinese Giant Salamander, na których zjawiło się ponad 50 interesariuszy z różnych dziedzin takich jak nauka czy rolnictwo[15].
- Lepsze poznanie biologii wirusów i innych patogenów w celu zminimalizowania ryzyka wystąpienia epidemii na farmie, a także regularne inspekcje farm i kontrolowania panujących na nich warunków higienicznych[89][175].
Znaczenie użytkowe, kulturowe i naukowe
Salamandra olbrzymia chińska jako pożywienie oraz jej zastosowanie w lecznictwie
Gatunek ten jedzony jest przez ludność zamieszkującą Chiny od czasów prehistorycznych – w szczególności w południowej części Chin. Mięso ma delikatną konsystencję, a jego smak porównywany jest do smaku mięsa rybiego, kurzego, mięsa węża oraz żab i nazywane jest żywym żeńszeniem w wodzie (ang. live ginseng in the water)[26]. Płazy te często trzymane są w akwariach koło restauracji, w których tworzy się z nich zupy, gulasze oraz inne potrawy[188]. Mięso salamandry olbrzymiej chińskiej zawiera 18 aminokwasów, z czego 8 to aminokwasy egzogenne[26]. Tłuszcz obecny jest głównie w ogonie, a mięso cechuje się dużą zawartością nienasyconych kwasów tłuszczowych, w tym ω-3 i ω-6[26]. Mięso zawiera również duże ilości makroelementów i mikroelementów takich jak fosfor, cynk, mangan i miedź, wątroba z kolei bogata jest w witaminy A, B, D[26]. W tradycyjnej medycynie chińskiej uznaje się, że mięso to odżywia energię Qi oraz że posiada pozytywny wpływ na ludzką mądrość[26]. Używane jest ono do leczenia anemii, czerwonki i malarii, a także niestrawności u dzieci od dawnych czasów[26]. Ponadto pobudza apetyt[189]. Uznaje się również, że sok trzustkowy zmniejsza temperaturę ciała i poprawia wzrok[189]. Część z rzekomych korzyści potwierdzona została naukowo – wykazano, że mięso salamandry olbrzymiej chińskiej ma większą zawartość przeciwutleniaczy niż wołowina, wieprzowina, mięso kurze oraz rybie[26]. Karmienie muszki owocówki mięsem A. davidianus przedłużyło oczekiwaną długość życia, spowolniło starzenie, a także zwiększyło możliwości rozrodcze karmionych owadów[26]. U karmionych myszy zredukowało ono uczucie zmęczenia i zmniejszyło stężenie kwasu mlekowego we krwi[26]. Ponadto przewiduje się, że glikoproteiny salamandry olbrzymiej chińskiej mogą mieć właściwości przeciwnowotworowe, a maści zawierające mieszankę skóry, tłuszczu oraz śluzu A. davidianus skróciły proces gojenia ran u myszy z oparzeniami drugiego stopnia i odmrożeniami[26].

Znaczenie w kulturze
Gatunek ten jest częstym obiektem legend. Spekuluje się, że płaz ten zainspirował legendy o chińskich smokach[191]. Według innej legendy salamandra olbrzymia chińska może żyć w najgorętszym z ogni, a wczesnym przybyszom do Chin pokazywano ognioodporne okrycie wykonane rzekomo z wełny A. davidianus (w rzeczywistości ubiór ten wykonany był zapewne z azbestu)[14]. Gatunek ten jest często przedstawiany na ceramice kultury Yangshao, a jego tłuszcz wykorzystywany był również w lampach i pochodniach[14]. Istnieje również teoria głosząca, że chiński symbol yin i yang przedstawia dwa splecione osobniki salamandry olbrzymiej chińskiej[14][191]. Według innych legend rzekomy płacz wydawany przez salamandry olbrzymie chińskie powiązany jest z ludzkimi dziećmi – uważa się, że niektóre dzieci (np. te nieślubne lub martwe) zamieniają się w A. davidianus lub że są przez płaza zjadane[16]. Obecnie w niektórych regionach Chin uznaje się, że dotknięcie lub zjedzenie A. davidianus przynosi pecha[13][16]. Gatunek ten opisywany był również w mediach w 2019 roku, kiedy to wykazano, że to być może A. sligoi jest największym gatunkiem płaza[24]. O badaniu tym informowały m.in. National Geographic[192], New Scientist[193], The Independent[194], Sky[195], BBC[196]. W 2008 roku gatunek ten został wybrany jako najdziwniejszy zagrożony gatunek płaza przez London Animal Association of UK[110].
Hodowla salamandry olbrzymiej chińskiej
Gatunek ten zaczął być hodowany na farmach w latach 60. i 70. XX wieku w prowincjach Syczuan, Anhui i Shaanxi, a branża ta zaczęła się znacząco rozwijać od 2004 roku dzięki subwencjom rządowym[110][175]. W 2015 roku liczba farm hodujących A. davidianus wynosiła 2622, a liczba hodowanych osobników prawie 12,5 miliona[26]. Obecnie dokładny rozmiar branży nie jest znany[175]. Farmy skupiają się na hodowli osobników dorosłych lub larw, a licencja nadawana jest przez miejscowe urzędy rybackie[110][175]. W celu przyspieszenia wzrostu na niektórych farmach stosuje się przymusowe karmienie[110]. Branża ta jest bardzo dobrze rozwinięta w prowincji Shaanxi, gdzie w 2011 roku w spisie statystycznym odnotowano 2,6 miliona hodowanych salamander olbrzymich chińskich, a w 2010 roku w niektórych powiatach około 60% rodzin zatrudnionych było na farmach[15]. W tejże prowincji branża warta była około miliarda yuanów w 2009 roku[15]. W 2012 roku w farmach zlokalizowanych w paśmie Qin Ling leżącym w południowej części prowincji Shaanxi przetrzymywanych było 70% wszystkich osobników hodowanych w Chinach[15]. W Qin Ling hodowla A. davidianus jest jednym z najważniejszych obszarach lokalnej gospodarki wraz z hodowlą ziół i grzybów[15]. Wśród farm hodujących salamandry olbrzymie chińskie wyróżnić można dwa główne modele zarządzania[15]:
- Model firmowy (ang. company model) – cechuje się obecnością co najmniej jednej samowystarczalnej farmy działającej pod patronatem konkretnej firmy. Na tych farmach salamandry olbrzymie chińskie trzymane są zazwyczaj w ciemnych budynkach bez okien pod ziemią. Szacuje się, że obecnie na farmach tych przetrzymywanych jest około 42000 osobników dorosłych i 164000 młodych osobników złapanych w środowisku naturalnym[16].
- Model firmowo-małorolny (ang. company-plus-smallholders model) – w tym modelu firma rozdziela dużą część narodzonych płazów do pojedynczych domostw na wsiach, które następnie zajmują się ich odchowem. Firmy czasami płacą za budowę hodowli w domostwach, a także przesyłają młode salamandry olbrzymie chińskie oraz płacą pensję hodowcom, którzy w zamian zobowiązani są do kupna pożywienia dla płazów od sponsorującej firmy oraz do sprzedaży podrośniętych osobników do tejże firmy. W innym wariancie małorolni samodzielnie budują hodowlę, kupują młode osobniki od firmy bez zobowiązań z poprzedniego wariantu, ale również bez stałej pensji.
Istnieje również trzeci model – spółdzielni rozrodczych (ang. breeding cooperatives), które uczą swoich członków metod hodowlanych, a także zapewniają pomoc marketingową i prawną[15]. W powiecie Liuba (prowincja Shaanxi) istnieją dwie takie spółdzielnie zrzeszające około 300 członków z ponad 200 farm[15].

Przyszłość branży jest niepewna, gdyż opiera się ona praktycznie całkowicie na piramidzie finansowej[15]. W związku z polityką władz lokalnych promującej rozwój branży większość nowo urodzonych osobników sprzedawanych jest do nowo powstałych farm, a około 3% (wagowo), głównie osobniki chore i niezdolne do rozrodu, kupowana jest przez restauratorów[15].
Płaz ten trzymany jest również rzadko w ogrodach zoologicznych, gdzie hodowany jest od wczesnych lat 90. XX wieku (w ZSL London Zoo przetrzymywany był w latach 20. XX wieku)[197]. Osobniki zazwyczaj trzymane są pojedynczo w związku z terytorializmem oraz karmione są rybami, a także krewetkami i dżdżownicami. Obecnie nie istnieją programy hodowlane w ogrodach zoologicznych[197]. Salamandra olbrzymia chińska znajduje się w zbiorach m.in. następujących ogrodów zoologicznych:
- San Diego Zoo[198],
- Ocean Park Hongkong[199],
- Zoo w Duisburgu[200]
- ZSL London Zoo (przetrzymywany osobnik pochodzi z przemytu)[191],
- Ogród zoologiczny w Pradze, gdzie przetrzymywany jest najprawdopodobniej największy hodowlany okaz A. davidianus[31],
- Toronto Zoo[201],
- Ogród Zoologiczny w Moskwie[202].
Zastosowania naukowe
Gatunek ten jest coraz częstszym obiektem badań naukowych[14]. Może on służyć jako model do badania adaptacji podczas zmiany trybu życia z wodnego na lądowy[131]. Ponadto otrzymano linie komórkowe A. davidianus z grasicy (ang. thymus cell line (GSTC)), śledziony (ang. spleen cell line (GSSC)) oraz nerek (ang. kidney cell line (GSKC)), które wykorzystywane są w badaniach in vitro nad wirusami infekującymi salamandry olbrzymie chińskie jak i inne zwierzęta, takie jak amur biały[203][204]. Co więcej, wydzieliny salamandry olbrzymiej chińskiej testowane są jako źródło azotu przy tworzeniu aerożelów węglowych z nanocelulozy oraz jako kleje biologiczne (ang. bioadhesive) z różnymi medycznymi zastosowaniami[205][206].
Zobacz też
Przypisy
- ↑ Andrias davidianus, [w:] Integrated Taxonomic Information System (ang.).
- ↑ Ch.É. Blanchard. Note sur une nouvelle Salamandre gigantesque (Sieboldia Davidiana Blanch.) de la Chine occidentale. „Comptes Rendus Hebdomadaires des Séances de l’Académie des Sciences”. 73, s. 79, 1871. (fr.).
- ↑ A. David: Journal de mon Troisième Voyage d’Exploration dans l’Empire Chinoise. T. 1. Paris: Hachette, 1875, s. 326. (fr.).
- ↑ M.L.Y. Chang. Sur la salamandre geante de la Chine. „Bulletin de la Société Zoologique de France”. 60, s. 350, 1935. (fr.).
- ↑ C.H. Pope & A.M. Boring. A survey of Chinese Amphibia. „Peking Natural History Bulletin”. 15, s. 18, 1940. (ang.).
- ↑ C.-c. Liu. Amphibians of western China. „Fieldiana. Zoology Memoirs”. 2, s. 69, 1950. (ang.).
- ↑ F. Westphal. Die tertiären und rezenten eurasiatischen Riesensalamander (Genus Andrias, Urodela, Amphibia). „Palaeontographica. Abteilung A, Paläozoologie, Stratigraphie”. 110, s. 36, 1958. (niem.).
- ↑ A.H. Brame, Jr.. A list of the world's recent and fossil salamanders. „Herpeton”. 2, s. 5, 1967. (ang.).
- ↑ B.G. Naylor. Cryptobranchid salamanders from the Paleocene and Miocene of Saskatchewan. „Copeia”. 1981, s. 76–86, 1981. DOI: 10.2307/1444042. (ang.).
- ↑ Liang Gang, Geng Baorong, Zhao Ermi, Andrias davidianus, [w:] The IUCN Red List of Threatened Species 2017, wersja 2017-3 [dostęp 2018-04-12] (ang.).
- ↑ Zwierzęta: encyklopedia ilustrowana. Warszawa: Wydawnictwo Naukowe PWN, 2005. ISBN 83-01-14344-4.
- ↑ Agassiz – nomenclator zoologicus – nomenclatore zoologico [online], summagallicana.it [dostęp 2021-02-20].
- 1 2 3 4 5 Kate Jirik, LibGuides: Chinese Giant Salamanders (Andrias spp.) Fact Sheet: Taxonomy & History [online], ielc.libguides.com [dostęp 2021-02-20] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 Robert Browne i inni, The Sustainable Management of Giant Salamanders (Cryptobranchoidea). Review. [online], 5 listopada 2020.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 Andrew A. Cunningham i inni, Development of the Chinese giant salamander Andrias davidianus farming industry in Shaanxi Province, China: conservation threats and opportunities, „Oryx”, 50 (2), 2016, s. 265–273, DOI: 10.1017/S0030605314000842, ISSN 0030-6053 [dostęp 2021-02-20] (ang.).
- 1 2 3 4 5 6 7 8 Samuel T. Turvey i inni, From dirty to delicacy? Changing exploitation in China threatens the world's largest amphibians, „People and Nature”, 3 (2), 2021, s. 446–456, DOI: 10.1002/pan3.10185, ISSN 2575-8314 [dostęp 2021-04-19] (ang.).
- ↑ Bogna Lakomska, Images of Animals in Neolithic Chinese Ceramic, „Athens Journal of Humanities and Arts 2020, 7” [dostęp 2021-02-25] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 Chengzhao Liu, Amphibians of western China, 1950.
- 1 2 3 4 E.G. Bòulenger, 5. On a new Giant Salamander, living in the Society's Gardens., „Proceedings of the Zoological Society of London”, 94 (1), 1924, s. 173–174, DOI: 10.1111/j.1096-3642.1924.tb01494.x, ISSN 1469-7998 [dostęp 2021-02-25] (ang.).
- ↑ Masafumi Matsui i inni, Reduced genetic variation in the Japanese giant salamander, Andrias japonicus (Amphibia: Caudata), „Molecular Phylogenetics and Evolution”, 49 (1), 2008, s. 318–326, DOI: 10.1016/j.ympev.2008.07.020, ISSN 1055-7903 [dostęp 2021-02-25] (ang.).
- 1 2 3 4 5 Robert W. Murphy i inni, Genetic variability among endangered Chinese giant salamanders, Andrias davidianus, „Molecular Ecology”, 9 (10), 2000, s. 1539–1547, DOI: 10.1046/j.1365-294x.2000.01036.x, ISSN 1365-294X [dostęp 2021-02-25] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Zhi-Qiang Liang i inni, Phylogeographic patterns and conservation implications of the endangered Chinese giant salamander, „Ecology and Evolution”, 9 (7), 2019, s. 3879–3890, DOI: 10.1002/ece3.5014, ISSN 2045-7758, PMID: 31015973, PMCID: PMC6467858 [dostęp 2021-02-25] (ang.).
- 1 2 3 4 5 6 7 8 9 Fang Yan i inni, The Chinese giant salamander exemplifies the hidden extinction of cryptic species, „Current Biology”, 28 (10), 2018, R590–R592, DOI: 10.1016/j.cub.2018.04.004, ISSN 0960-9822 [dostęp 2021-02-25] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Samuel T. Turvey i inni, Historical museum collections clarify the evolutionary history of cryptic species radiation in the world's largest amphibians, „Ecology and Evolution”, 9 (18), 2019, s. 10070–10084, DOI: 10.1002/ece3.5257, ISSN 2045-7758, PMID: 31624538, PMCID: PMC6787787 [dostęp 2021-02-25] (ang.).
- 1 2 Jing Chai i inni, Discovery of a wild, genetically pure Chinese giant salamander creates new conservation opportunities, „Zoological Research”, 43 (3), 2022, s. 469–480, DOI: 10.24272/j.issn.2095-8137.2022.101, ISSN 2095-8137, PMID: 35514224, PMCID: PMC9113980 [dostęp 2022-06-03] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Dong He i inni, Nutritional and medicinal characteristics of Chinese giant salamander (Andrias davidianus) for applications in healthcare industry by artificial cultivation: A review, „Food Science and Human Wellness”, 7 (1), 2018, s. 1–10, DOI: 10.1016/j.fshw.2018.03.001, ISSN 2213-4530 [dostęp 2021-02-27] (ang.).
- 1 2 3 Ke-Qin Gao, Neil H. Shubin, Earliest known crown-group salamanders, „Nature”, 422 (6930), 2003, s. 424–428, DOI: 10.1038/nature01491, ISSN 1476-4687 [dostęp 2021-02-27] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 Robert K Browne i inni, The giant salamanders (Cryptobranchidae): Part B. Biogeography, ecology and reproduction [online], 1 maja 2013.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Opis Andrias davidianus w serwisie Amphibiaweb.org
- 1 2 3 4 5 6 7 8 Lauren Hatch, Andrias davidianus [online], Animal Diversity Web [dostęp 2021-03-01] (ang.).
- 1 2 Prague Zoo displays probably the largest Giant Salamander in the world [online], Prague Zoo [dostęp 2021-03-01] (ang.).
- ↑ Chinese Giant Salamander [online], EDGE of Existence [dostęp 2021-03-01] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Kate Jirik, LibGuides: Chinese Giant Salamanders (Andrias spp.) Fact Sheet: Physical Characteristics [online], ielc.libguides.com [dostęp 2021-03-01] (ang.).
- ↑ Zhang Yu-hui i inni, Study of Retina in Andrias davidianus With Im and Sem, „Zoological Research”, 12 (4), 22 listopada 1991, s. 323–328, ISSN 2095-8137 [dostęp 2021-03-01] (ang.).
- ↑ R. Browne, Survey techniques for giant salamanders and other aquatic Caudata [online], 2011.
- 1 2 3 4 5 6 7 8 9 Peng Kemei i inni, Morphologic observaton and anatomical research on viscera of Megalobatrachus davidianus, „Hubei Agricultural Sciences”, en.cnki.com.cn, maj 1998 [dostęp 2021-03-04].
- 1 2 Robert Browne, The giant salamanders (Cryptobranchidae): Part A. palaeontology, phylogeny, genetics, and morphology [online], 2011.
- ↑ H. Zhang i inni, Heterogeneous Vesicles in Mucous Epithelial Cells of Posterior Esophagus of Chinese Giant Salamander (Andrias Davidianus), „European Journal of Histochemistry : EJH”, 59 (3), 2015, DOI: 10.4081/ejh.2015.2521, ISSN 1121-760X, PMID: 26428885, PMCID: PMC4598597 [dostęp 2021-03-04].
- ↑ Li Pipeing i inni, The anatomical and histological studies of the digestive tract on Andrias davidianus, „Journal of Shaanxi Normal University”, en.cnki.com.cn, styczeń 1991 [dostęp 2021-03-04].
- 1 2 Fang Zhan-qiang, Ultrastructure of Liver of Chinese Giant Salamander,Andrias davidianus, „Sichuan Journal of Zoology”, en.cnki.com.cn, luty 2006 [dostęp 2021-03-04].
- 1 2 3 4 Xiaofang Geng i inni, Differential Proteomic Analysis of Chinese Giant Salamander Liver in Response to Fasting, „Frontiers in Physiology”, 11, 2020, DOI: 10.3389/fphys.2020.00208, ISSN 1664-042X [dostęp 2021-03-04] (ang.).
- ↑ Qiao Zhigang i inni, Analysis of the proteases activity in 13 organs of the doll fish (Andrias davidianus) digestive system [online].
- 1 2 3 4 5 Huang Huayuan, Sun Yanxiang, Jiang Guocheng, Observation on the heart and the aortic Trunk of chinese Andrias Davidianus [online], 2003.
- ↑ Li Pipeng i inni, The Hematological Observation Of Chinese Giant Salamander ( Andrias davidianus ), „Journal of Shaanxi Normal University (Natural Science Edition)”, en.cnki.com.cn, marzec 1989 [dostęp 2021-03-04].
- ↑ Max A. Nickerson, Asiatic Giant Salamanders and Hellbenders (Cryptobranchidae), [w:] Michael Hutchins, Grzimek's Animal Life Encyclopedia(Vol. 6: Amphibians. 2nd ed.), go.gale.com, 2004, s. 343 [dostęp 2021-03-04].
- 1 2 Amazing Facts about the Chinese Giant Salamander OneKindPlanet Facts [online], OneKindPlanet [dostęp 2021-03-04] (ang.).
- ↑ Zhenbing Wu i inni, High-throughput sequencing reveals the gut and lung prokaryotic community profiles of the Chinese giant salamander (Andrias davidianus), „Molecular Biology Reports”, 46 (5), 2019, s. 5143–5154, DOI: 10.1007/s11033-019-04972-8, ISSN 1573-4978 [dostęp 2021-03-04] (ang.).
- 1 2 3 4 5 6 7 8 Qiu Youxiang, Yang Anfeng, The Osteological Research of the Chinese Giant Salamander, Megalobatrachus davidianus, „Acta Scicentiarum Naturalum Universitis Pekinesis”, en.cnki.com.cn, czerwiec 1986 [dostęp 2021-03-04].
- 1 2 3 4 5 6 7 8 9 Egon Heiss i inni, Biomechanics and hydrodynamics of prey capture in the Chinese giant salamander reveal a high-performance jaw-powered suction feeding mechanism, „Journal of the Royal Society Interface”, 10 (82), 2013, DOI: 10.1098/rsif.2012.1028, ISSN 1742-5689, PMID: 23466557, PMCID: PMC3627076 [dostęp 2021-03-04].
- ↑ Iwao Sato i inni, Fine Structure and Elemental Analysis of the Enamel in Andrias davidianus (Cryptobranchidae) and Onychodactylus japonicus (Hynobiidae), „Journal of Herpetology”, 25 (2), 1991, s. 141–146, DOI: 10.2307/1564640, ISSN 0022-1511, JSTOR: 1564640 [dostęp 2021-03-04].
- ↑ Praca zbiorowa, Płazy – Amphibia, [w:] Czesław Błaszak (red.), Zoologia Tom 3 Część 1 Szkarłupnie – płazy, Warszawa: Wydawnictwo Naukowe PWN, 2015, s. 473, ISBN 978-83-01-18277-9.
- ↑ Data from proteomic analysis of the skin of Chinese giant salamander (Andrias davidianus), „Data in Brief”, 3, 2015, s. 99–102, DOI: 10.1016/j.dib.2015.02.010, ISSN 2352-3409 [dostęp 2021-03-04] (ang.).
- 1 2 3 4 Xiaofang Geng i inni, Proteomic analysis of the skin of Chinese giant salamander (Andrias davidianus), „Journal of Proteomics”, 119, 2015, s. 196–208, DOI: 10.1016/j.jprot.2015.02.008, ISSN 1874-3919 [dostęp 2021-03-04] (ang.).
- ↑ S.T.H. Chan, T. Sandor, B. Lofts, A histological, histochemical, and biochemical study of the adrenal tissue of the Chinese giant salamander (Andrias davidianus Blanchard), „General and Comparative Endocrinology”, 25 (4), 1975, s. 509–516, DOI: 10.1016/0016-6480(75)90161-6, ISSN 0016-6480 [dostęp 2021-03-04] (ang.).
- 1 2 3 4 Xiaofang Geng i inni, Proteomic analysis of eleven tissues in the Chinese giant salamander ( Andrias davidianus ), „Scientific Reports”, 9 (1), 2019, s. 16415, DOI: 10.1038/s41598-019-50909-3, ISSN 2045-2322 [dostęp 2021-03-04] (ang.).
- 1 2 Praca zbiorowa, Płazy – Amphibia, [w:] Czesław Błaszak (red.), Zoologia Tom 3 Część 1 Szkarłupnie – płazy, Warszawa: Wydawnictwo Naukowe PWN, 2015, s. 513, ISBN 978-83-01-18277-9.
- 1 2 Cheng Hong, Huang Shi‐Qiang, Harold Heatwole, Ampullary organs, pit organs, and neuromasts of the chinese giant salamander, Andrias davidianus, „Journal of Morphology”, 226 (2), 1995, s. 149–157, DOI: 10.1002/jmor.1052260204, ISSN 1097-4687 [dostęp 2021-03-04] (ang.).
- 1 2 Hong C, Guo-Hua Y, Heatwole H. 2000. Ultrastructure of the skin mechanoreceptors of the Chinese giant salamander, Andrias davidianus. J Morphol. 245:80–85.
- 1 2 V.M. Olshanskii, V.D. Baron, Xue Wei, Electrical discharges in Chinese salamander Andrias davidianus, „Doklady Biochemistry and Biophysics”, 471 (1), 2016, s. 447–449, DOI: 10.1134/S1607672916060193, ISSN 1608-3091 [dostęp 2021-03-04] (ang.).
- ↑ gigabase, Oxford Reference, DOI: 10.1093/oi/authority.20110803095851873 [dostęp 2021-03-06] (ang.).
- 1 2 3 Xiaofang Geng i inni, A reference gene set construction using RNA-seq of multiple tissues of Chinese giant salamander, Andrias davidianus, „GigaScience”, 6 (3), 2017, DOI: 10.1093/gigascience/gix006 [dostęp 2021-03-06] (ang.).
- 1 2 Jing-Cheng Xu i inni, Four complete mitochondrial genomes of living wild-type chinese giant salamander Andrias davidianus (Amphibia: Cryptobranchidae), „Mitochondrial DNA Part B”, 3 (2), 2018, s. 1200–1202, DOI: 10.1080/23802359.2018.1524275, PMID: 33474464, PMCID: PMC7800566 [dostęp 2021-03-06].
- 1 2 Peng Zhang i inni, The complete mitochondrial genome of the Chinese giant salamander, Andrias davidianus (Amphibia: Caudata), „Gene”, 311, 2003, s. 93–98, DOI: 10.1016/S0378-1119(03)00560-2, ISSN 0378-1119 [dostęp 2021-03-06] (ang.).
- ↑ Wentao Guo i inni, Skin secretion and shedding is a good source for non-destructive genetic sampling in the Chinese giant salamander (Andrias davidianus), „Zeitschrift Fur Naturforschung. C, Journal of Biosciences”, 68 (3-4), 2013, s. 164–168, ISSN 0939-5075, PMID: 23819313 [dostęp 2021-03-06].
- 1 2 3 Bicai Zhu i inni, The karyotype of the caudate amphibian Andrias davidianus, „Hereditas”, 136 (1), 2002, s. 85–88, DOI: 10.1034/j.1601-5223.2002.1360112.x, ISSN 1601-5223 [dostęp 2021-03-06] (ang.).
- 1 2 3 Stanley K. Sessions, Pedro E. León, James Kezer, Cytogenetics of the chinese giant salamander, Andrias davidianus (Blanchard): the evolutionary significance of cryptobranchoid karyotypes, „Chromosoma”, 86 (3), 1982, s. 341–357, DOI: 10.1007/BF00292262, ISSN 1432-0886 [dostęp 2021-03-06] (ang.).
- ↑ Paul M. Hime i inni, Genomic Data Reveal Conserved Female Heterogamety in Giant Salamanders with Gigantic Nuclear Genomes, „G3: Genes|Genomes|Genetics”, 9 (10), 2019, s. 3467–3476, DOI: 10.1534/g3.119.400556, ISSN 2160-1836, PMID: 31439718, PMCID: PMC6778777 [dostęp 2021-04-07].
- ↑ Wang Li-Xin i inni, Construction of cDNA Library of Andrias davidianus Skin Tissue with Analyzing the cDNA Sequence and Expression of Arpc5l Gene, „Chinese Journal of Biochemistry and Molecular Biology”, en.cnki.com.cn, marzec 2011 [dostęp 2021-03-06].
- ↑ Yang Fang i inni, Construction and identification of directional cDNA library from Chinese giant salamander (Andrias davidianus) liver [online], 1 stycznia 2004.
- ↑ Liping Yang i inni, Growth hormone and prolactin in Andrias davidianus: cDNA cloning, tissue distribution and phylogenetic analysis, „General and Comparative Endocrinology”, 165 (2), 2010, s. 177–180, DOI: 10.1016/j.ygcen.2009.07.010, ISSN 0016-6480 [dostęp 2021-03-06] (ang.).
- 1 2 3 Transcriptome analysis of the Chinese giant salamander (Andrias davidianus) using RNA-sequencing, „Genomics Data”, 14, 2017, s. 126–131, DOI: 10.1016/j.gdata.2017.10.005, ISSN 2213-5960 [dostęp 2021-03-06] (ang.).
- ↑ Xiaofang Geng i inni, RNA-seq analysis provides insight into molecular adaptations of Andrias davidianus, „Development Genes and Evolution”, 229 (5), 2019, s. 197–206, DOI: 10.1007/s00427-019-00641-9, ISSN 1432-041X [dostęp 2021-03-06] (ang.).
- 1 2 3 Cong Wang i inni, Effects of heat stress on the liver of the Chinese giant salamander Andrias davidianus: Histopathological changes and expression characterization of Nrf2-mediated antioxidant pathway genes, „Journal of Thermal Biology”, 76, 2018, s. 115–125, DOI: 10.1016/j.jtherbio.2018.07.016, ISSN 0306-4565 [dostęp 2021-03-06] (ang.).
- ↑ Qiang Ma, Role of Nrf2 in Oxidative Stress and Toxicity, „Annual review of pharmacology and toxicology”, 53, 2013, s. 401–426, DOI: 10.1146/annurev-pharmtox-011112-140320, ISSN 0362-1642, PMID: 23294312, PMCID: PMC4680839 [dostęp 2021-03-06].
- 1 2 3 Yong Huang i inni, Identification and characterization of the Chinese giant salamander (Andrias davidianus) miRNAs by deep sequencing and predication of their targets, „3 Biotech”, 7 (4), 2017, DOI: 10.1007/s13205-017-0817-3, ISSN 2190-572X, PMID: 28695491, PMCID: PMC5503845 [dostęp 2021-03-06].
- 1 2 3 Yong Huang i inni, Identification and characterization of known and novel microRNAs in three tissues of Chinese giant salamander base on deep sequencing approach, „Genomics”, 109 (3-4), 2017, s. 258–264, DOI: 10.1016/j.ygeno.2017.04.007, ISSN 1089-8646, PMID: 28476431 [dostęp 2021-03-06].
- ↑ Yong Huang, Wang Bao Gong, Identification and Characterization of MicroRNAs in Skin of Chinese Giant Salamander (Andrias davidianus) by the Deep Sequencing Approach, „Biochemistry (Moscow)”, 83 (6), 2018, s. 766–777, DOI: 10.1134/S0006297918060147, ISSN 1608-3040 [dostęp 2021-03-06] (ang.).
- 1 2 3 Rui Chen i inni, Comparative microRNAome analysis of the testis and ovary of the Chinese giant salamander, „Reproduction (Cambridge, England)”, 154 (3), 2017, s. 169–179, DOI: 10.1530/REP-17-0109, ISSN 1741-7899, PMID: 28630098 [dostęp 2021-03-06].
- ↑ T. a. O. Feng-yong i inni, Genetic Structure and Geographic Subdivision of Four Populations of the Chinese Giant Salamander (Andrias davidianus), „Zoological Research”, 26 (2), 22 kwietnia 2005, s. 162–167, ISSN 2095-8137 [dostęp 2021-03-11] (ang.).
- ↑ Robin S. Waples i inni, Evaluating the Ryman–Laikre effect for marine stock enhancement and aquaculture, „Current Zoology”, 62 (6), 2016, s. 617–627, DOI: 10.1093/cz/zow060, ISSN 1674-5507, PMID: 29491949, PMCID: PMC5804264 [dostęp 2021-03-11].
- 1 2 3 4 5 Shu Chen i inni, Determining threatened species distributions in the face of limited data: Spatial conservation prioritization for the Chinese giant salamander (Andrias davidianus), „Ecology and Evolution”, 8 (6), 2018, s. 3098–3108, DOI: 10.1002/ece3.3862, ISSN 2045-7758, PMID: 29607009, PMCID: PMC5869214 [dostęp 2021-03-11] (ang.).
- 1 2 3 4 5 6 Zhang Ke-Jia i inni, Advances in conservation biology of Chinese giant salamander, „Biodiversity Science”, 10 (3), 2002, s. 291, DOI: 10.17520/biods.2002040, ISSN 1005-0094 [dostęp 2021-03-11] (ang.).
- 1 2 Y. Meng i inni, Genetic diversity of Chinese giant salamander (Andrias davidianus) based on the novel microsatellite markers, „Russian Journal of Genetics”, 48 (12), 2012, s. 1227–1231, DOI: 10.1134/S102279541212006X, ISSN 1608-3369 [dostęp 2021-03-13] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Xiao-ming Wang i inni, The decline of the Chinese giant salamander Andrias davidianus and implications for its conservation, „Oryx”, 38 (2), 2004, s. 197–202, DOI: 10.1017/S0030605304000341, ISSN 1365-3008 [dostęp 2021-03-11] (ang.).
- 1 2 Andrias davidianus (Blanchard, 1871) | Amphibian Species of the World [online], amphibiansoftheworld.amnh.org [dostęp 2021-03-11].
- 1 2 3 4 5 Kate Jirik, LibGuides: Chinese Giant Salamanders (Andrias spp.) Fact Sheet: Distribution & Habitat [online], ielc.libguides.com [dostęp 2021-03-11] (ang.).
- 1 2 3 4 Samuel T. Turvey i inni, Imminent extinction in the wild of the world’s largest amphibian, „Current Biology”, 28 (10), 2018, R592–R594, DOI: 10.1016/j.cub.2018.04.005, ISSN 0960-9822 [dostęp 2021-03-11] (ang.).
- 1 2 3 4 5 Pierson TW i inni, A survey for the Chinese giant salamander (Andrias davidianus; Blanchard, 1871) in the Qinghai Province [online].
- 1 2 3 4 Home [online], Chinese giant salamander [dostęp 2021-04-15] (ang.).
- ↑ Tian Zhao i inni, Niche divergence of evolutionarily significant units with implications for repopulation programs of the world's largest amphibians, „Science of The Total Environment”, 738, 2020, s. 140269, DOI: 10.1016/j.scitotenv.2020.140269, ISSN 0048-9697 [dostęp 2021-04-19] (ang.).
- 1 2 Sou Fukumoto, Atushi Ushimaru, Toshifumi Minamoto, A basin-scale application of environmental DNA assessment for rare endemic species and closely related exotic species in rivers: a case study of giant salamanders in Japan, „Journal of Applied Ecology”, 52 (2), 2015, s. 358–365, DOI: 10.1111/1365-2664.12392, ISSN 1365-2664 [dostęp 2021-03-11] (ang.).
- ↑ T. Kawamichi, H. Ueda, Spawning at Nests of Extra-Large Males in the Giant Salamander Andrias japonicus, „Journal of Herpetology”, 32 (1), 1998, s. 133, DOI: 10.2307/1565495, JSTOR: 1565495 [dostęp 2021-03-11].
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Qinghua Luo i inni, Observation of the Breeding Behavior of the Chinese Giant Salamander (Andrias davidianus) Using a Digital Monitoring System, „Animals”, 8 (10), 2018, s. 161, DOI: 10.3390/ani8100161 [dostęp 2021-03-13] (ang.).
- ↑ Qing-Hua Luo, [Habitat characteristics of Andrias davidianus in Zhangjiajie of China], „Ying Yong Sheng Tai Xue Bao = The Journal of Applied Ecology”, 20 (7), 2009, s. 1723–1730, ISSN 1001-9332, PMID: 19899477 [dostęp 2021-03-13].
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 Wen-fa Cheng, The Ecological and Behavioral Research of Andrias davidianus and its protection, „Russian Journal of Herpetology”, 5 (1), 1998, s. 2–4, DOI: 10.30906/1026-2296-1998-5-1-2-4, ISSN 1026-2296 [dostęp 2021-03-23] (ang.).
- ↑ Lu Zhang i inni, Environmental Characteristics Associated with Settlement of Reintroduced Chinese Giant Salamanders, „Journal of Herpetology”, 51 (3), 2017, s. 417–424, DOI: 10.1670/16-106, ISSN 0022-1511 [dostęp 2021-03-13].
- ↑ Du Qi i inni, AN EXPERIMENT ON FOOD HABITS CHANGE OF ANDRIAS DAVIAUS, „Chinese Journal of Zoology”, en.cnki.com.cn, marzec 1994 [dostęp 2021-03-20].
- ↑ Sun Han-chang, Nutritional Requirement and Feed of Megalobatrachus davidianus (Blanchard), „Journal of Anhui Agricultural Sciences”, en.cnki.com.cn [dostęp 2021-03-20].
- 1 2 3 4 Josep Fortuny i inni, 3D Bite Modeling and Feeding Mechanics of the Largest Living Amphibian, the Chinese Giant Salamander Andrias davidianus (Amphibia:Urodela), „PLOS One”, 10 (4), 2015, e0121885, DOI: 10.1371/journal.pone.0121885, ISSN 1932-6203, PMID: 25853557, PMCID: PMC4390218 [dostęp 2021-03-20] (ang.).
- ↑ D. Cundall, J. Lorenz-Elwood, J.D. Groves, Asymmetric suction feeding in primitive salamanders, „Experientia”, 43 (11), 1987, s. 1229–1231, DOI: 10.1007/BF01945537, ISSN 1420-9071 [dostęp 2021-05-24] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Kate Jirik, LibGuides: Chinese Giant Salamanders (Andrias spp.) Fact Sheet: Behavior & Ecology [online], ielc.libguides.com [dostęp 2021-03-27] (ang.).
- 1 2 Qinghua Luo, Yingjie Song, Hongbing Ji, Nocturnal Activity Rhythm of Chinese giant Salamander (Andrias davidianus) during the Reproductive Period [online], 13 lipca 2017.
- ↑ Wang Wen-lin i inni, Investigation on the breeding Biology of Giant Salamanders (Andrias davidianus), „Journal of Henan Education Institute”, en.cnki.com.cn, 2002 [dostęp 2021-04-07].
- 1 2 3 4 5 Hexun Zheng, Xiaoming Wang, Telemetric Data Reveals Ecolgoically Adaptive Behavior of Captive Raised Chinese Giant Salamanders When Reintroduced into Their Native Habitat, „Asian Herpetological Research; Sichuan”, search.proquest.com, 2010 [dostęp 2021-03-27] (pol.).
- 1 2 3 Lu Zhang i inni, Spatial distribution and seasonal movement patterns of reintroduced Chinese giant salamanders, „BMC Zoology”, 4 (1), 2019, s. 7, DOI: 10.1186/s40850-019-0046-9, ISSN 2056-3132 [dostęp 2021-03-27].
- ↑ Qijun Wang i inni, Abiotic and Biotic Influences on the Movement of Reintroduced Chinese Giant Salamanders (Andrias davidianus) in Two Montane Rivers, „Animals”, 11 (6), 2021, s. 1480, DOI: 10.3390/ani11061480 [dostęp 2021-05-26] (ang.).
- ↑ J. Wang, Current status of Japanese giant salamander and the enlightenment on the conservation of Chinese giant salamander [online], undefined, 2015 [dostęp 2021-03-27] (ang.).
- ↑ Li Dongfeng, Lan Shucheng, Analysis of the sonograms of Andrias davidianus [online], 1 stycznia 1997.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 Kate Jirik, LibGuides: Chinese Giant Salamanders (Andrias spp.) Fact Sheet: Reproduction & Development [online], ielc.libguides.com [dostęp 2021-03-27] (ang.).
- 1 2 3 4 5 6 7 8 9 10 Dai Qiang, Wang Yuezhao, Liang Gang, Conservation Status of Chinese Giant Salamander (Andrias davidianus) [online].
- ↑ Yang Chu-bin i inni, The Basic Histological Structure and Developmental Variations of Oviduct in Big Salamander, Andrias davidians, „Journal of Natural Science of Hunan Normal University”, en.cnki.com.cn, 2003 [dostęp 2021-04-07].
- 1 2 Frank L. Moore, Reproductive Endocrinology of Amphibians, I. Chester-Jones, P.M. Ingleton, J.G. Phillips (red.), Boston, MA: Springer US, 1987, s. 207–221, DOI: 10.1007/978-1-4899-3617-2_6, ISBN 978-1-4899-3617-2 [dostęp 2021-06-15] (ang.).
- 1 2 Yunke Wu, Fei Ye, Possible polyembryony in one of the world's largest salamanders, Andrias davidianus (Cryptobranchoidea, Cryptobranchidae), „Herpetology Notes”, 11 lipca 2022.
- ↑ Qiao Zhi-gang i inni, Effects of Temperature,Light and Preservative Fluid on the Survival of Spermatozoa in Chinese Giant Salamander (Andrias davidianus), „Fisheries Science”, en.cnki.com.cn, 2004 [dostęp 2021-04-07].
- 1 2 3 4 5 Luo Jian i inni, Embryonic development and organogenesis of Chinese giant salamander, Andrias davidianus, „PROGRESS IN NATURAL SCIENCE”, 8 maja 2007.
- ↑ Qing-Hua Luo i inni, [Effects of water quality on the reproductive behavior and capacity of Andrias davidianus under tourism disturbance.], „Ying Yong Sheng Tai Xue Bao = The Journal of Applied Ecology”, 32 (4), 2021, s. 1471–1478, DOI: 10.13287/j.1001-9332.202104.035, ISSN 1001-9332, PMID: 33899416 [dostęp 2021-05-26].
- 1 2 Chenhao Yang i inni, Bacteria in Abnormal Eggs of Chinese Giant Salamanders (Andrias davidianus) May Derive from Gut, „Zoological Science”, 35 (4), 2018, s. 314–320, DOI: 10.2108/zs180013, ISSN 0289-0003 [dostęp 2021-04-07].
- 1 2 3 4 5 Qiaomu Hu i inni, Identification of critical sex-biased genes in Andrias davidianus by de novo transcriptome, „Molecular Genetics and Genomics”, 294 (2), 2019, s. 287–299, DOI: 10.1007/s00438-018-1508-4, ISSN 1617-4623 [dostęp 2021-04-07] (ang.).
- 1 2 Q Hu, H Tian, H Xiao, Effects of temperature and sex steroids on sex ratio, growth, and growth-related gene expression in the Chinese giant salamander Andrias davidianus, „Aquatic Biology”, 28, 2019, s. 79–90, DOI: 10.3354/ab00710, ISSN 1864-7782 [dostęp 2021-04-07] (ang.).
- ↑ Wu Xuexiang i inni, Live weight gain in the rearing of young Chinese giant salamander Andrias davidianus, „Hebei Fisheries”, en.cnki.com.cn, 2010 [dostęp 2021-04-07].
- ↑ Yang Aisheng i inni, PRELIMINARY STUDIES ON THE EMBRYONIC DEVELOPMENT OF MEGALOBATRACHUS DAVIDIANUS (BLANCHARD), „Acta Zoologica Sinica”, en.cnki.com.cn, 1983 [dostęp 2021-04-07].
- ↑ QIAOMU HU i inni, Characterization and tissue distribution of Lhx9 and Lhx9 α in Chinese giant salamander Andrias davidianus, „Journal of Genetics”, 95 (3), 2016, s. 683–690, DOI: 10.1007/s12041-016-0685-3, ISSN 0973-7731 [dostęp 2021-04-08] (ang.).
- ↑ Yuanxian Wang i inni, UCHL1 expression and localization on testicular development and spermatogenesis of Chinese giant salamanders, „Oncotarget”, 8 (49), 2017, s. 86043–86055, DOI: 10.18632/oncotarget.20910, ISSN 1949-2553, PMID: 29156776, PMCID: PMC5689666 [dostęp 2021-04-08].
- 1 2 Qiaomu Hu i inni, Identification and expression of forkhead box genes in the Chinese giant salamander Andrias davidianus, „Reproduction, Fertility, and Development”, 30 (4), 2018, s. 634–642, DOI: 10.1071/RD17049, ISSN 1031-3613, PMID: 28945985 [dostęp 2021-04-08].
- ↑ Qiaomu Hu i inni, Sexually Dimorphic Expression of Foxl2 and Ftz-F1 in Chinese Giant Salamander Andrias Davidianus, „Journal of Experimental Zoology. Part B, Molecular and Developmental Evolution”, 326 (6), 2016, s. 363–374, DOI: 10.1002/jez.b.22693, ISSN 1552-5015, PMID: 27527384 [dostęp 2021-04-08].
- 1 2 Qiaomu Hu i inni, Identification and expression of cytochrome P450 genes in the Chinese giant salamander Andrias davidianus, „Theriogenology”, 95, 2017, s. 62–68, DOI: 10.1016/j.theriogenology.2017.03.001, ISSN 0093-691X [dostęp 2021-04-08] (ang.).
- ↑ Qiaomu Hu i inni, Characterization and expression of cyp19a gene in the Chinese giant salamander Andrias davidianus, „Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology”, 192, 2016, s. 21–29, DOI: 10.1016/j.cbpb.2015.11.005, ISSN 1096-4959 [dostęp 2021-04-08] (ang.).
- ↑ Qiaomu Hu i inni, Cloning, expression of, and evidence of positive selection for, the prolactin receptor gene in Chinese giant salamander (Andrias davidianus), „Journal of Experimental Zoology Part B: Molecular and Developmental Evolution”, 324 (8), 2015, s. 707–719, DOI: 10.1002/jez.b.22659, ISSN 1552-5015 [dostęp 2021-04-08] (ang.).
- 1 2 Quanhe Wang i inni, Characterization and evolution analysis of Wt1 and StAR genes in Andrias davidianus, „Gene Reports”, 13, 2018, s. 158–165, DOI: 10.1016/j.genrep.2018.10.005, ISSN 2452-0144 [dostęp 2021-04-08] (ang.).
- ↑ Yao Gao i inni, Molecular characterisation of oestrogen receptor ERα and the effects of bisphenol A on its expression during sexual development in the Chinese giant salamander (Andrias davidianus), „Reproduction, Fertility, and Development”, 31 (2), 2019, s. 261–271, DOI: 10.1071/RD18107, ISSN 1031-3613, PMID: 30092913 [dostęp 2021-04-08].
- 1 2 Shengyan Su i inni, Comparative expression analysis identifies the respiratory transition-related miRNAs and their target genes in tissues of metamorphosing Chinese giant salamander (Andrias davidianus), „BMC Genomics”, 19 (1), 2018, s. 406, DOI: 10.1186/s12864-018-4662-5, ISSN 1471-2164 [dostęp 2021-04-08].
- 1 2 3 4 Mengjie Zhang i inni, Age-related changes in the gut microbiota of the Chinese giant salamander (Andrias davidianus), „MicrobiologyOpen”, 8 (7), 2019, e00778, DOI: 10.1002/mbo3.778, ISSN 2045-8827, PMID: 30585426, PMCID: PMC6612560 [dostęp 2021-04-08] (ang.).
- ↑ Li Pei-qing i inni, Sex identification of Chinese giant salamander (Andrias davidianus) by Doppler B-ultrasound method, „Journal of Biology”, en.cnki.com.cn, 2010 [dostęp 2021-04-08].
- ↑ Qiaomu Hu i inni, Genome-wide RAD sequencing to identify a sex-specific marker in Chinese giant salamander Andrias davidianus, „BMC Genomics”, 20 (1), 2019, s. 415, DOI: 10.1186/s12864-019-5771-5, ISSN 1471-2164, PMID: 31122206, PMCID: PMC6533744 [dostęp 2021-04-08].
- ↑ X. Han i inni, ARTIFICIAL PROPAGATION OF TANK-CULTURED CHINESE GIANT SALAMANDER (ANDRIAS DAVIDIANUS) [online], undefined, 2006 [dostęp 2021-04-08] (ang.).
- ↑ Zhang Hong-xing i inni, Study on Spawning Induction and Incubation Technology of the Giant Salamander(Andrias davidianus), „Hubei Agricultural Sciences”, en.cnki.com.cn, 2012 [dostęp 2021-04-08].
- ↑ Li Hai-zhu i inni, Compared study on artificial insemination methods of Andrias davidianus, „Guangdong Agricultural Sciences”, en.cnki.com.cn, 2013 [dostęp 2021-04-08].
- 1 2 Lu Zhang i inni, THE EFFECT OF WATER TEMPERATURE ON THE GROWTH OF CAPTIVE CHINESE GIANT SALAMANDERS (ANDRIAS DAVIDIANUS) REARED FOR REINTRODUCTION: A COMPARISON WITH WILD SALAMANDER BODY CONDITION, „Herpetologica”, 70 (4), 2014, s. 369–377, ISSN 0018-0831, JSTOR: 24635234 [dostęp 2021-04-08].
- 1 2 3 4 5 J. Ma i inni, Ultrastructural Morphogenesis of an Amphibian Iridovirus Isolated from Chinese Giant Salamander (Andrias davidianus), „Journal of Comparative Pathology”, 150 (2-3), 2014, s. 325–331, DOI: 10.1016/j.jcpa.2013.09.007, ISSN 0021-9975 [dostęp 2021-04-09] (ang.).
- 1 2 3 4 Zhongyuan Chen i inni, Genome architecture changes and major gene variations of Andrias davidianus ranavirus (ADRV), „Veterinary Research”, 44 (1), 2013, s. 101, DOI: 10.1186/1297-9716-44-101, ISSN 0928-4249, PMID: 24143877, PMCID: PMC4015033 [dostęp 2021-04-09].
- 1 2 3 Huihui Gao i inni, Iridoviral infection can be reduced by UCHL1-loaded exosomes from the testis of Chinese giant salamanders (Andrias davidianus), „Veterinary Microbiology”, 224, 2018, s. 50–57, DOI: 10.1016/j.vetmic.2018.08.025, ISSN 0378-1135 [dostęp 2021-04-09] (ang.).
- 1 2 Yan Meng i inni, Pathological and microbiological findings from mortality of the Chinese giant salamander (Andrias davidianus), „Archives of Virology”, 159 (6), 2014, s. 1403–1412, DOI: 10.1007/s00705-013-1962-6, ISSN 1432-8798 [dostęp 2021-04-09] (ang.).
- 1 2 3 Jian Du i inni, Autophagy and apoptosis induced by Chinese giant salamander (Andrias davidianus) iridovirus (CGSIV), „Veterinary Microbiology”, 195, 2016, s. 87–95, DOI: 10.1016/j.vetmic.2016.09.011, ISSN 0378-1135 [dostęp 2021-04-09] (ang.).
- ↑ Na Wang i inni, Complete Genome Sequence of a Ranavirus Isolated from Chinese Giant Salamander (Andrias davidianus), „Genome Announcements”, 2 (1), 2014, DOI: 10.1128/genomeA.01032-13, ISSN 2169-8287, PMID: 24407629, PMCID: PMC3886942 [dostęp 2021-04-09].
- ↑ Fei Ke i inni, Ranaviruses Bind Cells from Different Species through Interaction with Heparan Sulfate, „Viruses”, 11 (7), 2019, DOI: 10.3390/v11070593, ISSN 1999-4915, PMID: 31261956, PMCID: PMC6669447 [dostęp 2021-04-09].
- ↑ Yiqun Li i inni, Chinese Giant Salamander (Andrias davidianus) Iridovirus Infection Leads to Apoptotic Cell Death through Mitochondrial Damage, Caspases Activation, and Expression of Apoptotic-Related Genes, „International Journal of Molecular Sciences”, 20 (24), 2019, DOI: 10.3390/ijms20246149, ISSN 1422-0067, PMID: 31817556, PMCID: PMC6940751 [dostęp 2021-04-09].
- ↑ Z.Y. Zhou i inni, Characterization of a ranavirus isolated from the Chinese giant salamander (Andrias davidianus, Blanchard, 1871) in China, „Aquaculture”, 384-387, 2013, s. 66–73, DOI: 10.1016/j.aquaculture.2012.12.018, ISSN 0044-8486 [dostęp 2021-04-09] (ang.).
- ↑ Yuting Deng i inni, Multi-Drug Resistance Mediated by Class 1 Integrons in Aeromonas Isolated from Farmed Freshwater Animals, „Frontiers in Microbiology”, 7, 2016, DOI: 10.3389/fmicb.2016.00935, ISSN 1664-302X, PMID: 27379065, PMCID: PMC4908131 [dostęp 2021-04-09].
- ↑ W. Xu i inni, Isolation and identification on pathogenic bacteria of [online], undefined, 2010 [dostęp 2021-04-09] (ang.).
- ↑ Zhengyong Gao i inni, [Isolation and identification of Citrobacter freundii from diseased giant salamander, Andrias davidianus], „Wei Sheng Wu Xue Bao = Acta Microbiologica Sinica”, 52 (2), 2012, s. 169–176, ISSN 0001-6209, PMID: 22586994 [dostęp 2021-04-09].
- ↑ Zhitao Qi i inni, Functional characterization of a short peptidoglycan recognition protein from Chinese giant salamander (Andrias davidianus), „Oncotarget”, 8 (59), 2017, s. 99323–99335, DOI: 10.18632/oncotarget.21470, ISSN 1949-2553, PMID: 29245904, PMCID: PMC5725095 [dostęp 2021-04-09].
- ↑ Du Zong-jun i inni, Isolation and Identification of Pseudomonas fluorescents from Andrias davidianus, „Journal of Sichuan Agricultural University”, en.cnki.com.cn, 2011 [dostęp 2021-04-09].
- ↑ Li Wang, Yong Wei, Yanqing Huang, Morganella morganii as a Causative Agent of Disease in the Chinese Giant Salamander (Andrias davidianus), „Asian Herpetological Research”, 30 sierpnia 2013.
- ↑ Ming Li i inni, First report of two Balantidium species from the Chinese giant salamander, Andrias davidianus: Balantidium sinensis Nie 1935 and Balantidium andianusis n. sp., „Parasitology Research”, 102 (4), 2008, s. 605–611, DOI: 10.1007/s00436-007-0795-1, ISSN 1432-1955 [dostęp 2021-04-09] (ang.).
- 1 2 3 4 5 6 Lu Zhang i inni, Reintroduction and Post-Release Survival of a Living Fossil: The Chinese Giant Salamander, „PLOS One”, 11 (6), 2016, e0156715, DOI: 10.1371/journal.pone.0156715, ISSN 1932-6203, PMID: 27258650, PMCID: PMC4892505 [dostęp 2021-04-09] (ang.).
- ↑ Zhang Tong-fu, Yang Ming-lang, A NEW GENUS AND SPECIES OF TREMATODES FROM ANDRIAS DAVIDIANUS IN SICHUAN PROVINCE (TREMATODA: DIGENEA), „ACTA ZOOTAXONOMICA SINICA”, en.cnki.com.cn, 1997 [dostęp 2021-04-09].
- 1 2 Wei Zhu i inni, Retrospective Survey of Museum Specimens Reveals Historically Widespread Presence of Batrachochytrium dendrobatidis in China, „EcoHealth”, 11 (2), 2014, s. 241–250, DOI: 10.1007/s10393-013-0894-7, ISSN 1612-9210 [dostęp 2021-04-09] (ang.).
- 1 2 3 Benjamin Tapley i inni, Range-wide decline of Chinese giant salamanders Andrias spp. from suitable habitat, „Oryx”, 2021, s. 1–9, DOI: 10.1017/S0030605320000411, ISSN 0030-6053 [dostęp 2021-04-15] (ang.).
- ↑ Zhitao Qi i inni, Transcriptome analysis of the endangered Chinese giant salamander (Andrias davidianus): Immune modulation in response to Aeromonas hydrophila infection, „Veterinary Immunology and Immunopathology”, 169, 2016, s. 85–95, DOI: 10.1016/j.vetimm.2015.11.004, ISSN 0165-2427, PMID: 26620078 [dostęp 2021-04-10] (ang.).
- 1 2 Yuding Fan i inni, Transcriptomic analysis of the host response to an iridovirus infection in Chinese giant salamander, Andrias davidianus, „Veterinary Research”, 46 (1), 2015, s. 136, DOI: 10.1186/s13567-015-0279-8, ISSN 1297-9716, PMID: 26589400, PMCID: PMC4654921 [dostęp 2021-04-10].
- ↑ Rong Zhu i inni, Thymus cDNA library survey uncovers novel features of immune molecules in Chinese giant salamander Andrias davidianus, „Developmental & Comparative Immunology”, 46 (2), 2014, s. 413–422, DOI: 10.1016/j.dci.2014.05.019, ISSN 0145-305X [dostęp 2021-04-10] (ang.).
- 1 2 Zisheng Wang i inni, Molecular characterization and expression analysis of cathepsin C in Chinese giant salamander (Andrias davidianus) after Aeromonas hydrophila infection, „Electronic Journal of Biotechnology”, 32, 2018, s. 47–54, DOI: 10.1016/j.ejbt.2018.01.002, ISSN 0717-3458 [dostęp 2021-04-10] (ang.).
- 1 2 Hui Yang i inni, Characterization of galectin-1 from Chinese giant salamanders Andrias davidianus and its involvements during immune response, „Developmental & Comparative Immunology”, 70, 2017, s. 59–68, DOI: 10.1016/j.dci.2017.01.004, ISSN 0145-305X [dostęp 2021-04-10] (ang.).
- ↑ Yanan Liu i inni, Characterization, Expression Pattern and Antiviral Activities of Mx Gene in Chinese Giant Salamander, Andrias davidianus, „International Journal of Molecular Sciences”, 21 (6), 2020, DOI: 10.3390/ijms21062246, ISSN 1422-0067, PMID: 32213935, PMCID: PMC7139979 [dostęp 2021-04-10].
- ↑ Lili Huang i inni, Cloning, sequence analysis and expression profiles of Toll-like receptor 7 from Chinese giant salamander Andrias davidianus, „Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology”, 184, 2015, s. 52–57, DOI: 10.1016/j.cbpb.2015.02.006, ISSN 1096-4959 [dostęp 2021-04-10] (ang.).
- ↑ Wenzhi Liu i inni, Immunological responses and protection in Chinese giant salamander Andrias davidianus immunized with inactivated iridovirus, „Veterinary Microbiology”, 174 (3-4), 2014, s. 382–390, DOI: 10.1016/j.vetmic.2014.10.028, ISSN 0378-1135 [dostęp 2021-04-10] (ang.).
- ↑ Yan Meng i inni, MicroRNA repertoire and comparative analysis of Andrias davidianus infected with ranavirus using deep sequencing, „Developmental & Comparative Immunology”, 85, 2018, s. 108–114, DOI: 10.1016/j.dci.2018.04.002, ISSN 0145-305X [dostęp 2021-04-10] (ang.).
- ↑ Rong Zhu i inni, Extensive diversification of MHC in Chinese giant salamanders Andrias davidianus (Anda-MHC) reveals novel splice variants, „Developmental & Comparative Immunology”, 42 (2), 2014, s. 311–322, DOI: 10.1016/j.dci.2013.10.001, ISSN 0145-305X [dostęp 2021-04-10] (ang.).
- ↑ Yong Zhou i inni, Protective immunity of a Pichia pastoris expressed recombinant iridovirus major capsid protein in the Chinese giant salamander, Andrias davidianus, „Vaccine”, 33 (42), 2015, s. 5662–5669, DOI: 10.1016/j.vaccine.2015.08.054, ISSN 0264-410X [dostęp 2021-04-10] (ang.).
- 1 2 Zhong-Yuan Chen i inni, Protective Immunity Induced by DNA Vaccination against Ranavirus Infection in Chinese Giant Salamander Andrias davidianus, „Viruses”, 10 (2), 2018, s. 52, DOI: 10.3390/v10020052 [dostęp 2021-04-10] (ang.).
- ↑ Hui Yang i inni, Identification of the first cathelicidin gene from skin of Chinese giant salamanders Andrias davidianus with its potent antimicrobial activity, „Developmental & Comparative Immunology”, 77, 2017, s. 141–149, DOI: 10.1016/j.dci.2017.08.002, ISSN 0145-305X [dostęp 2021-04-10] (ang.).
- ↑ Lan-Zhi Wang i inni, The first evidence of four transcripts from two Interleukin 18 genes in animal and their involvement in immune responses in the largest amphibian Andrias davidianus, „Developmental & Comparative Immunology”, 106, 2020, s. 103598, DOI: 10.1016/j.dci.2019.103598, ISSN 0145-305X [dostęp 2021-04-10] (ang.).
- ↑ Xiuling You i inni, Three ferritin subunit analogs in Chinese giant salamander (Andrias davidianus) and their response to microbial stimulation, „Molecular Immunology”, 67 (2), 2015, s. 642–651, DOI: 10.1016/j.molimm.2015.07.020, ISSN 0161-5890 [dostęp 2021-04-10] (ang.).
- ↑ Qihuan Zhang i inni, Molecular Cloning, Characterization, and Expression Analysis of Cathepsin A in the Chinese Giant Salamander Andrias davidianus, „Journal of Aquatic Animal Health”, 29 (4), 2017, s. 199–207, DOI: 10.1080/08997659.2017.1349007, ISSN 0899-7659, PMID: 28992444 [dostęp 2021-04-10].
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 Kate Jirik, LibGuides: Chinese Giant Salamanders (Andrias spp.) Fact Sheet: Population & Conservation Status [online], ielc.libguides.com [dostęp 2021-04-13] (ang.).
- ↑ Nick J.B. Isaac i inni, Phylogenetically-Informed Priorities for Amphibian Conservation, „PLOS One”, 7 (8), 2012, e43912, DOI: 10.1371/journal.pone.0043912, ISSN 1932-6203, PMID: 22952807, PMCID: PMC3431382 [dostęp 2021-02-27] (ang.).
- ↑ Species [online], EDGE of Existence [dostęp 2021-04-14] (ang.).
- ↑ Liang Gang, Geng Baorong, Zhao Ermi, IUCN Red List of Threatened Species: Andrias davidianus [online], IUCN Red List of Threatened Species, 30 kwietnia 2004 [dostęp 2021-04-14].
- ↑ EUR-Lex – L:2019:320:TOC – EN – EUR-Lex [online], eur-lex.europa.eu [dostęp 2021-04-14].
- ↑ Rozporządzenia Unii Europejskiej dotyczące handlu dziką fauną i florą – Wprowadzenie do Konwencji CITES i jej implementacja w krajach Unii Europejskiej [online].
- 1 2 3 4 5 6 7 Yuan Pan i inni, Using local ecological knowledge to assess the status of the Critically Endangered Chinese giant salamander Andrias davidianus in Guizhou Province, China, „Oryx”, 50 (2), 2016, s. 257–264, DOI: 10.1017/S0030605314000830, ISSN 0030-6053 [dostęp 2021-04-15] (ang.).
- 1 2 Chenqi Lu i inni, Giant salamanders: Farmed yet endangered, „Science”, 367 (6481), 2020, s. 989–989, DOI: 10.1126/science.abb2375, ISSN 0036-8075, PMID: 32108104 [dostęp 2021-04-15] (ang.).
- 1 2 Peng Zhang i inni, Species range shifts in response to climate change and human pressure for the world's largest amphibian, „Science of The Total Environment”, 735, 2020, s. 139543, DOI: 10.1016/j.scitotenv.2020.139543, ISSN 0048-9697 [dostęp 2021-04-15] (ang.).
- 1 2 Zhixin Zhang i inni, Future climate change will severely reduce habitat suitability of the Critically Endangered Chinese giant salamander, „Freshwater Biology”, 65 (5), 2020, s. 971–980, DOI: 10.1111/fwb.13483, ISSN 1365-2427 [dostęp 2021-04-15] (ang.).
- ↑ Qinghua Luo i inni, Effects of tourism disturbance on habitat quality and population size of the Chinese giant salamander (Andrias davidianus), „Wildlife Research”, 45 (5), 2018, s. 411–420, DOI: 10.1071/WR17092, ISSN 1448-5494 [dostęp 2021-04-15] (ang.).
- ↑ Chinese Giant Salamander [online], EDGE of Existence [dostęp 2021-04-17] (ang.).
- ↑ Jie Wang i inni, Genetic Bottlenecks of the Wild Chinese Giant Salamander in Karst Caves, „Asian Herpetological Research”, ahr-journal.com, 25 września 2017 [dostęp 2021-04-17].
- ↑ Guangzhou Grub: Eating the Critically Endangered Chinese Giant Salamander [online], The Bon Vivant in Yellow, 10 marca 2015 [dostęp 2021-04-17] (ang.).
- 1 2 Marty Crump, Eye of Newt and Toe of Frog, Adder’s Fork and Lizard’s Leg, Chicago: The University of Chicago Press, 2015, s. 204.
- ↑ A giant salamander. Colour lithograph after A. Weczerzick. [online], Wellcome Collection [dostęp 2021-04-17] (ang.).
- 1 2 3 Zoo welcomes world’s largest amphibian [online], Zoological Society of London (ZSL) [dostęp 2021-04-17] (ang.).
- ↑ World’s largest amphibian identified as a unique species [online], Animals, 16 września 2019 [dostęp 2021-04-17] (ang.).
- ↑ Chelsea Whyte, New species of giant salamander is the world's largest amphibian [online], New Scientist [dostęp 2021-04-17] (ang.).
- ↑ Newly discovered species of giant salamander is 'world’s largest' known amphibian [online], The Independent, 17 września 2019 [dostęp 2021-04-17] (ang.).
- ↑ New Chinese giant salamander species is largest amphibian in the world [online], Sky News [dostęp 2021-04-17] (ang.).
- ↑ World's biggest amphibian 'discovered' in museum, „BBC News”, 17 września 2019 [dostęp 2021-04-17] (ang.).
- 1 2 Kate Jirik, LibGuides: Chinese Giant Salamanders (Andrias spp.) Fact Sheet: Managed Care [online], ielc.libguides.com [dostęp 2021-04-17] (ang.).
- ↑ Chinese Giant Salamander | San Diego Zoo Animals & Plants [online], animals.sandiegozoo.org [dostęp 2021-04-17].
- ↑ Chinese Giant Salamander [online], Ocean Park Hong Kong, 21 lipca 2016 [dostęp 2021-04-17] (ang.).
- ↑ Start – Zoo-Duisburg [online], zoo-duisburg.de [dostęp 2021-04-17].
- ↑ Andrias davidianus / Chinese giant salamander in zoos [online], zooinstitutes.com [dostęp 2021-04-17] (ang.).
- ↑ Andrias davidianus / Chinese giant salamander in Moscow zoo [online], zooinstitutes.com [dostęp 2021-04-17] (ang.).
- 1 2 Jiang-Di Yuan i inni, Establishment of three cell lines from Chinese giant salamander and their sensitivities to the wild-type and recombinant ranavirus, „Veterinary Research”, 46 (1), 2015, s. 58, DOI: 10.1186/s13567-015-0197-9, ISSN 1297-9716, PMID: 26070783, PMCID: PMC4465014 [dostęp 2021-04-17].
- ↑ Jie Ma i inni, Efficient resistance to grass carp reovirus infection in JAM-A knockout cells using CRISPR/Cas9, „Fish & Shellfish Immunology”, 76, 2018, s. 206–215, DOI: 10.1016/j.fsi.2018.02.039, ISSN 1050-4648 [dostęp 2021-04-17] (ang.).
- ↑ Qunhao Wang i inni, Honeycomb-structured carbon aerogels from nanocellulose and skin secretion of Andrias davidianus for highly compressible binder-free supercapacitors, „Carbohydrate Polymers”, 245, 2020, s. 116554, DOI: 10.1016/j.carbpol.2020.116554, ISSN 0144-8617 [dostęp 2021-04-17] (ang.).
- ↑ Jun Deng i inni, A Bioinspired Medical Adhesive Derived from Skin Secretion of Andrias davidianus for Wound Healing, „Advanced Functional Materials”, 29 (31), 2019, s. 1809110, DOI: 10.1002/adfm.201809110, ISSN 1616-3028 [dostęp 2021-04-17] (ang.).