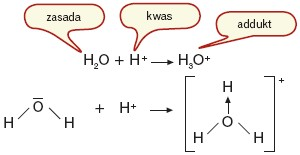
Założenia teorii Lewisa:
Kwas to atom, cząsteczka lub jon przyjmujący parę elektronową (akceptor). Kwas ma właściwości elektronoakceptorowe np. posiada niecałkowicie zapełnioną powłokę zewnętrzną: BF3, H+, Cu2+.
Zasada to atom, cząsteczka lub jon dostarczający parę elektronową (donor). Zasada ma właściwości elektronodonorowe (ma wolną parę elektronową): H2O, NH3, Cl–, CN–.
Między kwasem a zasadą przebiega reakcja zobojętniania, w wyniku której tworzy się tzw. addukt (kwasowo-zasadowy kompleks Lewisa) z wiązaniem koordynacyjnym (transfer pary elektronowej od zasady do kwasu).