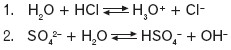Założenia teorii Brønsteda–Lowry’ego:
Kwas: protonodawca, czyli substancja (cząsteczka, jon) zdolna do oddawania protonu, np. HCl, H2O, CH3COOH, H3O+, NH4+, HSO4–, HCO3–.
Zasada: protonobiorca, czyli substancja (cząsteczka, jon) zdolna do pobierania protonu, np. NH3, CH3NH2, H2O, CH3COO–, CO32–.
Reakcja pomiędzy kwasem a zasadą, w czasie której odbywa się transfer protonu, jest przykładem reakcji protolitycznej.
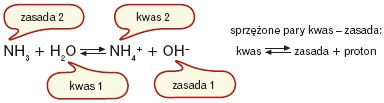
Każdej zasadzie (NH3) odpowiada sprzężony z nią kwas (NH4+). Każdy kwas oddając proton przechodzi w sprzężoną z nim zasadę. Należy pamiętać, że im mocniejszy kwas, tym słabsza sprzężona z nim zasada.
Ta sama substancja może być kwasem i zasadą. Substancja taka nosi nazwę amfolitu lub substancji amfiprotycznej. W poniższym równaniu nr 1 cząsteczka wody pełni rolę zasady, a w równaniu nr 2 – rolę kwasu.