Elektroda drugiego rodzaju – elektroda odwracalna (równowagowa) z dwoma granicami faz (na których zachodzą szybkie reakcje odwracalne)[1][2]:
- pierwszą – między metalem i pokrywającą metal warstwą jego trudno rozpuszczalnej soli,
- drugą – między warstwą soli trudno rozpuszczalnej i roztworem soli dobrze rozpuszczalnej, zawierającej ten sam anion.
Obecność tego samego anionu w dobrze rozpuszczalnej soli innego metalu dodatkowo zmniejsza rozpuszczalność soli tworzącej warstwę (zachowanie stałej wartości iloczynu rozpuszczalności). Potencjał elektrody zależy od stężenia tych anionów. Ma stałą wartość dzięki zbuforowaniu jonów potencjałotwórczych. Stałość i odtwarzalność potencjału elektrod drugiego rodzaju umożliwia ich powszechne stosowanie jako elektrod odniesienia w potencjometrii[3][4].
Przykłady elektrod II rodzaju
Wśród elektrod drugiego rodzaju wymienia się np.[2]:
- elektrodę chlorosrebrową – Ag, AgCl | Cl-,
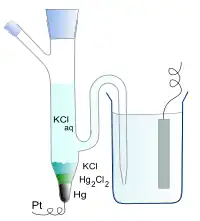
- elektrodę kalomelową – Hg, Hg2Cl2 | Cl-,
- elektrodę tlenkowo-rtęciową – Hg, HgO | O2−,
- elektrodę siarczano-rtęciową – Hg, Hg2SO4 | SO2−4.
Termodynamika reakcji elektrodowych i potencjał elektrody
| Typ elektrody | E [V] |
| Pb/PbSO4/SO2−4 | –0,3505 |
| Ag/AgI/I- | –0,1519 |
| Ag/AgBr/Br- | 0,0711 |
| Ag/AgCNS/CNS- | 0,0947 |
| Hg/HgO/OH- | 0,0976 |
| Hg/Hg2Br2/Br- | 0,1392 |
| Ag/AgCl/Cl- | 0,2224 |
| Hg/Hg2Cl2/Cl- | 0,2681 |
| 0,1n | 0,336 |
| 1n | 0,281 |
| nasycona | 0,242 |
| Hg/Hg2SO4/SO4- | 0,6141 |

Reakcje potencjałotwórcze ilustruje poglądowy przykład półogniwa[3][4]:
- M | MXz | X-, N+,
gdzie:
- M – metal ulegający utlenieniu do kationu Mz+,
- X- – anion tworzący sól trudno rozpuszczalną z metalem M i dobrze rozpuszczalną – z metalem N.
Reakcją potencjałotwórczą, zachodzącą na pierwszej granicy międzyfazowej (M | MXz), jest odwracalna reakcja utleniania i redukcji metalu M:
Na drugiej granicy międzyfazowej (MXz | X-) kationy Mz+ biorą udział w odwracalnej reakcji powstawania i dysocjacji trudno rozpuszczalnej soli MXz:
Sumą obu równań jest równanie złożonej reakcji potencjałotwórczej:
dla której równanie Nernsta przybiera postać charakterystyczną dla elektrod odwracalnych względem anionu (np. elektrody chlorowej):
Aktywność anionów soli trudno rozpuszczalnej jest bezpośrednio związana z aktywnością jonów metalu, co wyraża wartość iloczynu rozpuszczalności. W przypadku soli MXz stężenie Mz+ jest związane ze stężeniem anionu X-:
a w bardziej ogólnym przypadku:
co pozwala wyrazić prawo działania mas jako:
Zobacz też
Przypisy
- ↑ Leksykon naukowo-techniczny z suplementem. T. A-O. Warszawa: WNT, 1989, s. 189. ISBN 83-204-0969-1.
- 1 2 Praca zbiorowa: Encyklopedia techniki – Chemia. Wyd. 4. Warszawa: Wydawnictwa Naukowo-Techniczne, 1993, s. 206. ISBN 83-204-1312-5.
- 1 2 3 Stanisław Bursa: Chemia fizyczna. Wyd. 2 popr. Warszawa: Państwowe Wydawnictwo Naukowe, 1979, s. 756–763. ISBN 83-01-00152-6. (pol.).
- 1 2 3 Józef Szarawara: Termodynamika chemiczna. Warszawa: WNT, 1969, s. 21–23.
- ↑ Aleksander Brodski: Chemia fizyczna. T. 2. Warszawa: PWN, 1954, s. 717.