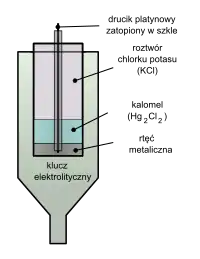
Elektroda kalomelowa – półogniwo, elektroda drugiego rodzaju, którą stanowi rtęć stykająca się z chlorkiem rtęci(I) (kalomelem). W celu zabezpieczenia elektrody przed obecnością Hg2+, do sporządzenia jej nie używa się czystego kalomelu, lecz pasty kalomelowej zawierającej niewielkie ilości rozdrobnionej rtęci w roztworze chlorku potasu (KCl)[1].
Schematycznie tę elektrodę można przedstawić następująco[2]:
- Hg | Hg2Cl2(s) | KCl(nas.) E = 0,244 V (25 °C)
Reakcja elektrodowa[2]:
- Hg2Cl2 + 2e− ⇌ 2Hg + 2Cl−
wskazuje, że potencjał takiego półogniwa zależy od stężenia jonów chlorkowych. Stosując nasycony roztwór jonów Cl− (np. KCl), uzyskuje się półogniwo o stałym potencjale, który w określonej temperaturze wynosi[2]:
- 0,257 V (0 °C),
- 0,244 V (25 °C)[3],
- 0,223 V (50 °C).
Elektroda kalomelowa jest często stosowana w praktyce laboratoryjnej jako półogniwo odniesienia do pomiaru potencjału innych półogniw, zamiast niewygodnej w użyciu elektrody wodorowej.
Przypisy
- ↑ Andrzej Cygański, Podstawy metod elektroanalitycznych, WNT, 1999 (wyd. III), str. 121.
- 1 2 3 Ćwiczenia laboratoryjne z biomateriałów. J. Marciniak (red.). Gliwice: Wydawnictwo Politechniki Śląskiej, 1999, s. 33-34.
- ↑ PN-EN ISO 17475:2010. Korozja metali i stopów. Elektrochemiczne metody badań. Wytyczne wykonania potencjostatycznych i potencjodynamicznych pomiarów polaryzacyjnych.. s. 16.