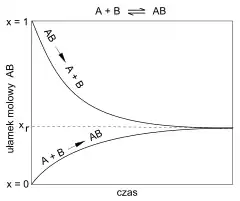
Reakcja odwracalna – reakcja złożona, która w szerokim zakresie parametrów zewnętrznych (np. ciśnienie, temperatura, stężenia reagentów) może równocześnie zachodzić w dwóch przeciwnych kierunkach, zgodnie z tym samym równaniem[1][2], przy czym szybkości obu reakcji prostych (cząstkowych, elementarnych, izolowanych) są różne i zmieniają się w czasie wraz ze zmianami stężenia reagentów. W przypadku, gdy energia nie jest dostarczana z zewnątrz (reakcja zachodzi samorzutnie), większą szybkość ma ta z obu reakcji elementarnych, która przybliża układ termodynamiczny, jakim jest środowisko reakcji, do stanu równowagi (np. stanu o najmniejszej entalpii swobodnej, gdy p,T = const)[3][4].
Tak zdefiniowana reakcja odwracalna zwykle nie jest procesem odwracalnym z punktu widzenia termodynamiki chemicznej (nie jest możliwy powrót do początkowego stanu układu i jego otoczenia)[4].
Historia
Pojęcie reakcji odwracalnej zostało wprowadzone przez Bertholleta w roku 1803. Zaobserwował on osady węglanu sodu na obrzeżach słonych jezior położonych w skałach wapiennych w Egipcie[5] powstałe w wyniku reakcji:
- 2NaCl + CaCO3 → Na2CO3 + CaCl2
Berthollet rozpoznał, że jest to reakcja odwrotna do dobrze znanej reakcji:
- Na2CO3 + CaCl2→ 2NaCl + CaCO3
Przed Bertholettem przyjmowano, że reakcje zachodzą w jednym kierunku. Berthollet zrozumial, że obecność dużej ilości soli "popycha" reakcję skierowaną w drugą stronę.[6]
W roku 1864, Waage i Guldberg sformułowali prawo działania mas, które ilościowo opisało obserwację Bertholetta. W latach 1884 i 1888, Le Chatelier oraz Braun sformułowali regułę przekory, która rozszerzyła tę samą ideę na wpływ czynników innych niż stężenie na pozycję równowagi.
Zobacz też
Przypisy
- ↑ Praca zbiorowa: Encyklopedia techniki – Chemia. Wyd. 4. Warszawa: Wydawnictwo Naukowo–Techniczne, 1993, s. 620. ISBN 83-204-1312-5.
- ↑ "Leksykon naukowo-techniczny z suplementem". T. P-Ż. Warszawa: WNT, 1989, s. 805-806. ISBN 83-204-0969-1.
- ↑ Stanisław Bursa: Chemia fizyczna. Wyd. 2 popr. Warszawa: Państwowe Wydawnictwo Naukowe, 1979, s. 612-617. ISBN 83-01-00152-6.
- 1 2 Józef Szarawara: "Termodynamika chemiczna". Warszawa: WNT, 1969, s. 21-25.
- ↑ How did Napoleon Bonaparte help discover reversible reactions?. Chem1 General Chemistry Virtual Textbook: Chemical Equilibrium Introduction: reactions that go both ways.
- ↑ Claude-Louis Berthollet,"Essai de statique chimique", Paris, 1803. (Google books)