Elektroda pierwszego rodzaju – elektroda odwracalna (równowagowa) z jedną granicą faz, na której zachodzi szybka, odwracalna reakcja potencjałotwórcza – reakcja utleniania lub redukcji. Potencjał powstaje na granicy między metalem i elektrolitem, przy czym metal jest jednym z reagentów lub pełni tylko funkcję przenośnika elektronów między reagentami znajdującymi się w otoczeniu[1][2][3].
Przykłady elektrod I rodzaju

Elektrodami pierwszego rodzaju (I rodzaju) są najczęściej metale (np. drut, blaszka) zanurzone w roztworach, które zawierają ich jony, np.[2]:
- elektroda miedziana: Cu|Cu2+,
- elektroda cynkowa: Zn|Zn2+,
- elektroda srebrowa: Ag|Ag+,
- elektrody amalgamatowe, np. kadmowa: Cd(Hg)|Cd2+.
Do tej grupy zalicza się również elektrody gazowe, np.[2]:
- elektroda wodorowa: Pt|H2, H+,
- elektroda chlorowa: Pt|Cl2, Cl−
lub elektrody redoks (metal szlachetny znajduje się w roztworze, w którym zachodzi reakcja redoks), np.[1]:
- elektroda chinhydronowa,
- elektroda Pt|Mn2+, MnO4−,
- elektroda Pt|Fe2+, Fe3+.
Stan równowagi
W stanie równowagi reakcje utleniania metalu, prowadzące do tworzenia kationów, i reakcje redukcji kationów do atomów metalu zachodzą z jednakową szybkością. W tym stanie jednakowe są sumy potencjałów elektrochemicznych i chemicznych substratów i produktów reakcji elektrodowej. W ogólnym przypadku anodowego utleniania metalu (M) otrzymuje się wówczas równanie Nernsta w postaci[2][1]:
gdzie:
- – potencjał normalny elektrody,
- – stała gazowa,
- – temperatura,
- – liczba elektronów wymienianych w reakcji połówkowej,
- – stała Faradaya,
- – aktywności metalu i jego jonów w stanie równowagi.
W analogicznym przypadku elektrody wodorowej otrzymuje się zależność potencjału elektrody od pH:
Równania Nernsta są podstawą potencjometrycznych oznaczeń stężenia (np. pH-metria). Dokładność oznaczeń potencjometrycznych zależy od stałości i odtwarzalności potencjału stosowanych elektrod. W przypadku elektrod pierwszego rodzaju występują zmiany potencjału, spowodowane np. zmianami stanu powierzchni metalu w czasie procesów elektrochemicznych, pod wpływem czynników mechanicznych, adsorpcji gazów, powstawania warstewek tlenkowych. Najbardziej odtwarzalne potencjały mają elektrody monokrystaliczne, kontaktujące się z roztworem jedną płaszczyzną sieci krystalicznej. Skuteczną metodą zwiększania odtwarzalności bywa też działanie przeciwne – znaczne zwiększanie stopnia rozwinięcia powierzchni (stosowanie bardzo drobnych proszków metalicznych). Niepowtarzalność potencjału, związaną z orientacją sieci krystalicznej metalu względem powierzchni elektrody, bywa eliminowana również przez stosowanie amalgamatów[1].
Zamknięte obwody elektryczne
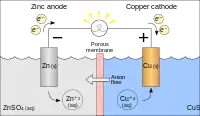
anodowe utlenianie cynku i katodowa redukcja miedzi
Przytoczone równania dotyczą wyłącznie stanu równowagi termodynamicznej, a więc sytuacji, gdy obwód elektryczny jest otwarty lub jest zamknięty z użyciem opornika o nieskończenie dużej rezystancji (natężenie prądu elektrycznego jest nieskończenie małe). W sytuacjach rzeczywistych (pracujące ogniwa galwaniczne lub elektrolizery) do stanu równowagi nie dochodzi. Potencjały są elektrod różnią się od wartości równowagowych o wartość nadnapięcia[4]. Pomiary wartości nadnapięcia stężeniowego na kroplowej elektrodzie rtęciowej są podstawą polarografii.
Zobacz też
- elektroda drugiego rodzaju
- elektroda trzeciego rodzaju
- elektroda proszkowa
Przypisy
- 1 2 3 4 Stanisław Bursa: Chemia fizyczna. Wyd. 2 popr. Warszawa: Państwowe Wydawnictwo Naukowe, 1979, s. 752–756. ISBN 83-01-00152-6. (pol.).
- 1 2 3 4 Praca zbiorowa: Encyklopedia techniki – Chemia. Wyd. 4. Warszawa: Wydawnictwo Naukowo–Techniczne, 1993, s. 206. ISBN 83-204-1312-5.
- ↑ Leksykon naukowo-techniczny z suplementem. T. A-O. Warszawa: WNT, 1989, s. 686. ISBN 83-204-0969-1.
- ↑ Józef Szarawara: Termodynamika chemiczna. Warszawa: WNT, 1969, s. 21–23.