Na przestrzeni minionych stuleci wielu badaczy podejmowało próbę usystematyzowania pierwiastków, tworząc różne formy układu okresowego.

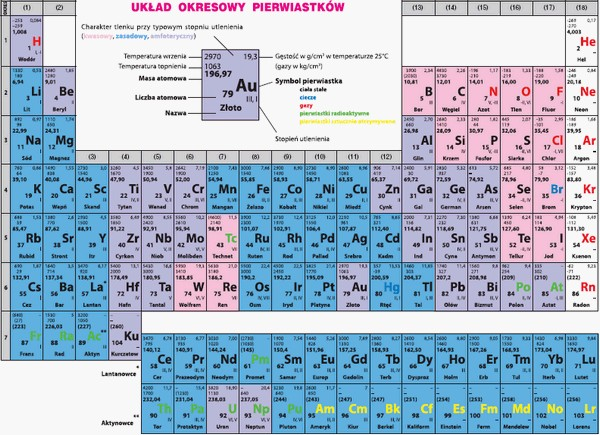
Współczesny układ okresowy różni się od pierwszych układów zaproponowanych przez Mendelejewa i Wernera. Zawiera 18 grup i 7 okresów. Podstawą uporządkowania pierwiastków jest ich liczba atomowa (konfiguracja elektronowa). Współcześnie próbowano tworzyć inne formy układu okresowego – pojawiała się forma trójwymiarowa, kolista, spiralna, piramidalna, jednak najczęściej spotykana i ogólnie przyjęta jest klasyczna „prostokątna” wersja układu okresowego.
Współczesny układ okresowy zawiera 111 pierwiastków; pierwiastek 110 zapisywany symbolem Uun uzyskał nazwę „Darmsztadt” i symbol Ds, a pierwiastek 111– nazwę „Roentgen” i symbol Rg.
Pierwiastki ułożone w kolejności rosnącej liczby atomowej tworzą 7 poziomych okresów oraz 18 kolumn (grup) o numerach od 1 do 18 (cyfry arabskie). Lantanowce i aktynowce zajmują odrębne miejsce w układzie okresowym.
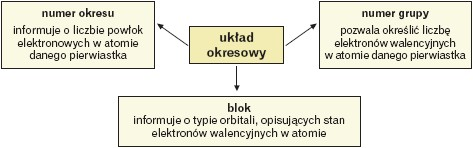
Atomy pierwiastków należących do określonej grupy mają jednakową liczbę elektronów walencyjnych. Dla grup od 1 do 12– liczba elektronów walencyjnych jest zgodna z numerem grupy, a dla grup od 13 do 18 należy – w celu określenia liczby elektronów walencyjnych – od numeru grupy należy odjąć 10. Każda grupa obejmuje pierwiastki o analogicznych właściwościach chemicznych i częściowo fizycznych. Nazwy grup tworzy się od nazwy pierwiastka rozpoczynającego grupę, np. grupa 1 – litowce, grupa 2 – berylowce, grupa 17 – fluorowce.
Atomy pierwiastków należących do danego okresu mają jednakową liczbę powłok elektronowych zgodną z numerem okresu. Numer okresu określa ostatnią powłokę,którą w przypadku pierwiastków bloku s i p (pierwiastków grup 1, 2 i 13 – 18) można nazwać walencyjną.
Współczesny układ okresowy wyróżnia cztery bloki pierwiastków, których elektrony walencyjne w atomach opisywane są analogicznymi typami orbitali.