Hybrydyzacja to zabieg matematyczny polegający na kombinacji liniowej walencyjnych orbitali atomowych tego samego atomu. Uzyskane nowe orbitale atomowe, o tym samym kształcie konturu i energii (co odróżnia je od orbitali, z których powstały), noszą nazwę orbitali zhybrydyzowanych (hybryd). Typ hybrydyzacji określa, które walencyjne orbitale atomowe zostały poddane matematycznemu przekształceniu, a jednocześnie wyznacza rozmieszczenie przestrzenne powstałych hybryd. Hybrydy w przestrzeni ułożone są w sposób gwarantujący minimalne ich oddziaływania. Rodzaje orbitali zhybrydyzowanych powstających ze zmieszania orbitali s i p:
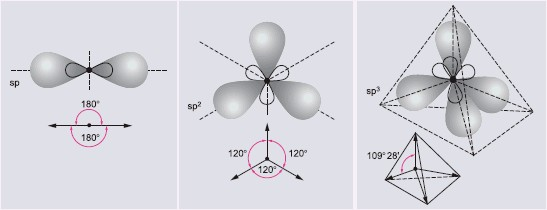
- sp – dwie hybrydy ułożone liniowo (kąt 180°) – w hybrydyzacji uczestniczy orbital s i jeden orbital p,
- sp2 – trzy hybrydy skierowane do naroży trójkąta równobocznego, leżące w jednej płaszczyźnie (kąt 120°) – w hybrydyzacji uczestniczy orbital s i dwa orbitale p,
- sp3 – cztery hybrydy skierowane do naroży tetraedru (kąt 109°28’) – w hybrydyzacji uczestniczy orbital s i trzy orbitale p.
Poniższy rysunek przedstawia przestrzenne rozmieszczenie hybryd danego typu:
Opis zachowania elektronów w cząsteczkach – na gruncie mechaniki kwantowej – wymaga uwzględnienia faktu, że elektrony znajdują się w polu działania więcej niż jednego jądra atomowego. Podobnie jak dla elektronów w atomach, elektrony w cząsteczkach opisywane są funkcjami falowymi zwanymi orbitalami cząsteczkowymi.
