Fosfor występuje w przyrodzie w postaci minerałów takich jak fosforyt Ca3(PO4)2 lub apatyt fluorowy 3 Ca3(PO4)2 · CaF2. Jest także składnikiem żywych organizmów (m.in. wchodzi w skład kwasów nukleinowych oraz niektórych białek).
Fosfor występuje w przyrodzie w postaci minerałów takich jak fosforyt Ca3(PO4)2 lub apatyt fluorowy 3 Ca3(PO4)2 · CaF2. Jest także składnikiem żywych organizmów (m.in. wchodzi w skład kwasów nukleinowych oraz niektórych białek).
Konfiguracja elektronowa atomu fosforu: 1s2 2s2 2p6 3s2 3p3.
Stopnie utlenienia fosforu w związkach: –III, III, V.
Fosfor tworzy cztery odmiany alotropowe o różnych właściwościach i zastosowaniu:
| odmiana | właściwości | zastosowanie |
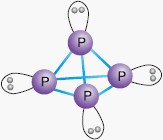
| fosfor biały | - występuje w postaci czteroatomowych cząsteczek P4 - białe ciało stałe, nierozpuszczalne w wodzie - ulega samozapaleniu w ok. 40oC, dlatego przechowywany jest pod wodą - w ciemności świeci, „fosforyzuje” zielonym światłem, gdyż pod wpływem tlenu z powietrza utlenia się, czemu towarzyszy emisja światła – zjawisko chemiluminescencji - jest aktywny chemicznie - nie przewodzi prądu elektrycznego - jest trujący |
ma zastosowanie w produkcji tlenków, kwasów i soli kwasów fosforowych |
| fosfor czerwony | - czerwono-różowy proszek, bez zapachu, nierozpuszczalny w wodzie - ma mniejszą aktywność chemiczną niż fosfor biały - słabo przewodzi prąd elektryczny - nie jest trujący |
stosowany do produkcji zapałek, a także w przemyśle zbrojeniowym, np. do produkcji bomb i amunicji, stosowany jest także jako dodatek do stopów metali jako środek podnoszący ich twardość |
| fosfor fioletowy | - jest stosunkowo nietrwały - powstaje podczas ogrzewania fosforu czerwonego |
--- |
| fosfor czarny | - najtrwalsza odmiana fosforu - jest to ciało stałe o szarym zabarwieniu i metalicznym połysku - przewodzi prąd elektryczny |
--- |
Fosfor biały występuje w postaci cząsteczek P4, które mają kształt tetraedru, a każdy atom fosforu w cząsteczce jest w stanie hybrydyzacji sp3.