 | |
| Systematyka[1][2] | |
| Domena | |
|---|---|
| Królestwo | |
| Podkrólestwo | |
| Nadgromada | |
| Gromada | |
| Podgromada | |
| Nadklasa | |
| Klasa | |
| Nadrząd | |
| Rząd | |
| Rodzina | |
| Rodzaj | |
| Gatunek |
pałka szerokolistna |
| Nazwa systematyczna | |
| Typha latifolia L. Sp. pl. 2:971. 1753[3] | |
| Kategoria zagrożenia (CKGZ)[4] | |
 | |


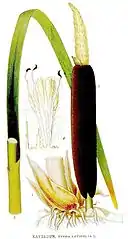
Pałka szerokolistna, rogoża[5] (Typha latifolia L.) – gatunek rośliny należący do rodziny pałkowatych (Typhaceae). Szeroko rozprzestrzeniony na świecie, w Polsce pospolity. Rośnie na brzegach wód stojących i wolno płynących. Tworzy często rozległe, zwykle niemal jednogatunkowe szuwary. Jest jedną z ważniejszych roślin jadalnych rosnących w dzikiej przyrodzie. Rośliny tego gatunku dostarczają surowca plecionkarskiego, wykorzystywane są w bukieciarstwie i do fitoremediacji, a także uprawiane są jako ozdobne.
Zasięg występowania
Gatunek jest bardzo szeroko rozprzestrzeniony na kuli ziemskiej. Występuje na wszystkich kontynentach, z wyjątkiem Antarktydy[6]. W Europie zwarty zasięg obejmuje niemal cały kontynent. Rzadziej rośnie w południowej części Półwyspu Iberyjskiego i Bałkańskiego, brak go na Islandii, w północnej części Półwyspu Skandynawskiego i w północnej Rosji[7]. W Afryce występuje lokalnie na północnych krańcach kontynentu[7], poza tym w części środkowej kontynentu, w Nigerii, oraz na wschodzie – w Etiopii, Kenii, Tanzanii i Ugandzie[7]. W Azji zasięg obejmuje południową Syberię i Azję Środkową, na południu sięgając po północny Pakistan. Gatunek rośnie w rejonie Kaukazu, w Azji Mniejszej i wzdłuż wschodnich wybrzeży Morza Śródziemnego. Na Dalekim Wschodzie zasięg obejmuje basen Morza Japońskiego, Sachalin i Wyspy Japońskie[7]. W Ameryce Północnej gatunek jest pospolity we wschodniej i środkowej części, poza tym spotykany jest na rozproszonych stanowiskach w zachodniej części kontynentu. Rośnie w basenie Zatoki Meksykańskiej i jako zawleczony w rejonie Morza Karaibskiego[6]. W Ameryce Południowej występuje w Argentynie, Paragwaju i południowej Brazylii[6].
Pałka szerokolistna uprawiana jest w wielu krajach świata. Jako gatunek introdukowany rozprzestrzenia się w Australii, Nowej Zelandii, na Hawajach[6] i w południowo-wschodniej Azji[8]. Ze względu na wypieranie gatunków rodzimych, szybkie rozrastanie się, tworzenie gęstych, jednogatunkowych i trwałych zbiorowisk, gatunek zaliczony został do najbardziej uciążliwych roślin inwazyjnych na świecie[9]. Potencjalnie jeszcze większą inwazyjnością cechuje się mieszaniec pałki szerokolistnej i wąskolistnej – pałka pośrednia T. ×glauca[8][10].
W Polsce pałka szerokolistna jest szeroko rozprzestrzeniona na całym niżu i w niższych położeniach górskich[11][12]. Szczególnie pospolicie rośnie w południowej i zachodniej części kraju[13].
Morfologia
- Łodyga
- Wzniesiona, sztywna, wyrastająca z pełzającego kłącza. Osiąga od 1,5 do 2,5 m[14] (rzadko do 3 m) wysokości oraz do 2 cm średnicy w połowie długości i 0,3–0,7 cm średnicy w górnej części[15]. Kłącze rzadko rozgałęzione, okryte łuskami, tęgie[16]. Osiąga do 70 cm długości i 0,5–3 cm średnicy. Znajduje się zazwyczaj 7–10 cm poniżej powierzchni gleby[17]. Z kłącza wyrastają włókniste korzenie przybyszowe[18].
- Liście
- Zwykle tylko odziomkowe, bifacjalne[19]. Na jednym pędzie nadziemnym jest ich od 12 do 16[17]. Blaszka liściowa jest równowąska o unerwieniu równoległym[20]. Stopniowo od łusek na kłączu, liście przechodzą w asymilacyjne otulające pochwami łodygę[16] lub tworzące nibyłodygę (rośliny niekwitnące). Liście asymilacyjne są sinozielone, wzniesione o długości do 3 m, z czego znaczna część to pochwa liściowa[20]. Wolna część blaszki liściowej ma szerokość od 1 do 2,9 cm[15], od strony odosiowej jest wypukła, na przekroju poprzecznym półksiężycowata[21]. Skręcona nieco w luźną spiralę[19]. Liście sięgają zwykle na długość końca kwiatostanu lub nieznacznie są od niego dłuższe[18]. Pochwy liściowe są otwarte[17], wzdłuż brzegów są błoniaste lub papierzaste, jaśniejsze[15]. Na doosiowej powierzchni pochew, rzadziej na wolnej części blaszki, występują bezbarwne i niewyraźnie widoczne gruczoły śluzowe[15]. Wydzielany przez nie śluz chroni łodygę i liście przed zdarciem w czasie ich ocierania się podczas wiatru[11].
- Kwiaty
- Roślina jednopienna, rozdzielnopłciowa[22]. Kwiaty bardzo drobne, jednopłciowe, zebrane w kolby – gęste, cylindryczne kwiatostany na szczycie łodygi. Kwiatostan męski sąsiaduje bezpośrednio od góry z kolbą zawierającą kwiaty żeńskie, rzadko widoczna jest między nimi przerwa nieprzekraczająca 1,5 cm, wyjątkowo 4 cm[18][23]. Kwiatostan męski osiąga od (3,5) 10 do 12 (20) cm długości[21][24] i 1–2 cm średnicy[15] (jest podobnej długości jak kwiatostan żeński[24]). U podstawy kwiatostanu męskiego znajduje się jedna do trzech szybko opadających podsadek[21]. Poszczególne kwiaty, których w kwiatostanie jest ponad tysiąc[23], osiągają od 5 do 12 mm długości[15]. Okwiat w kwiatach męskich jest zredukowany do kilku szczecinek[22]. Każdy kwiat zawiera trzy pręciki. Ich główki są osadzone na nitkach nasadą i posiadają szeroki łącznik[19]. Pyłek uwalniany jest w tetradach[15][18].
- Kwiatostany żeńskie to okazałe kolby osiągające na przekroju 1,2–3 cm średnicy[18]. Początkowo są jasnozielone, potem brązowe[15]. W kwiatach żeńskich szczeciniaste listki okwiatu są bezbarwne[15]. Kwiaty żeńskie nie mają przysadek[5]. Słupek jest pojedynczy, powstaje z jednego owocolistka[19]. Znamiona są lancetowate do jajowato-lancetowatych[18] i wydłużają się po przekwitnieniu (wystają nad okwiat)[19]. Górna zalążnia zawiera pojedynczy, anatropowy zalążek. W kwiatach brak miodników[19].
- Owoce
- Jednonasienne orzeszki, opatrzone włoskami okwiatu w formie puchu kielichowego[11]. Zawierają też trwałe, wydłużające się znamiona i szypułkę, także ułatwiające rozsiewanie[19]. Budowa owoców pozwala na zmniejszenie prędkości spadania. Poza tym roślina, w ramach przystosowania do anemochorii, wytwarza owoce w wielkiej liczbie (od 117 do 268 tys.[17], średnio ok. 220 tys. na jednym pędzie[25][23]).
- Gatunki podobne
- Od pałki wąskolistnej różni się szerszymi liśćmi (u wąskolistnej do 1 cm szerokości) i przyleganiem kolby męskiej do żeńskiej (u wąskolistnej jest kilkucentymetrowa przerwa między kwiatostanami)[13] oraz brakiem przysadek u kwiatów żeńskich[5]. Blisko spokrewniona pałka Shuttlewortha osiąga do 1,5 m wysokości, liście jasnozielone mają do 1 cm (rzadko do 1,5) szerokości. Kwiatostan męski przylega do żeńskiego i jest od niego wyraźnie (1,5 do 4×) krótszy[24].
Biologia
Rozwój

Hydrofit, helofit. Po okresie spoczynku zimowego rośliny rozpoczynają wzrost w marcu[23]. Pędy najsilniej rozrastają się w maju i czerwcu[11]. Jednak nowe pędy nadziemne wyrastają z kłączy sukcesywnie przez cały sezon wegetacyjny. Najsilniejszy przyrost masy kłączy następuje od końca lipca do połowy sierpnia oraz na przełomie września i października[26]. Jesienią masa kłączy jest dwukrotnie większa od masy pędów nadziemnych. Także zawartość węglowodanów w kłączach rośnie jesienią i osiąga wielkość 2–3-krotnie większą niż latem[26]. Na produktywność i wzrost pałki ogromny wpływ mają warunki wodne i rośliny towarzyszące. Najstarsze fragmenty kłącza, osiągające ponad dwa lata – sukcesywnie obumierają. Poszczególne ramety nie żyją dłużej niż trzy lata[23].
W skupieniach roślin dominują pędy wegetatywne. Pędy kwitnące rozwijają się często bardzo nielicznie (np. na jednym z badanych stanowisk trzy pędy kwitnące przypadały na ogólną ich liczbę 1779), na co wpływ może mieć silne wzajemne zacienianie się pędów. Nie kwitną też rośliny całkowicie wynurzone, a słabiej kwitną rośliny rosnące w głębszej wodzie[23]. Kwitnienie w warunkach środkowoeuropejskich trwa od czerwca do sierpnia[11], w cieplejszym klimacie zaczyna się i kończy wcześniej, w chłodniejszym – później[23]. Kwiaty zapylane są za pomocą wiatru[11] (anemogamia). Kwiaty żeńskie zakwitają na pędzie wcześniej niż męskie, co zwykle pozwala uniknąć samozapylenia[23]. Pyłek może być przeniesiony tylko przy silnych wiatrach, a ponieważ długo zachowuje żywotność (przy sprzyjających warunkach przez około 4 tygodni), nierzadko dochodzi do samozapylenia[27]. Po przekwitnieniu kwiaty męskie szybko opadają odsłaniając nagą oś kwiatostanu, podczas gdy suche kwiaty żeńskie utrzymują się do zimy i wówczas odpadają w wielkich ilościach[16][17]. Nasiona powstają w ponad połowie zapylonych kwiatów[23]. Kwitnienie skutkuje zwykle obumarciem całej ramety, co powoduje, że szuwar pałkowy rozprzestrzenia się wegetatywnie na zewnątrz, podczas gdy starsze okazy w środku płatu sukcesywnie zakwitają i zamierają[18]. Nasiona opatrzone aparatem lotnym przenoszone są przez wiatr, czasami również przez wodę[11]. Aparat włoskowy znacznie zmniejsza tempo spadania owocu, wynoszące w efekcie 0,13 m/s. Przy wietrze wiejącym z prędkością 10 km/h i masie owocu wynoszącej 0,05 mg wyliczono dystans transportu diaspory na 46,9 m[23]. Zwykle ok. 95% wytwarzanych nasion posiada zdolność do kiełkowania[28]. Owoce mokre z reguły opadają i pokrywają glebę w zwartych skupieniach. Nasiona przerywają spoczynek i kiełkują na podłożu mokrym lub wilgotnym, przy niskiej koncentracji tlenu, w cieple oraz przy długim dniu i krótkiej nocy. Najlepsze warunki do kiełkowania występują na miejscach pozbawionych okrywy roślinnej, w płytkiej wodzie, która łatwo się nagrzewa i jest dobrze naświetlona. W zwartych szuwarach pałkowych siewki tego gatunku praktycznie nie występują[17]. Nasiona tworzą trwały glebowy bank nasion – potwierdzono niewielką żywotność nasion 5-letnich[23].
Gatunek rozprzestrzenia się na większe odległości głównie przez nasiona, podczas gdy rozmnażanie wegetatywne odgrywa główną rolę dla rozszerzania i utrzymywania się lokalnych stanowisk[17]. Siewki pałki szerokolistnej są drobne[23], nie występuje hipokotyl ani epikotyl. Pojedynczy liścień jest silnie wygięty i ma ok. 1 cm długości[29]. Pierwsze 2–4[23] listki są nitkowate i osiągają do 1,5 cm długości (mają jedną, centralną żyłkę przewodzącą i wyraźne żyłki boczne)[29], następnie rozwijają się 2–6 liści pływających, po czym dopiero zaczyna wzrastać pęd. Gdy osiągnie co najmniej 35 cm wysokości – zaczyna rozrastać się kłącze[23]. W pierwszym roku wzrostu polikormon pałki szerokolistnej może rozrosnąć się na powierzchni o średnicy 3 m[26]. Jednoroczna roślina może mieć ponad sto pąków wierzchołkowych, 35 pędów nadziemnych o wysokości do 10 cm, 29 pędów osiągających do 46 cm i 34 pędy osiągające od 46 do 61 cm wysokości. Roślina dwuletnia może porastać ponad 50 m², a jej kłącza osiągają łączną długość 480 m, wydając ponad 1,7 tysiąca pędów nadziemnych, w tym mogą pojawiać się pojedyncze, pierwsze pędy kwitnące[23].
Anatomia
_stem_cross_section%252C_Arnhem%252C_the_Netherlands.JPG.webp)
Podługowata, często zakrzywiona strefa brzeżna liścia zawiera skupisko włókien oraz pojedynczą wiązkę przewodzącą. W pozostałej części liścia przeplatają się wiązki subepidermalne oraz wiązki w mezofilu asymilacyjnym. Komórki epidermy położone nad każdą wiązką przewodzącą są większe i pokryte grubszą warstwą kutykuli, co na powierzchni liścia powoduje efekt prążkowania lub żebrowania[30]. Ponad 50% objętości liści może stanowić aerenchyma[31], podczas gdy tkanka asymilacyjna zajmuje 10% ich objętości[20].
Generatywna część łodygi otoczona jest epidermą oraz cienką hipodermą. Wewnątrz znajduje się kilka pierścieni wiązek przewodzących. Dużym wiązkom przewodzącym towarzyszy zespół włókien biegnący pomiędzy drugim a trzecim pierścieniem. W tej części łodygi nie występuje endoderma. Krótka łodyga wegetatywna zawiera hipodermę, złożoną z 4–5 warstw komórek oraz jednorzędową epidermę. Pojedyncza warstwa komórek epidermy występuje także w kłączach. Pod nią znajduje się warstwa kory oraz walec osiowy. Korę tworzy kilkuwarstwowa hipoderma, aerenchyma oraz rozproszone, drobne wiązki. Do wewnątrz znajduje się pojedyncza warstwa endodermy. Komórki hipodermy mają ściany zdrewniałe i w zależności od położenia zawierają suberynę lub ligninę. Występowanie pasemek Caspary’ego powoduje, że warstwa taka ma charakter egzodermy[30].
W kłączach pałki szerokolistnej podobnie jak i wąskolistnej, gromadzone są pojedyncze ziarna skrobi o zarysie w przybliżeniu okrągłym lub eliptycznym, o osi od 3 μm do 18 μm, zwykle ok. 11 μm. Rzadko występują ziarna złożone, zbudowane z 2–4 ziaren[32].
Genetyka
Liczba chromosomów 2n = 30[5]. W Ameryce Północnej nierzadko tworzy hybrydy z pałką wąskolistną zwane pałką pośrednią Typha ×glauca, czego nie obserwowano często w Europie[10]. Nowsze badania wskazują jednak, że hybrydyzacja tych dwóch gatunków w Europie jest również spotykana. Okazy mieszańcowe znajdowane są m.in. w zachodniej Polsce[33]. Lokalnie gatunek krzyżuje się również z pałką południową, tworząc gatunek hybrydowy Typha ×provincialis[34]. Zróżnicowanie genetyczne w obrębie populacji na poszczególnych stanowiskach jest bardzo małe[23].
Cechy fitochemiczne
Skład chemiczny tkanek pałki szerokolistnej jest zmienny. Nieco inny skład mają pędy nadziemne i kłącza. Zaobserwowano również różnice między roślinami z odmiennych siedlisk. Zawartość białka wyekstrahowanego (będącego frakcją białka całkowitego) z mączki kłączy pałki szerokolistnej rosnącej w różnych lokalizacjach może różnić się pięciokrotnie[35]. W poniższej tabeli uwzględniono dane z kilku badań dotyczące głównie pędów wynurzonych[36]:
| Substancja | Udział procentowy w suchej masie |
|---|---|
| substancje mineralne (popiół) | 4,2-12 |
| N | 0,35-0,42 |
| P | 0,02-0,66 |
| K | 0,35-5,0 |
| Ca | 0,21-2,5 |
| Mg | 0,1-0,77 |
| Na | 0,07-0,55 |
| S | 0,1-0,2 |
| Si | 0,22 |
| Fe | 0,007-0,02 |
| Mn | 0,01-0,34 |
| Zn | 0,0017-0,01 |
| białka | 10,3 |
| tłuszcze | 3,9 |
| celuloza (błonnik) | 33,2 |
| chlorofile | 0,26 |
| taniny | 2,1 |
| kwas asparaginowy | 1,35 |
| kwas glutaminowy | 1,31 |
| lizyna | 0,66 |
| histydyna | 0,25 |
| arginina | 0,62 |
| treonina | 0,5 |
| seryna | 0,52 |
| prolina | 0,48 |
| glicyna | 0,63 |
| alanina | 0,75 |
| izoleucyna | 0,62 |
| leucyna | 1,05 |
| cysteina | 0,57 |
| metionina | 0,16 |
| tyrozyna | 0,39 |
| fenyloalanina | 0,6 |
| wartość energetyczna [kJ/g] | 16,7 |
W niektórych starszych źródłach (z początków XX wieku) donoszono o trujących, w pewnych sytuacjach, właściwościach pałki dla ludzi i zwierząt. Informacje te nie znajdują jednak potwierdzenia. Puch ułatwiający rozsiewanie nasion może podrażniać oczy. Pyłek pałki nie powoduje jednak reakcji alergicznych[18].
Rośliny wytwarzają szereg związków pełniących funkcję allelopatin. Wytwarzane związki należą do steroidów oraz kwasów tłuszczowych i hamują wzrost niektórych mikroglonów oraz sinic[37][38].
Fizjologia
Transport gazów, O2 do korzeni i CO2 z korzeni do pędu odbywa się w wyniku konwekcji. Różnica ciśnień względem otoczenia zmierzona dla roślin tego gatunku wynosiła 350 Pa. Tempo przepływu gazu w kłączach pałki wynosi do 8 cm³ min−1[39]. Opory przepływu w liściach oraz w połączeniach liści z kłączem są większe[40]. Na tempo to znacząco wpływa temperatura otoczenia oraz wilgotność względna, nie obserwowano natomiast by wpływało nań światło[39].
Nasiona są fotoblastyczne. Oświetlanie oraz niskie stężenie tlenu prowadzą do zwiększonego zatrzymywania wody przez koloidy, co prowadzi do obrzmienia i pęknięcia okrywy nasiennej[41]. Optymalna temperatura kiełkowania wynosi 30 °C w dzień przy zakresie stężeń tlenu 2,3 do 4,3 mg dm−3. Działanie światła czerwonego musi trwać co najmniej 10 godzin przy natężeniu 2,5 × 10 −8 W m−2[42].
Chociaż pałka szerokolistna należy do roślin o fotosyntezie C3, wykazuje się wyjątkowo wysoką efektywnością asymilacji dwutlenku węgla, a cykl fotooddechowy pomimo wysokiej aktywności oksydazy glikolanowej obejmuje niewielką część asymilowanego CO2[43].
Obserwowano występowanie pałki na terenach skażonych metalami ciężkimi. Badania laboratoryjne potwierdziły wysoką odporność gatunku na zanieczyszczenia metalami takimi jak Zn, Cu[44], Cd[45], Fe, Ni[46]. Metale te mogą być gromadzone w tkankach pałki bez negatywnego wpływu na działanie organizmu[45]. Pałka szerokolistna ma tendencję do akumulowania metali ciężkich w korzeniach. Zawartość w kłączach i pędach asymilacyjnych jest mniejsza, przy czym – z wyjątkiem manganu – w częściach zielonych mniejsza niż w kłączach, co sugeruje, że istnieją mechanizmy fizjologiczne zapobiegające wnikaniu metali ciężkich w głąb tkanek[47].
Ekologia
Wymagania siedliskowe i wpływ na siedlisko

Pałka szerokolistna rośnie w bardzo zróżnicowanych warunkach klimatycznych – w strefach umiarkowanych (na północy sięgając środkowej części Alaski, gdzie temperatury zimowe sięgają –34 °C) i międzyzwrotnikowej, w wilgotnym klimacie oceanicznym oraz na obszarach będących pod wpływem klimatu kontynentalnego[18]. W górach spotykana na obszarach położonych nawet na wysokości 2300 m n.p.m.[23] Roślina występuje w wodach stojących oligotroficznych do eutroficznych (płytkie i zatorfione brzegi jezior, starorzecza, rowy melioracyjne, doły potorfowe), na podłożu zwykle mulistym, zasobnym w materię organiczną, przynajmniej w warstwie wierzchniej[17][11]. W zbiornikach wodnych może rosnąć w strefie litoralu do głębokości 2 m. Znosi dosyć duże wahania poziomu wody, ale jej korzenie i kłącza muszą być stale w podłożu zalanym wodą[11]. Znosi wysychanie w miesiącach letnich, ale nie przeżywa długotrwałej suszy[23]. Wraz ze wzrostem głębokości rośliny rosną w zbiorowisku rzadziej i słabiej kwitną. W takich warunkach biomasa lokowana jest bardziej w liściach niż w organach podziemnych[48]. Gdy teren, na którym rośnie pałka szerokolistna, ulegnie zlądowaceniu, rośliny tego gatunku giną, a ich miejsce zajmują inne rośliny szuwarowe lub mszysto-turzycowe. Podczas gwałtownego przyboru wód czasami całe łany pałki ulegają oderwaniu od podłoża i pływają na wodzie jako tzw. pło[11]. Dzięki dodatniej pływalności kłączy (ze względu na przestwory powietrzne oraz uwięzione w pływającej macie roślin pęcherze gazu, powstające w procesach anaerobowych), skupienia pałki mogą rosnąć bez kontaktu z podłożem, tworząc płat o grubości kilkudziesięciu centymetrów[23]. Splątane kłącza i grube łodygi pałki zatrzymują szczątki organiczne i niesiony przez wodę muł. W rezultacie gatunek ma duży udział w zarastaniu zbiorników wodnych. Produkuje dużą ilość biomasy, która jednak szybko ulega rozkładowi[11]. Ze względu na sprawny system transportu tlenu do korzeni, skutecznie natlenia podłoże, zwykle ubogie w ten pierwiastek, dzięki czemu przyczynia się istotnie do ograniczenia fermentacji metanowej[49]. Pałka ta bywa spotykana na brzegach wód słabo zasolonych[17], przy czym o ile dorosłe rośliny dość dobrze znoszą zasolenie osiągające ponad 1,1%, o tyle na siedliskach zasolonych nasiona nie kiełkują, a także znacznie ograniczone jest tworzenie pędów kwitnących[23]. Pałka szerokolistna dobrze znosi pożary, regenerując się z kłączy. Wyjątkiem są sytuacje, gdy pożary zbiegają się z osuszeniem siedliska lub po wypaleniu roślin nastąpi podniesienie poziomu wód[23].
Oddziaływania międzygatunkowe

._Locatie%252C_De_Famberhorst_01.JPG.webp)
.jpg.webp)
Zdominowane przez pałkę szerokolistną fitocenozy występują przeważnie w węższym zakresie niż te, w których jest domieszką, tj. w wodach żyznych o głębokości do 1 m. W sukcesji roślin wodnych zwykle stanowią jednak fazę dość krótkotrwałą. Mogą przekształcać się w pło paprociowe, w którym pałka szerokolistna bywa współdominantem[11]. Szerokie i stosunkowo krótkie liście pozwalają na zasiedlenie przede wszystkim wód płytkich do głębokości 15 cm. Przy większej głębokości przewagę w konkurencji uzyskuje inny gatunek pałki – Typha angustifolia[50] (gdy szuwary tych gatunków sąsiadują, szuwar pałki szerokolistnej zwykle tworzy pas bliższy brzegu[17]). Niemniej, w niektórych regionach oba te gatunki, jak również ich krzyżówki, zajmują siedliska o podobnej głębokości (która ponadto potrafi być zmienna sezonowo)[51]. Zwarte płaty pałki szerokolistnej znacznie ograniczają możliwości rozwoju innych roślin, stąd często mają charakter jednogatunkowych agregacji. Ze względu na wielkie ilości wytwarzanych diaspor i szybki rozrost wegetatywny – gatunek w krótkim czasie może skolonizować i zdominować zaburzone lub nowo powstałe siedliska[28].
Pałka szerokolistna jest kluczową rośliną pokarmową dla piżmaka oraz ważną dla nutrii[23] i kaczkowatych z plemienia Anserini. Nasiona bywają spożywane przez cyraneczkę karolińską, biegusa tundrowego, berniklę kanadyjską, śnieżycę dużą i gęś białoczelną[17]. Piżmaki często budują sobie schronienia z materiału pochodzącego z tych roślin. W szuwarach pałkowych chętnie chronią się jelenie[17]. Skupienia pałki stanowią biotop lęgowy wielu kaczkowatych oraz epoletnika krasnoskrzydłego, są wykorzystywane jako miejsce schronienia także przez wiele innych gatunków wodno-błotnych[28]. Puch z owoców pałki jest jednym z budulców gniazda remiza zwyczajnego[52].
Pałka szerokolistna jest rośliną pokarmową dla larw chrząszczy Stilbus oblongus (pleszakowate), na górnej powierzchni liści żerują dorosłe Donacia cinerea, na korzeniach larwy Donacia aquatica, Donacia cinerea i Plateumaris sericea (stonkowate), na łodydze Tournotaris bimaculatus (Erirhinidae)[53], a w łodydze Sphenophorus pertinax (Dryophthoridae). Na powierzchni liści żerują gąsienice Arsilonche albovenosa[18] i Simyra insularis[54], a minują je Bellura obliqua i Nonagria oblonga (sówkowate)[18]. W kolbach żyją i żywią się sokami nimfy i dorosłe pluskwiaki Chilacis typhae (zwińcowate). W żywych pochwach liściowych rozwijają się larwy muchówki Phaonia atriceps, a w martwych Typhamyza bifasciata[53].
Na pałce występują rozmaite gatunki słodkowodnych ślimaków, uszkodzone i rozkładające się organy tej rośliny stanowić mogą pokarm zatoczka rogowego (Planorbarius corneus L.) i przyczepki jeziorowej (Acroloxus lacustris L.) – zwłaszcza osobniki tego ostatniego gatunku mogą na liściach i łodydze pałki występować masowo[55].
Gatunek może tworzyć mikoryzę arbuskularną z grzybami z rodzaju Glomus. Związek jest prawdopodobnie fakultatywny i zależny od warunków wzrostu roślin[56]. Dodatkowy tlen, który wodne rośliny jednoliścienne uwalniają do podłoża, sprzyja mineralizacji i zwiększa dostępność fosforu. Związek rośliny i grzyba może więc mieć niewielkie znaczenie[57]. Porównując wzrost roślin w obecności grzyba oraz w sterylnym podłożu wykazano, że mikoryza u pałki korzystnie wpływa na wzrost i ilość wytwarzanej biomasy[58]. W warunkach, gdy rośliny są okresowo zalewane, ilość arbuskul oraz strzępek jest pozytywnie skorelowana z długością okresu o niskim poziomie wody[59].
Na liściach rozwijają się pyknidia Phyllosticta typhina (Botryosphaeriaceae, powoduje rdzawe, podługowate plamy na końcach liści, jaśniejsze w środku) i Stagonospora typhoidearum (Phaeosphaeriaceae). Gatunek Colletotrichum typhae (Glomerellaceae) powoduje na liściach pomarańczowo-brązowe zmiany, stopniowo ciemniejące, na brzegach zaczerwienione, w środku z czasem jaśniejące[53]. Na martwych pędach pałki zarejestrowano rozwój takich gatunków grzybów jak: Typhula capitata i Psathyrella typhae (pieczarkowce), Lindtneria trachyspora (gołąbkowce), Septoria menispora (Mycosphaerellales), Arthrinium sporophleum (Apiosporaceae), Lachnum controversum (Helotiales), bagnówka pałkowa Epithele typhae (żagwiowce)[53].
Podwodne części pędów pałki szerokolistnej stanowią istotne podłoże dla epifitycznych glonów. Peryfiton na pędach tej rośliny składać się może ze 150 tysięcy glonów na m−2 i ponad 18 tysięcy mikrofauny na m−2[60]. Do dominantów w zbiorowiskach glonów peryfitonowych na pędach pałki należą: Fragilaria ulna, Fragilaria capucina, Spirogyra sp., Oscillatoria sp. i Komvophoron crassum[61][62].
- Fitosocjologia
- Pałka szerokolistna zazwyczaj występuje masowo, tworząc rozległe, jednogatunkowe szuwary, ale czasami występuje także jako domieszka w innych zespołach szuwarowych. Gdy rośnie w małych zbiornikach wodnych, w których nie ma dużego falowania wód, tworzy pas roślinności przybrzeżnej najdalej wnikający w toń wodną (zwykle w większych zbiornikach głębiej mogą rosnąć z roślin wynurzonych oczerety[17]). Od strony lądu szuwar pałkowy kryje się zwykle za pasem trzcinowisk[11], ewentualnie szuwarów mozgowych i zarośli wierzbowych[17]. W klasyfikacji zbiorowisk roślinnych jest to gatunek charakterystyczny dla klasy Phragmitetea i zespołu szuwaru pałkowego Typhetum latifoliae[63].
Systematyka i zmienność
W pierwszej klasyfikacji systematycznej rodzaju Typha z 1889 Moriz Kronfeld umieścił gatunek T. latifolia w sekcji Ebracteolatae (jednej z dwóch wyodrębnionych w rodzaju) w podsekcji Schuria wspólnie z takimi gatunkami jak: T. shuttleworthii, T. capensis i T. orientalis. Kolejnej rewizji systematycznej rodzaju dokonał S.G. Smith w 1987. Wyróżnił on 6 grup bez rangi systematycznej i T. latifolia znalazła się w grupie I wspólnie z T. shuttleworthii. Analiza chloroplastowego DNA potwierdziła bliskie pokrewieństwo tych gatunków. Tworzą one klad oddzielony jako jeden ze starszych w obrębie rodzaju – zaraz po kladzie bazalnym z wyraźnie odrębną T. minima[64].
Udokumentowano liczne ekotypy gatunku, jednak najwyraźniej są one wynikiem specyficznego oddziaływania środowiska, a nie uwarunkowań genetycznych[18]. Ekotypy różnią się w odniesieniu do takich cech jak: długość liści i fenologia ich rozwoju, forma wzrostu klonalnego, termin kwitnienia. Różnią się także reakcjami fizjologicznymi (np. na wzrost stężenia dwutlenku węgla, intensywności oświetlenia). Poza ekotypami różniącymi się preferencjami klimatycznymi lub determinowanymi przez takie czynniki, zarejestrowano adaptacje ze względu na zasolenie i zmienność warunków siedliskowych[18].
Jako forma ambigua bywają klasyfikowane rośliny, u których występuje przerwa między kwiatostanem męskim i żeńskim[23].
- Mieszańce
Znane są mieszańce z pałką wąskolistną (T. ×glauca) i południową (T. ×provincialis)[34]. Oba mieszańce są sterylne i rozprzestrzeniają się wegetatywnie[18].
- Pałka pośrednia[65] Typha ×glauca od pałki szerokolistnej różni się zwykle obecnością przerwy między kwiatostanem męskim i żeńskim (długości do 3,3 cm), równowąskimi lub równowąsko-lancetowatymi znamionami, obecnością bardzo drobnych przysadek przy kwiatach żeńskich, liśćmi przewyższającymi mniej lub bardziej wyraźnie kwiatostany[18]. Od pałki wąskolistnej, która jest taksonem macierzystym (zapylana jest pyłkiem pałki szerokolistnej)[8], różni się zielonym kwiatostanem podczas kwitnienia (u T. angustifolia – brązowy) oraz drobniejszymi przysadkami, które widać pod powiększeniem co najmniej 20× (u T. angustifolia – wystarcza 10×), przy czym są one węższe od znamion[18].
- Mieszaniec T. ×glauca odnotowany został po raz pierwszy w Europie w 1889 roku przez Kronfelda[8] jednak nie jest na jej obszarze zbyt często notowany[10]. Jest rozpowszechniony natomiast w południowo-wschodniej Kanadzie, w północnej i zachodniej części USA[8]. Mieszaniec dobrze rośnie w siedliskach przekształconych przez człowieka i jego zdolności adaptacyjne wskazują na potencjalnie inwazyjny charakter[8][10]. Z Ameryki Północnej opisywany jest też proces krzyżowania wstecznego i introgresji prowadzący do rozmywania puli genowej gatunków rodzicielskich[18]. Do samej hybrydyzacji dochodzi najwyraźniej bardzo rzadko. Nie stwierdzono powstania mieszańca podczas 6-letnich obserwacji wspólnego stanowiska obu taksonów rodzicielskich. Mieszaniec nie został odnaleziony, mimo poszukiwań i wsparcia badaniami genetycznymi dla jego identyfikacji, na wielu obszarach, np. na Ukrainie[8]. Na liście krajowej flory polskiej z 2020 mieszaniec ten określony został jednak jako „częsty”[65].
- Występowanie Typha ×provincialis stwierdzono w Ameryce Północnej, jednak brak danych na temat częstości powstawania tego mieszańca i jego rozprzestrzenienia[8].
- Odmiany uprawne
W uprawie stosowany jest kultywar ‘Variegata’ o liściach wąsko, biało obrzeżonych i z wąskim białym paskiem biegnącym wzdłuż środka liścia[66]. Rośliny tej odmiany są mniej ekspansywne w uprawie od formy typowej[67].
Nazewnictwo
W polskim nazewnictwie ludowym i tradycyjnym funkcjonowały następujące nazwy: baszka, doktorska baszka wodna, gołka, kołowiej, ożypałka, ożypałka szerokoliściowa, pałka, pałka bagienna, pałka większa, pałka wodna, pałki, rogoża, rogoża kołowiejec, rogoża ożypałka, rogoża pałka wodna, rogoża rogozina, rogoża szerokolistna. Część z nich dotyczy też innych przedstawicieli rodzaju[68].
Nazwy typhe (τύφη) w odniesieniu do pałki używał Teofrast (372–287 p.n.e.). Dioskurydes (40–80 n.e.) używał określenia typhes (τυφης). Pochodzenie tych określeń wiąże się ze słowem typhos oznaczającym moczary, ewentualnie też opary, dymy, mgły – co wiązane jest z delikatnym wyglądem rozsiewających się owoców. Nazwa ta została zaadaptowana jako rodzajowa przez Karola Linneusza, ale też była stosowana w zlatynizowanej formie przez wcześniejszych botaników[69][70]. Hieronim Bock i Jacques Daléchamps używali określenia Typha aquatica, Albrecht von Haller – Typha clava unica, Andrea Cesalpino – Typha palustris, Gaspard i Jean Bauhin – Typha palustris major[71]. Naukowa nazwa gatunkowa to zestawienie łacińskich słów latus – ‘szeroki’ i folium – ‘liść’[68].
Zastosowanie


- Roślina jadalna i pastewna
Wszystkie części pałki szerokolistnej są jadalne, a ze względu na rozpowszechnienie i wielkie zasoby tego gatunku, należy on do najważniejszych roślin pokarmowych możliwych do pozyskania w dzikiej przyrodzie[72]. Ślady obróbki pałki (przy czym zachowane szczątki pałki szerokolistnej i wąskolistnej są zbyt podobne, by je jednoznacznie rozróżniać) sięgają co najmniej 30 000 lat wstecz, do paleolitu, a mąka z jej kłączy porównywana jest do mąki z płaskurki[32]. Na jej popularność wpływ może mieć stosunkowo mała zawartość fitolitów[73]. Kłącza możliwe do spożycia surowe, po wysuszeniu i po gotowaniu. Są najbogatsze w składniki odżywcze od jesieni do wiosny, kiedy zawierają ponad 55% węglowodanów (w tym 30–46% skrobi) oraz 6–8% białka. W celu usunięcia nieprzyjemnego zapachu mułu należy kłącza dokładnie umyć. Ponieważ kłącza zawierają dużo włókien, zaleca się pocięcie ich w cienkie talarki, ewentualnie w przypadku gotowania – można przetrzeć wywar przez sito, zatrzymując włókna. Suszone kłącza można także przetrzeć na mąkę. W sumie z 1 ha pałki pozyskać można 8 ton mąki z kłączy[72]. Obficie produkowany żółty pyłek także może być zbierany i wykorzystywany jako bogata w białko mąka[18]. Może być używany po zmieszaniu z mąką pszenną do wypieku chleba, samodzielnie do zagęszczania zup i potraw[74]. Indianie lepili z pyłku ciastka, a w południowo-wschodniej Azji dodawano go do ciast. Można także zjadać (surowe, po przegotowaniu[72] lub pieczone[74]) młode kolby kwiatów żeńskich. Owoce ze względu na aparat puchowy były przygotowywane do spożycia przez potrząsanie z żarem. Dzięki temu drobne owoce się prażyły, a aparat lotny ulegał spopieleniu. Z owoców lepiono placki, dodawano do wypieków, gotowano na papkę lub w zupie[72]. Miękkie, dolne części liści (pochwy liściowe) mogą być spożywane w sałatkach[74] – młode pędy można spożywać zarówno gotowane, jak i na surowo[18]. Mogą być przyrządzane jak szparagi (wymagają dłuższego gotowania) lub dodawane do różnych potraw[74]. Pędy nadziemne pokrojone na krótkie fragmenty można także marynować. Owoce po otarciu z puchu mogą być spożywane jak „orzeszki”. Ze względu na rozliczne walory konsumpcyjne postulowano hodowlę pałki w celu uzyskania odmian o większej produktywności, pozwalających na szersze wykorzystanie tego gatunku jako rośliny spożywczej[18].
Młode rośliny nadają się na kiszonkę dla zwierząt[75], chociaż należy zachować ostrożność przy karmieniu nią koni, których przypadek zatrucia wiązano ze spożyciem pałki szerokolistnej[18].
Roślina odgrywała istotną rolę jako jadalna i znajdująca wielorakie inne zastosowania dla rdzennej ludności Ameryki Północnej. Stąd w literaturze bywa określana jak „bagienny supermarket” (supermarket of the swamps). W przeszłości toczono walki międzyplemienne o kontrolę nad mokradłami porośniętymi szuwarami pałkowymi[23]. Pałka ta była też ważną rośliną pokarmową Kozaków (stąd jedna z angielskich nazw rośliny – Cossack asparagus). Jakuci dodawali sproszkowane kłącza do dania zwanego butagas, w którego skład wchodziły poza tym krwiściąg lekarski, łączeń baldaszkowy i lilia złotogłów[72]. Była także notowana jako roślina jadalna w Chinach od czasów starożytnych – pojawia się w tekstach z epoki Zhou pod nazwą pu (chiń. upr. 蒲; pinyin pú)[76].

Pałka szerokolistna wykorzystywana jest do nasadzeń w oczkach wodnych i stawach. Rozmnaża się z nasion lub przez podział na wiosnę. Jest jednak bardzo ekspansywna, najlepiej sadzić ją tam, gdzie można kontrolować jej rozrastanie się[77]. Kwiatostany są wykorzystywane do bukietów oraz dekoracji wnętrz.
- Materiał plecionkarski i izolacyjny

W wielu regionach z liści pałki wykonuje się maty, plecionki oraz papier[75]. Indianie wykorzystywali plecionki z włókien pałki i jej liści w różnorodnym zakresie, w tym jako materiał izolacyjny, okrycie głowy, żagle do łodzi, wyplatali z niej kosze[69][78]. Matę wyplecioną z pałki datowaną na 10 tysięcy lat BP znaleziono w jaskini w południowej części USA[79]. Z włókna liści wykonuje się powrozy, chodniki i worki. Z uschniętych pędów pałki w budownictwie wykonuje się płyty i maty izolacyjne. Owoce wraz z puszystym okwiatem używane są w tapicerstwie do wyściółki mebli[75], a także do wypełniania poduszek, kołder, materacy i okryć[79][74]. Jan Krzysztof Kluk w 1811 roku pisał, że z puchu na kolbach się naydującego, ubodzy ludzie robią sobie pościele i poduszki dosyć dla nich wygodne[71]. W czasie II wojny światowej wykorzystywano owoce z puchem do napełniania kamizelek ratunkowych (zamiast kapoku) i kurtek lotniczych ze względu na doskonałe właściwości izolacyjne i doskonałą pływalność[79]. Z puchatych owoców pałki Indianie wykonywali wyściółkę w mokasynach[79].
- Fitoremediacja wód
Pałka jest jednym z gatunków znajdujących zastosowanie w oczyszczalniach hydrofitowych, przeznaczonych do oczyszczania ścieków bytowych[80]. Jest gatunkiem szczególnie efektywnym przy oczyszczaniu ścieków zawierających dużo materii organicznej i azotu amonowego[81]. Wykazuje się także zdolnością do pobierania i kumulacji metali ciężkich. Doświadczenia pokazały, że rośliny te są zdolne do pobrania 100% Zn i Cu oraz około 96% Ni z podłoża[82]. W innych badaniach natomiast stwierdzono słabszą w porównaniu z niektórymi innymi hydrofitami zdolność usuwania z wody Mg, Fe, Ni, przeciętną Mn i dużą N, P, S, Ca, K, Na i Cu[83]. W połączeniu z wysoką tolerancją na zanieczyszczenie metalami ciężkimi gatunek może być szeroko wykorzystywany w procesie oczyszczania wód[84]. Dobre efekty uzyskano stosując pałkę szerokolistną w systemie oczyszczania ścieków z garbarni[85] oraz przy usuwaniu z wód fenolu[86]. Roślina jest zdolna do wychwytywania i metabolizowania substancji będącej składnikiem leków – diklofenaku. Leki, pomimo że pojawiają się w ściekach w małych stężeniach, mogą być niebezpieczne dla środowiska ze względu na swoją aktywność biologiczną[87]. Innymi substancjami wychwytywanymi przez pałkę szerokolistną są pestycydy, które pojawiają się w wodach powierzchniowych nawet przy prawidłowej gospodarce rolnej. Rośliny mogą służyć do oczyszczania ścieków z pestycydów, bądź też zapewniać oczyszczanie wód poprzez celowe umieszczenie w rowach melioracyjnych[88]. Na dużą wydajność oczyszczania ścieków przez fitocenozy pałki szerokolistnej ma wpływ działalność mikroorganizmów zasiedlających tworzoną przez nią ryzosferę[89].
- Inne zastosowania
- Gatunek wskaźnikowy wchodzący w skład Makrofitowego Wskaźnika Rzecznego z wartościami L = 2 (wskaźnik zaawansowanej eutrofii) i W = 2 (gatunek o przeciętnej amplitudzie tolerancji ekologicznej)[90].
- Dostarcza biomasy, która może być efektywnie wykorzystana jako źródło energii[81].
- W przedwojennej Polsce pyłkiem pałki szerokolistnej fałszowano zarodniki widłaków, stanowiące ważny wówczas produkt o różnorodnym zastosowaniu[91].
- W polskim lecznictwie ludowym puch z owocami przykładano do oparzeń, rzadziej do innych zranień[92]. W Ameryce Północnej owoce pałki szerokolistnej od ponad 4000 lat stosowane są w leczeniu chorób skóry, oparzeń oraz do sporządzania opatrunków. Badania laboratoryjne potwierdzają lecznicze działanie ekstraktów z owoców zawierających rozpuszczalne w wodzie polisacharydy[93].
- Ponieważ zbite w kolbę owoce z puchem kielichowym są łatwopalne i wewnątrz suche nawet podczas deszczu – używane mogą być jak hubka[74].
Chwast i zwalczanie

Rośnie często jako chwast na polach ryżowych. Może powodować straty w plonach ryżu siewnego[8].
Pałka szerokolistna opisywana jest także jako roślina problematyczna w kontekście utrzymywania urządzeń melioracyjnych – zarasta bowiem rowy i kanały, zmniejszając przepływ wody i zwiększając ich zamulenie[18]. Generuje także problemy w użytkowaniu rybackim i rekreacyjnym zbiorników, ze względu na szybkie zarastanie i zamulanie wszelkich płycizn. Ze względu na silne zwiększanie ewapotranspiracji przyczyniać się może lokalnie do deficytu wody i wysychania niewielkich zbiorników i mokradeł[18].
W przypadku potrzeby zwalczenia lub ograniczenia udziału pałki szerokolistnej może być ona koszona (najlepiej poniżej poziomu wody), wygniatana, wypalana lub niszczona za pomocą herbicydów. Zaleca się realizowanie takich działań w czasie, gdy roślina ponosi największe koszty rozwoju – gdy kwiatostany są świeżo rozwinięte i jeszcze zielone. Jeśli możliwe jest regulowanie poziomu wody, optymalnie jest przed zwalczaniem odwodnić stanowisko, a po zabiegu spiętrzyć wodę zalewając pozostałości roślin[17].
Uprawa
Gatunek bywa uprawiany jako ozdobny ze względu na oryginalne, okazałe kwiatostany. Zaleca się jego sadzenie jednak tylko przy dużych zbiornikach ze względu na szybkie rozrastanie się i duże rozmiary płatów pałki. Ze względu na możliwość przebijania przez ostre końce kłączy folii lub gum używanych do uszczelniania zbiorników – pałka jest zalecana do uprawy tylko w zbiornikach o dnie naturalnym lub zabezpieczonych odpowiednio wytrzymałymi materiałami. Rośliny uprawia się w miejscach nasłonecznionych, w płytkiej wodzie (do 15[94] lub 30[66] cm głębokości). Rozmnaża się je przez podział kłączy wiosną lub za pomocą siewek pojawiających się naturalnie[94]. W celu zapobieżenia rozsiewaniu się roślin ścina się pędy nadziemne, przy czym warto czynność tę wykonywać tuż po zimie, a przed rozpadnięciem się owocostanów. W okresie zimowym należy łodygi zachowywać, ponieważ prowadzona jest przez nie wymiana gazowa między organami podziemnymi a atmosferą[67]. Szkody w uprawie powodować mogą mszyce[94].
Obecność w kulturze

Pałki (bez rozróżniania gatunków) na kontynentach amerykańskich odgrywały istotną rolę w kulturze Indian. Według świętej księgi Popol Vuh narodu Kicze Stwórca stworzył kobietę z pałki (mężczyznę z koralodrzewa). Pałka pojawia się w różnych indiańskich mitach i legendach. Używana była podczas różnych ceremonii i rytuałów m.in. u Algonkinów, Dakotów i Pueblo. Ci ostatni często sadzili pałki przy swoich osadach[69]. Prawdopodobnie przed upowszechnieniem się upraw kukurydzy pyłek pałki był u Indian Pueblo i Apaczów istotnym źródłem pożywienia i był święcony w różnych ceremoniach, m.in. mających przynieść deszcz i powodzenie. Apacze uważali, że pyłkiem pałki jest rozświetlona na nocnym niebie Droga Mleczna. Nawahowie uważali pałkę za zbyt potężną roślinę, by ją spożywać. Używali pyłku w ceremoniach, a z liści wyplatali naszyjniki i bransolety[69]. Saliszowie składali pałki w grobach zmarłych[78].
W Europie pałki są częstym symbolem obecnym w heraldyce[79], symbolizującym pokój i dobrobyt[95].
Przez niektórych botaników i znawców Biblii pałka szerokolistna i pałka południowa są uważane za rośliny biblijne. Według F. N. Heppera opisane w Księdze Wyjścia (13,18 i 14,21-22) przejście Żydów w czasie ucieczki z Egiptu nie odbyło się przez Morze Czerwone, lecz przez podmokłe szuwary na jego obrzeżach. Powołuje się przy tym na występujące w tych cytatach hebrajskie słowa jam-sup, które dosłownie znaczą morze trzcin lub morze pałki[96]. Na niektórych obrazach stojący przed Poncjuszem Piłatem Jezus Chrystus w ręce trzyma kwiatostan pałki. Znawcy roślin biblijnych odrzucają taką możliwość. Co prawda pałka szerokolistna rośnie w Jerozolimie, ale sąd nad Jezusem odbyć się miał wiosną (marzec-kwiecień), a kwiatostany pałki rozwijają się w lipcu[96].
Przypisy
- ↑ Michael A. Ruggiero i inni, A Higher Level Classification of All Living Organisms, „PLOS One”, 10 (4), 2015, art. nr e0119248, DOI: 10.1371/journal.pone.0119248, PMID: 25923521, PMCID: PMC4418965 [dostęp 2020-02-20] (ang.).
- ↑ Peter F. Stevens, Angiosperm Phylogeny Website, Missouri Botanical Garden, 2001– [dostęp 2010-11-03] (ang.).
- ↑ The Plant List. [dostęp 2015-02-03].
- ↑ Typha latifolia, [w:] The IUCN Red List of Threatened Species (ang.).
- 1 2 3 4 Lucjan Rutkowski: Klucz do oznaczania roślin naczyniowych Polski niżowej. Warszawa: Wydawnictwo Naukowe PWN, 2014, s. 611. ISBN 978-83-01-14342-8.
- 1 2 3 4 Germplasm Resources Information Network (GRIN). [dostęp 2015-02-03].
- 1 2 3 4 Typha latifolia. [w:] Den Virtuella Floran [on-line]. Naturhistoriska riksmuseet. (Za: Hultén, E. & Fries, M. 1986. Atlas of North European vascular plants: north of the Tropic of Cancer I-III. – Koeltz Scientific Books, Königstein). [dostęp 2015-03-14].
- 1 2 3 4 5 6 7 8 9 Typha latifolia (broadleaf cattail). [w:] Invasive Species Compendium [on-line]. cabi.org. [dostęp 2015-03-16].
- ↑ Holm, L.; Doll, J.; Holm, E.; Pancho, J.; Herberger, J.: World weeds: natural histories and distribution. Madison: Department of Agronomy, University of Wisconsin, 1997. ISBN 0-471-04701-5.
- 1 2 3 4 Amber Olson, Jennifer Paul, Joanna R. Freeland. Habitat preferences of cattail species and hybrids (Typha spp.) in eastern Canada. „Aquatic Botany”. 91 (2), s. 67–70, sierpień 2009. DOI: 10.1016/j.aquabot.2009.02.003. (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 Zbigniew Podbielkowski, Henryk Tomaszewicz: Zarys hydrobotaniki. Warszawa: Państwowe Wydawnictwo Naukowe, 1979, s. 257–258, 374–375. ISBN 83-01-00566-1.
- ↑ Adam Zając, Maria (red.) Zając: Atlas rozmieszczenia roślin naczyniowych w Polsce. Kraków: Pracownia Chorologii Komputerowej Instytutu Botaniki Uniwersytetu Jagiellońskiego, 2001, s. 564. ISBN 83-915161-1-3.
- 1 2 Stanisław Bernatowicz, Paweł Wolny: Botanika rybacka. Warszawa: Państwowe Wydawnictwo Rolnicze i Leśne, 1969, s. 100.
- ↑ Stanisław Kłosowski, Grzegorz Kłosowski: Rośliny wodne i bagienne. Warszawa: Multico Oficyna Wydawnicza, 2007, seria: Flora Polski. ISBN 978-83-7073-248-6.
- 1 2 3 4 5 6 7 8 9 Typha latifolia Linnaeus. [w:] Flora of North America [on-line]. eFloras.org. [dostęp 2015-03-12].
- 1 2 3 Typha Linnaeus. [w:] Flora of North America [on-line]. eFloras.org. [dostęp 2015-03-07].
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Broadleaf Cattail. Utah State University. [dostęp 2015-03-25].
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 James B. Grace, Janet S. Harrison. The Biology of Canadian Weeds.: 73. Typha latifolia L., Typha angustifolia L. and Typha xglauca Godr.. „Canadian Journal of Plant Science”. 66, 2, s. 361–379, 1986. DOI: 10.4141/cjps86-051.
- 1 2 3 4 5 6 7 Michael G. Simpson: Plant Systematics. Amsterdam, Boston, London: Elsevier, 2010, s. 262. ISBN 978-0-12-374380-0.
- 1 2 3 J. Pazourek. The volumes of anatomical components in leaves of Typha angustifolia L. and Typha latifolia L. „Biologia Plantarum”. 19 (2), s. 129–135, marzec 1977. DOI: 10.1007/BF02926750. (ang.).
- 1 2 3 Typha latifolia Linnaeus. [w:] Flora of China [on-line]. eFloras.org. [dostęp 2015-03-12].
- 1 2 Władysław Szafer, Stanisław Kulczyński: Rośliny polskie. Warszawa: PWN, 1953.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 Corey L. Gucker: Typha latifolia. [w:] Fire Effects Information System (FEIS) [on-line]. U.S. Department of Agriculture, Forest Service, Rocky Mountain Research Station, Fire Sciences Laboratory. [dostęp 2015-03-25].
- 1 2 3 Katarzyna Kozłowska, Agnieszka Nobis, Marcin Nobis. Typha shuttleworthii (Typhaceae), new for Poland. „Polish Botanical Journal”. 56, 2, s. 299–305, 2011.
- ↑ Klaus Kubitzki, H. Huber: Flowering Plants. Monocotyledons: Alismatanae and Commelinanae (except Gramineae). Springer Science & Business Media, 1998, s. 457–459. ISBN 3-540-64061-4.
- 1 2 3 K. Fiala. Underground organs of Typha angustifolia and Typha latifolia, their growth, propagation and production. „Acta Scientiarum Naturalium Academiae Scientiarum Bohemoslovacae”, s. 1–44, 1978.
- ↑ K. Krattinger. Genetic mobility in Typha. „Aquatic Botany”. 1, s. 57–70, 1975. DOI: 10.1016/0304-3770(75)90007-8. ISSN 0304-3770. (ang.).
- 1 2 3 Typha latifolia (aquatic plant). [w:] The Global Invasive Species Database [on-line]. [dostęp 2015-03-25].
- 1 2 F.M. Muller: Seedlings of the North-Western European Lowland: A flora of seedlings. Wageningen: Centre for Agricultural Publishing and Documentation, 1978, s. 250.
- 1 2 H.A. Mcmanus. Epifluorescent and Histochemical Aspects of Shoot Anatomy of Typha latifolia L., Typha angustifolia L. and Typha glauca Godr. „Annals of Botany”. 90 (4), s. 489–493, 2002. DOI: 10.1093/aob/mcf211. ISSN 0305-7364. (ang.).
- ↑ John V. H. Constable, James B. Grace and David J. Longstreth. High Carbon Dioxide Concentrations in Aerenchyma of Typha latifolia. „American Journal of Botany”. 79 (4), s. 415–418, 1992. (ang.).
- 1 2 Anna Revedin, Biancamaria Aranguren, Roberto Becattini, Laura Longo, Emanuele Marconi, Marta Mariotti Lippi, Natalia Skakun, Andrey Sinitsyn, Elena Spiridonova, Jirí Svoboda. Thirty thousand-year-old evidence of plant food processing. „Proceedings of the National Academy of Sciences”. 44 (107), s. 18815–18819, 2010. National Academy of Sciences. DOI: 10.1073/pnas.1006993107. (ang.).
- ↑ Renata Nowińska, Barbara Gawrońska, Aneta Czarna, Małgorzata Wyrzykiewicz-Raszewska. Typha glauca Godron and its parental plants in Poland: taxonomic characteristics. „Hydrobiologia”. online, 2014-04-04. DOI: 10.1007/s10750-014-1862-0. (ang.).
- 1 2 Typha Cattail. [w:] The Jepson Herbarium [on-line]. University of California, Berkeley. [dostęp 2015-02-06]. (ang.).
- ↑ Agata Kurzawska, Danuta Górecka, Dorota Piasecka-Kwiatkowska, Krzysztof Dziedzic. Zawartość glutenu w kłączu pałki wodnej wąskolistnej (Typha angustifolia). „Żywność. Nauka. Technologia. Jakość”. 72 (5), s. 85–92, 2010. (pol.).
- ↑ The production ecology of wetlands. D.F. Westlake, J. Květ, A. Szczepański (red.). Cambridge: Cambridge University Press, 1998, s. 106, 111–112. ISBN 978-0-521-22822-0.
- ↑ G. Aliotta, M. Della Greca, P. Monaco, G. Pinto i inni. In vitro algal growth inhibition by phytotoxins ofTypha latifolia L. „Journal of Chemical Ecology”. 16 (9), s. 2637–2646, 1990. DOI: 10.1007/BF00988075. ISSN 0098-0331. (ang.).
- ↑ Marina Della Greca, Lorenzo Mangoni, Antonio Molinaro, Pietro Monaco i inni. (20S)-4α-methyl-24-methylenecholest-7-en-3β-ol, an allelopathic sterol from Typha latifolia☆. „Phytochemistry”. 29 (6), s. 1797–1798, 1990. DOI: 10.1016/0031-9422(90)85019-C. ISSN 0031-9422. (ang.).
- 1 2 Malene Bendix, Troels Tornbjerg, Hans Brix. Internal gas transport in Typha latifolia L. and Typha angustifolia L. 1. Humidity-induced pressurization and convective throughflow. „Aquatic Botany”. 49 (2–3), s. 75–89, 1994. DOI: 10.1016/0304-3770(94)90030-2. ISSN 0304-3770. (ang.).
- ↑ Troels Tornberg, Malene Bendix, Hans Brix. Internal gas transport in Typha latifolia L. and Typha angustifolia L. 2. Convective throughflow pathways and ecological significance. „Aquatic Botany”. 49 (2–3), s. 91–105, 1994. DOI: 10.1016/0304-3770(94)90031-0. ISSN 0304-3770. (ang.).
- ↑ H.B. Sifton. The germination of light-sensitive seeds of Typha latifolia L. „Canadian Journal of Botany”. 37 (4), s. 719–739, 1959. DOI: 10.1139/b59-057. ISSN 0008-4026. (ang.).
- ↑ V. Bonnewell, W.L. Koukkari, D.C. Pratt. Light, oxygen, and temperature requirements forTypha latifoliaseed germination. „Canadian Journal of Botany”. 61 (5), s. 1330–1336, 1983. DOI: 10.1139/b83-140. ISSN 0008-4026. (ang.).
- ↑ S.J. McNaughton, L.W. Fullem. Photosynthesis and Photorespiration in Typha latifolia. „Plant Physiology”. 45 (6), s. 703–707, 1970. DOI: 10.1104/pp.45.6.703. ISSN 0032-0889. (ang.).
- ↑ Gregory J. Taylor, A.A. Crowder. Copper and nickel tolerance in Typha latifolia clones from contaminated and uncontaminated environments. „Canadian Journal of Botany”. 62 (6), s. 1304–1308, 1984. DOI: 10.1139/b84-176. ISSN 0008-4026. (ang.).
- 1 2 Erika Fediuc, László Erdei. Physiological and biochemical aspects of cadmium toxicity and protective mechanisms induced in Phragmites australis and Typha latifolia. „Journal of Plant Physiology”. 159 (3), s. 265–271, 2002. DOI: 10.1078/0176-1617-00639. ISSN 0176-1617. (ang.).
- ↑ Gregory J. Taylor, A.A. Crowder. Uptake and accumulation of copper, nickel, and iron byTypha latifoliagrown in solution culture. „Canadian Journal of Botany”. 61 (7), s. 1825–1830, 1983. DOI: 10.1139/b83-193. ISSN 0008-4026. (ang.).
- ↑ Agnieszka Klink, Józef Krawczyk, Barbara Letachowicz, Magdalena Wisłocka. Some heavy metals accumulation and distribution in Typha latifolia L. from Lake Wielkie in Poland. „Archives of Environmental Protection”. 35 (3), s. 135–139, 2009. (ang.).
- ↑ James B. Grace. Effects of Water Depth on Typha latifolia and Typha domingensis. „American Journal of Botany”. 76, 5, s. 762–768, 1989.
- ↑ Dorthe N Jespersen, Brian K. Sorrell, Hans Brix. Growth and root oxygen release by Typha latifolia and its effects on sediment methanogenesis. „Aquatic Botany”. 61, 3, s. 165–180, 1998.
- ↑ James B. Grace, Robert G. Wetzel. Niche differentiation between two rhizomatous plant species: Typha latifolia and Typha angustifolia. „Canadian Journal of Botany”. 60 (1), s. 46–57, 1982. DOI: 10.1139/b82-007. ISSN 0008-4026. (ang.).
- ↑ Andrew McKenzie-Gopsill, Heather Kirk, Wendy Van Drunen, Joanna R. Freeland, Marcel E. Dorken. No evidence for niche segregation in a North American Cattail (Typha) species complex. „Ecology and Evolution”. 5 (2), s. 952–961, maj 2012. Wiley-Blackwell. DOI: 10.1002/ece3.225. ISSN 2045-7758. (ang.).
- ↑ Hanna Żelichowska: Remiz (Remiz pendulinus) [11]. [w:] Internetowy Atlas Ptaków [on-line]. [dostęp 2015-04-18].
- 1 2 3 4 Malcolm Storey: Typha latifolia L. (Bulrush, Greater Reedmace). [w:] BioInfo (UK) [on-line]. [dostęp 2015-03-31].
- ↑ Attributes of Simyra insularis. [w:] Butterflies and Moths of North America [on-line]. bamona. [dostęp 2015-04-02].
- ↑ Andrzej Piechocki: Mięczaki (Mollusca). Ślimaki (Gastropoda). T. 7: Fauna słodkowodna Polski. Warszawa; Poznań: Państwowe Wydawnictwo Naukowe, 1979, s. 160, 172. ISBN 83-01-01143-2.
- ↑ Dwayne L. Stenlund, Iris D. Charvat. Vesicular arbuscular mycorrhizae in floating wetland mat communities dominated by Typha. „Mycorrhiza”. 4 (3), s. 131–137, 1994. DOI: 10.1007/BF00203772. ISSN 0940-6360. (ang.).
- ↑ W. K. Cornwell, B. L. Bedford & C. T. Chapin. Occurrence of arbuscular mycorrhizal fungi in a phosphorus-poor wetland and mycorrhizal response to phosphorus fertilization. „American Journal of Botany”. 88 (10), s. 1824–1829, październik 2001. PMID: 21669616. (ang.).
- ↑ Ryan M. Dunham, Andrew M. Ray, Richard S. Inouye. Growth, physiology, and chemistry of mycorrhizal and nonmycorrhizalTypha latifolia seedlings. „Wetlands”. 23 (4), s. 890–896, 2003. DOI: [0890:GPACOM2.0.CO;2 10.1672/0277-5212(2003)023[0890:GPACOM]2.0.CO;2]. ISSN 0277-5212. (ang.).
- ↑ Andrew M. Ray, Richard S. Inouye. Effects of water-level fluctuations on the arbuscular mycorrhizal colonization of Typha latifolia L. „Aquatic Botany”. 84 (3), s. 210–216, 2006. DOI: 10.1016/j.aquabot.2005.10.005. ISSN 0304-3770. (ang.).
- ↑ Krystian Obolewski. Organizmy poroślowe (perifiton) zasiedlające wiosną trzcinę Phragmites australis i pałkę Typha latifolia w jeziorze Raduńskie Dolne – badania wstępne. „Słupskie Prace Biologiczne”. 2, s. 37–48, 2005.
- ↑ Beata Messyasz, Natalia Kuczyńska-Kippen, Barbara Nagengast. The epiphytic communities of various ecological types of aquatic vegetation of five pastoral ponds. „Biologia”. 64, 1, s. 88–96, 2009. DOI: 10.2478/s11756-008-0006-x.
- ↑ Hatice Tunca, Tuğba Ongun Sevindik, Dilek Bal, Sevil Arabaci. Community structure of epiphytic algae on three different macrophytes at Acarlar floodplain forest (northern Turkey). „Chinese Journal of Oceanology and Limnology”. 32, 4, s. 845–857, 2014.
- ↑ Władysław Matuszkiewicz: Przewodnik do oznaczania zbiorowisk roślinnych Polski. Warszawa: PWN, 2006.
- ↑ Changkyun Kim, Hong-Keun Choi. Molecular systematics and character evolution of Typha (Typhaceae) inferred from nuclear and plastid DNA sequence data. „Taxon”. 60, 5, s. 1417–1428, 2011.
- 1 2 Zbigniew Mirek i inni, Vascular plants of Poland. An annotated checklist, Kraków: W. Szafer Institute of Botany, Polish Academy of Sciences, 2020, s. 197, ISBN 978-83-62975-45-7.
- 1 2 Beata Grabowska, Tomasz Kubala: Rośliny wodne i wilgociolubne. Kraków: Officina Botanica, 2006, s. 75. ISBN 83-922115-5-3.
- 1 2 Hubert Zientek: Rośliny w oczkach wodnych. Warszawa: Medical Tribune Polska, 2008, s. 144–145. ISBN 978-83-60135-40-2.
- 1 2 Ireneusz R. Moraczewski, Barbara Sudnik-Wójcikowska, Bożena Dubielecka, Lucjan Rutkowski, Kazimierz A. Nowak, Wojciech Borkowski, Halina Galera: Flora ojczysta – gatunki pospolite, chronione, ciekawe... (CD-ROM: Atlas roślin, słownik botaniczny i multimedialne klucze do oznaczania). Warszawa: Wydawnictwo Stigma, 2000. (pol.).
- 1 2 3 4 Daniel F. Austin. Sacred Connections with Cat-tail (Typha, Typhaceae) – Dragons, water-serpents and reed-maces. „Ethnobotany Research and Applications”. 5, 2007. Botanical Research Institute of Texas.
- ↑ Marian Rejewski: Pochodzenie łacińskich nazw roślin polskich. Warszawa: 1996. ISBN 83-05-12868-7.
- 1 2 Krzysztof Kluk: Dykcyonarz roślinny. T. III. Warszawa: 1811, s. 142.
- 1 2 3 4 5 Łukasz Łuczaj: Dzikie rośliny jadalne Polski. Krosno: Chemigrafia, 2004. ISBN 83-904633-6-9.
- ↑ Marion K. Bamford, Rosa M. Albert, Dan Cabanes. Plio–Pleistocene macroplant fossil remains and phytoliths from Lowermost Bed II in the eastern palaeolake margin of Olduvai Gorge, Tanzania. „Quaternary International”. 1 (148), s. 95–112, maj 2006. DOI: 10.1016/j.quaint.2005.11.027.
- 1 2 3 4 5 6 Cattail (Bullrush) Typha latifolia. [w:] Edible Wild Food [on-line]. EdibleWildFood.com. [dostęp 2015-04-02].
- 1 2 3 Zbigniew Podbielkowski: Słownik roślin użytkowych. Warszawa: PWRiL, 1989. ISBN 83-09-00256-4.
- ↑ Chang Kwang-chih: Food in Chinese culture: anthropological and historical perspective. New Haven: Yale University Press, 1977, s. 28. ISBN 0-300-01938-6.
- ↑ Geoffrey Burnie i inni, Botanica. Ilustrowana, w alfabetycznym układzie, opisuje ponad 10 000 roślin ogrodowych, Niemcy: Könemann, Tandem Verlag GmbH, 2005, ISBN 3-8331-1916-0, OCLC 271991134.
- 1 2 Joanna Ostapkowicz, D. Lepofsky, R. Schulting, A. McHalsie. The Use of Cattail (Typha latifolia L.) down as a Sacred Substance by the Interior and Coast Salish. „Journal of Ethnobiology”. 21, 2, s. 77–90, 2001.
- 1 2 3 4 5 Kari Black: Cattails: The Super Mall of Nature. [w:] Ebb and Flood. The Newsletter of WSU Beach Watchers of Skagit & Snohomish Counties [on-line]. Washington State University, 2008. [dostęp 2015-04-02]. [zarchiwizowane z tego adresu (2016-03-11)].
- ↑ Jerry Coleman, Keith Hench, Keith Garbutt, Alan Sexstone i inni. „Water, Air, and Soil Pollution”. 128 (3/4), s. 283–295, 2001. DOI: 10.1023/A:1010336703606. ISSN 0049-6979. (ang.).
- 1 2 M.P. Ciria, M.L. Solano, P. Soriano. Role of Macrophyte Typha latifolia in a Constructed Wetland for Wastewater Treatment and Assessment of Its Potential as a Biomass Fuel. „Biosystems Engineering”. 92, 4, s. 535–544, 2005.
- ↑ Manios T, Stentiford EI, Millner P. Removal of heavy metals from a metaliferous water solution by Typha latifolia plants and sewage sludge compost. „Chemosphere”. 53 (5), s. 487–494, 2003. DOI: 10.1016/S0045-6535(03)00537-X. PMID: 12948532. (ang.).
- ↑ X. Water Purification. W: E. C. S. Little: Handbook of utilization of aquatic plants. Rzym: Food and Agriculture Organization of the United Nations, 1979, s. 130, seria: FAO Fisheries Technical Paper. ISBN 92-5-100825-6.
- ↑ Lyubenova L, Schröder P. Plants for waste water treatment--effects of heavy metals on the detoxification system of Typha latifolia. „Bioresour Technol”. 102 (2), s. 996–1004, 2011. DOI: 10.1016/j.biortech.2010.09.072. PMID: 20951580. (ang.).
- ↑ Calheiros CS, Rangel AO, Castro PM. Treatment of industrial wastewater with two-stage constructed wetlands planted with Typha latifolia and Phragmites australis. „Bioresource Technology”. 100 (13), s. 3205–3213, 2009. DOI: 10.1016/j.biortech.2009.02.017. PMID: 19289277. (ang.).
- ↑ S. M. Haslam: River Plants of Western Europe: The Macrophytic Vegetation of Watercourses of the European Economic Community. CUP Archive, 1987, s. 466. ISBN 0-521-26427-8.
- ↑ Bartha B, Huber C, Schröder P. Uptake and metabolism of diclofenac in Typha latifolia--how plants cope with human pharmaceutical pollution. „Plant Sci”. 227, s. 12–20, 2014. DOI: 10.1016/j.plantsci.2014.06.001. PMID: 25219301. (ang.).
- ↑ Moore MT, Tyler HL, Locke MA. Aqueous pesticide mitigation efficiency of Typha latifolia (L.), Leersia oryzoides (L.) Sw., and Sparganium americanum Nutt. „Chemosphere”. 92 (10), s. 1307–1313, 2013. DOI: 10.1016/j.chemosphere.2013.04.099. PMID: 23732006. (ang.).
- ↑ Cristina S.C. Calheiros, António O.S.S. Rangel, Paula M.L. Castro. Evaluation of different substrates to support the growth of Typha latifolia in constructed wetlands treating tannery wastewater over long-term operation. „Bioresource Technology”. 99 (15), s. 6866–6877, październik 2008. DOI: 10.1016/j.biortech.2008.01.043. (ang.).
- ↑ Metoda oceny i klasyfikacji rzek na podstawie makrofitów. W: Krzysztof Szoszkiewicz, Janina Zbierska, Szymon Jusik, Tomasz Zgoła: Makrofitowa Metoda Oceny Rzek: Podręcznik metodyczny do oceny i klasyfikacji stanu ekologicznego wód płynących w oparciu o rośliny wodne. Poznań: Bogucki Wydawnictwo Naukowe, 2010, s. 60–68. (pol.).
- ↑ J. Motyka, T. Panycz: Rośliny lecznicze i przemysłowe w Polsce. Lwów - Warszawa: Książnica Atlas, 1936, s. 69.
- ↑ Adam Paluch: Świat roślin w tradycyjnych praktykach wsi polskiej. Wrocław: Wydawnictwo Uniwersytetu Wrocławskiego, 1984, s. 146, seria: Acta Wratislaviensis 752.
- ↑ Gescher K, Deters AM. Typha latifolia L. fruit polysaccharides induce the differentiation and stimulate the proliferation of human keratinocytes in vitro. „J Ethnopharmacol”. 137 (1), s. 352–358, 2011. DOI: 10.1016/j.jep.2011.05.042. PMID: 21669276. (ang.).
- 1 2 3 Stefan Buczacki: Best Water Plants. London: Hamlyn, 1995, s. 34–35. ISBN 0-600-58337-6.
- ↑ Symbolism of heraldic elements. Fleur-de-lis Designs. [dostęp 2015-04-02].
- 1 2 Zofia Włodarczyk: Rośliny biblijne. Leksykon. Kraków: Instytut Botaniki im. W. Szafera PAN, 2011. ISBN 978-83-89648-98-3.
Linki zewnętrzne
- Typha latifolia. [w:] Den Virtuella Floran [on-line]. Naturhistoriska riksmuseet. (Za: Hultén, E. & Fries, M. 1986. Atlas of North European vascular plants: north of the Tropic of Cancer I-III. – Koeltz Scientific Books, Königstein). [dostęp 2015-03-14]. – mapa zasięgu na półkuli północnej
- BioLib: 42812
- EoL: 526590
- EUNIS: 194041
- Flora of China: 220013917
- Flora of North America: 220013917
- FloraWeb: 6127
- GBIF: 5289423
- identyfikator iNaturalist: 48685
- IPNI: 836870-1
- ITIS: 42326
- NCBI: 4733
- Plant Finder: 287387
- identyfikator Plant List (Royal Botanic Gardens, Kew): kew-271005
- Plants of the World: urn:lsid:ipni.org:names:836870-1
- Tela Botanica: 70154
- identyfikator Tropicos: 33200002
- USDA PLANTS: TYLA