Dieta niskowęglowodanowa – dieta zakładająca znaczne ograniczenie spożycia węglowodanów, z reguły do maksymalnie 130 g na dobę. Produkty spożywcze bogate w węglowodany (głównie pieczywo, makarony, ziemniaki, inne produkty zbożowe) zastępowane są produktami bogatymi w tłuszcz lub białko (m.in. mięso, ryby, jaja, sery). Dieta niskowęglowodanowa zaleca też spożywanie warzyw i owoców z niską zawartością węglowodanów (np. sałaty, brokuły, ogórki, szpinak, maliny, orzechy).
Dieta ta jest stosowana w leczeniu otyłości, a także wykazano jej dodatni wpływ na powodzenie terapii u dzieci chorych na epilepsję[1][2][3]. Modyfikowane diety niskowęglowodanowe (niska zawartość zarówno węglowodanów, jak i tłuszczów) są zalecane u osób chorych na cukrzycę typu 2[4][5].
Historia
Prehistoria
Dieta człowieka żyjącego przed rewolucją neolityczną, tzn. przed wynalezieniem rolnictwa, składała się głównie z mięsa, ryb, warzyw zielonych, orzechów oraz owadów w różnych proporcjach[6][7]. Jedna z analiz antropologicznych plemion zbieracko-łowieckich żyjących współcześnie wykazała, że w ich diecie występuje zarówno białko (19–35% całkowitej dostarczanej energii) jak i węglowodany (22–40% całkowitej dostarczanej energii)[8].
Pierwsze wzmianki współczesne
Dieta niskowęglowodanowa była stosowana jako metoda leczenia cukrzycy w XIX wieku[9][10].
W 1863 roku William Banting opublikował pracę zatytułowaną Letter on Corpulence Addressed to Public, w której opisuje dietę odchudzającą zakładającą rezygnację ze spożywania pieczywa, masła, mleka, cukru, piwa oraz ziemniaków[11]. Jest to pierwszy opis diety niskowęglowodanowej. Banting twierdził, że stosując tę dietę, nigdy nie był głodny[12].
W 1967 roku wydana została praca The Doctor’s Quick Weight Loss Diet autorstwa lekarza Irwina Stillmana opisująca dietę składającą się z niskiej zawartości węglowodanów i tłuszczów, a wysokiej zawartości białek. Dieta Stillmana uważana jest za pierwszą dietę niskowęglowodanową, która zdobyła znaczną popularność w Stanach Zjednoczonych[13].
W 1972 roku dr Robert Atkins wydał książkę Dr Atkins’ Diet Revolution, w której opisywał skuteczność diety niskowęglowodanowej, opierając się na doświadczeniach leczenia otyłości u swoich pacjentów w latach 60. Książka szybko zdobyła popularność, jednak spotkała się z miażdżącą krytyką środowisk medycznych[14]. Dieta opisywana przez Atkinsa uznana została za błędną i niebezpieczną, ponieważ ówczesny stan wiedzy medycznej wskazywał, że zwiększone spożycie tłuszczów powoduje liczne zagrożenia zdrowotne[15].
W 1979 roku Jan Kwaśniewski opublikował założenia własnej diety niskowęglowodanowej, nazwanej "optymalnym żywieniem" (sam twierdził, że opracował ją w 1965 roku), której zalecane proporcje spożywanych ilości białka, tłuszczów i węglowodanów odpowiadają założeniom diety niskowęglowodanowej.
Lata 90. XX w. i XXI w.
Dieta niskowęglowodanowa wciąż jest powodem kontrowersji w środowiskach medycznych. Szybko powiększa się ilość dostępnych wyników badań wpływu diety niskowęglowodanowej na zdrowie człowieka[16][17][18]. Głównym zarzutem wysuwanym przeciw diecie jest brak informacji na temat jej długofalowego wpływu na organizm. Niemniej, badania takie zaczynają się pojawiać[16].
Założenia diety
Termin dieta niskowęglowodanowa kojarzony jest najczęściej z dietą Atkinsa lub, w Polsce, z dietą Kwaśniewskiego[20]. Niemniej jednak istnieje szereg zróżnicowanych diet niskowęglowodanowych opierających się na tych samych podstawach, m.in. dieta Atkinsa, dieta proteinowa Dukana, cykliczna dieta ketogeniczna, dieta The Zone, dieta OleoKeto, dieta dr Budwig, metoda Montignaca, dieta South Beach, dieta optymalna, dieta dobrych produktów. Brak jest powszechnie zaakceptowanej definicji diety niskowęglowodanowej. Amerykańskie Stowarzyszenie Lekarzy Rodzinnych definiuje dietę niskowęglowodanową jako dietę, w której spożycie węglowodanów nie przekracza 60 g dziennie[21]. W 2008 roku grupa badaczy specjalizujących się w badaniach diet niskowęglowodanowych zaproponowała następujący podział[22]:
- Niskowęglowodanowa dieta ketogeniczna (LCKD, low-carb ketogenic diet): poniżej 50 g węglowodanów dziennie, węglowodany to mniej niż 10% całkowitych przyjmowanych kalorii
- Dieta niskowęglowodanowa (LCD, low-carb diet): 50–130 g węglowodanów, 10–26% kalorii
- Dieta średniowęglowodanowa (MCD, moderate-carb diet): 130–225 g węglowodanów, 26–45% kalorii
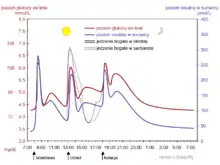
Fundamentem naukowym, na którym opiera się dieta niskowęglowodanowa, jest wiedza dotycząca wpływu spożywania węglowodanów na stężenie glukozy we krwi oraz związaną z tym produkcją hormonów przez organizm. Normalny poziom stężenia glukozy we krwi u człowieka zawiera się w granicach 4,5-5,5 mmol/l[23]. Poziom ten rośnie po spożyciu posiłku bogatego w węglowodany[19]. Stężenie glukozy we krwi kontrolowane jest głównie przez dwa hormony produkowane w trzustce: insulinę, która obniża stężenie glukozy we krwi oraz glukagon, który wykazuje działanie antagonistyczne w stosunku do insuliny[24]. Typowe dania w cywilizacji zachodniej są bogate w węglowodany, dlatego praktycznie każdy posiłek wiąże się z wydzielaniem insuliny. Dla kontrastu celem diety niskowęglowodanowej jest minimalizacja wydzielania insuliny na korzyść glukagonu[25], który stymuluje lipolizę i glukoneogenezę[26].
Dodatkowo, diety bardzo ubogie w węglowodany (poniżej 50 g węglowodanów dziennie) nazywane są ketogenicznymi, ponieważ wskutek wyczerpywania zapasów glikogenu w wątrobie indukują stan nazywany ketozą[25], czyli akumulacją ciał ketonowych w organizmie[27]. Ciała ketonowe są alternatywnym produktem utleniania wolnych kwasów tłuszczowych w wątrobie i mogą być wykorzystywane jako materiał energetyczny przez mózg, serce i inne tkanki[28]. Ich nadmiar wydalany jest w oddechu, przez skórę oraz w moczu. Ketoza często mylona jest z kwasicą ketonową. U osoby niecierpiącej na cukrzycę ketogeneza (proces produkcji ciał ketonowych) ustaje w momencie pojawienia się glukozy w organizmie, natomiast u cukrzyków stwierdza się jednoczesną obecność zarówno glukozy, jak i ciał ketonowych.
Założenia dietetyczne
By skutecznie ograniczyć ilość spożywanych węglowodanów, dieta niskowęglowodanowa zaleca całkowitą rezygnację z produktów skrobiowych lub zawierających cukier. Stosunek ilości kalorii pozyskiwanych z tłuszczu, białka i węglowodanów waha się w zależności od specyficznej odmiany diety, jednak jako dobry przykład można uznać stosunek 60% kalorii uzyskiwanych z tłuszczu, 35% z białka i 5% z węglowodanów. Odpowiada to mniej więcej 100 g tłuszczu, 100 g białka i 20 g węglowodanów. Większość diet niskowęglowodanowych nie nakłada restrykcji na całkowitą dzienną ilość spożywanych kalorii. Wynika to z jednej z właściwości ketozy – zwiększania uczucia sytości, co powoduje naturalne ograniczanie ilości spożywanych posiłków dziennie, a co za tym idzie – do ograniczenia ilości przyjmowanych kalorii w porównaniu z dietami wysokowęglowodanowymi[29]. Nowoczesne diety niskowęglowodanowe zalecają także spożywanie do każdego posiłku warzyw o niskiej zawartości węglowodanów oraz niskim indeksie glikemicznym – ma to na celu dostarczenie organizmowi odpowiedniej ilości błonnika.
Ogólne zestawienie produktów żywnościowych
| Produkty zalecane | |
|---|---|
| Produkty niezalecane (należy spożywać w bardzo ograniczonej ilości) | |
| Produkty zabronione |
|
Przykładowy dzienny plan posiłków

- Śniadanie: jajecznica z dwóch jaj na boczku i smażonymi słupkami z zielonej papryki
- składniki: jaja kurze (110 g), boczek wieprzowy (15 g), smalec (10 g), papryka zielona (120 g)
- wartości odżywcze: białko: ~ 15 g, tłuszcze: ~ 28 g, węglowodany: ~ 3 g
- Obiad: polędwiczki wieprzowe w sosie holenderskim z purée z kalafiora w maśle i świeżym szpinakiem
- składniki: schab wieprzowy (150 g), masło (50 g), żółtko jaja kurzego (35 g), sok cytrynowy (10 g), kalafior (200 g), szpinak (80 g)
- wartości odżywcze: białko: ~ 32 g, tłuszcze: ~ 62 g, węglowodany: ~ 5 g
- Kolacja: Sałata z tuńczykiem, serem mozzarella, warzywami, zieleniną i majonezem
- składniki: sałata (100 g), nać pietruszki (15 g), ogórek (60 g), ser mozzarella (30 g), tuńczyk (140 g), pomidory (60 g), majonez (25 g)
- wartości odżywcze: białko: ~ 40 g, tłuszcze: ~ 28 g, węglowodany: ~ 5 g
Łącznie: białko ~ 87 g, tłuszcze ~ 117 g, węglowodany ~ 13 g, ~ 1442 kcal
Wpływ na zdrowie
Wpływ diet niskowęglowodanowych na zdrowie pozostaje przedmiotem debaty w środowisku naukowym, głównie ze względu na stosunkowo niewielką ilość badań dotyczących tego tematu[30]. Zdecydowana większość z nich została opublikowana po roku 2000 i jako relatywnie młode pozostają przedmiotem dyskusji. Badacze w swoich publikacjach przedstawiają zróżnicowane opinie, poczynając od promowania skuteczności i bezpieczeństwa tych diet[16][31] a kończąc na potępianiu ich jako niebezpieczne[32]. Jednym z głównych zarzutów jest brak badań dotyczących długofalowych efektów diet niskowęglowodanowych, jednak ostatnio zaczyna się to zmieniać[16][17][33][34][35]. Stwierdzono, że zarówno wysoki (>70%) jak niski (<40%) udział węglowodanów w diecie jest związany ze zwiększeniem ryzyka przedwczesnego zgonu. Najmniejsze ryzyko obserwowano dla udziału węglowodanów między 50% a 55%[36].
Utrata tkanki tłuszczowej oraz wpływ na LDL i HDL
Liczne badania, w tym randomizowane eksperymenty kliniczne, wykazują większą skuteczność diet niskowęglowodanowych w procesie odchudzania w porównaniu z dietami niskotłuszczowymi. Pacjenci stosujący dietę niskowęglowodanową osiągali lepsze wyniki dotyczące utraty wagi, poprawy poziomu HDL i trójglicerydów oraz ciśnienia krwi. Do najczęściej wymienianych atutów tej diety zalicza się ograniczenie łaknienia i brak uczucia głodu, za co odpowiada podaż wysokoenergetycznych potraw opartych na tłuszczach, z których tworzone są ciała ketonowe. Mózg żywiąc się nimi w toku diety, generuje uczucie sytości, co sprzyja przestrzeganiu diety[37]. Ograniczony asortyment produktów prowadzi z kolei do spontanicznej redukcji spożycia żywności[38]. Astrup i wsp. podkreślają także, że paradoks konsumpcji produktów wysokotłuszczowych – prowadzącej do redukcji masy ciała – może polegać również na tym, że bardzo restrykcyjne ograniczenie spożycia węglowodanów prawdopodobnie skutkuje wyczerpaniem rezerw glikogenu w wątrobie, generując wydalanie wody związanej[39].
W dietach niskowęglowodanowych zarówno podaż tłuszczu ogółem, jak również profil kwasów tłuszczowych stanowią ważne elementy w dietoterapii otyłości. W badaniach na zwierzętach wykazano, że nasycone kwasy tłuszczowe są preferencyjnie odkładane w tkance tłuszczowej, podczas gdy wielonienasycone raczej utleniane. Szczególną rolę pełnią kwasy tłuszczowe jednonienasycone, które, jak wykazano, mogą wpływać na wielkość wydatków energetycznych, tempo utleniania kwasów tłuszczowych oraz wielkość komórek tłuszczowych[40].
| Autorzy | Rok publikacji | Profil badanej grupy | Czas trwania | Dieta | CHO
[g/d] |
Masa ciała
[%] |
HDL
[%] |
TAG
[%] |
TAG/HDL
[%] |
Glukoza
[%] |
Insulina
[%] |
Ciśnienie krwi
[mm Hg] |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sharman et al.[42] | 2002 | Mężczyźni bez nadwagi | 6 tyg. | NW | 46 | −2,8 | 11,5 | −33,0 | −39,9 | −0,2 | −34,2 | |
| NT | 271 | 0,5 | 0,0 | −5,3 | −5,3 | 1,8 | 13,0 | |||||
| Brehm et al.[43] | 2003 | Otyłe kobiety | 6 msc | NW | 41–97 | −9,3 | 13,4 | −23,4 | −32,4 | −9,1 | −14,8 | −5 |
| NT | 163–169 | −4,2 | 8,4 | 1,6 | −6,3 | −4,0 | −23,0 | −1 | ||||
| Sondike et al.[44] | 2003 | Nastolatkowie z nadwagą | 12 tyg. | NW | 37 | −10,7 | 8,7 | −40,5 | −45,2 | |||
| NT | 154 | −4,1 | 4,2 | −5,4 | −9,2 | |||||||
| Samaha et al.[45] | 2003 | Otyli mężczyźni/kobiety | 6 msc. | NW | 150 | −4,5 | 0,0 | −20,2 | −20,2 | −8,6 | −27,3 | |
| NT | 201 | −1,4 | −2,4 | −4 | −1,6 | −1,6 | 5,6 | |||||
| Foster et al.[46] | 2003 | Otyli mężczyźni/kobiety | 1 rok | NW | −7,3 | 18,2 | −28,1 | −29,5 | ||||
| NT | −4,5 | 1,4 | 0,7 | −2,6 | ||||||||
| Volek et al.[47] | 2003 | Kobiety bez nadwagi | 4 tyg. | NW | 43 | −2,0 | 32,0 | −30,2 | −47,2 | −1,9 | 11,6 | |
| NT | 249 | −1,3 | −7,7 | 3,8 | 0,5 | −5,3 | 18,7 | |||||
| Allick et al.[48] | 2004 | Cukrzycy typu 2 | 2 tyg. | NW | 0 | 0 | 23,5 | −43,9 | −55 | −16,9 | −16,7 | |
| NT | 775 | |||||||||||
| Sharman et al.[49] | 2004 | Mężczyźni z nadwagą | 6 tyg. | NW | 36 | −5,6 | −3,3 | −44,1 | −42,3 | −5,8 | −41,5 | |
| NT | 224 | −3,6 | −6,6 | −15 | −8,3 | −5,2 | −28,1 | |||||
| Brehm et al.[50] | 2004 | Otyłe kobiety | 4 msc. | NW | 69 | −10,8 | 16,3 | −37,3 | −46,1 | −9 | ||
| NT | 174 | −6,8 | 4,5 | −10,3 | −14,2 | −3 | ||||||
| Meckling et al.[51] | 2004 | Otyli mężczyźni/kobiety | 10 tyg. | NW | 59 | −7,7 | 12,2 | −29,4 | −37,1 | −8,0 | −28,7 | −6,1 |
| NT | 225 | −7,4 | −15,4 | −25,4 | −11,8 | −10,2 | −3,3 | −5 | ||||
| Stern et al.[31] | 2004 | Otyli mężczyźni/kobiety | 1 rok | NW | 120 | −3,9 | −2,8 | −28,6 | −26,8 | |||
| NT | 230 | −2,3 | −12,3 | 2,7 | 29,6 | |||||||
| Yancy et al.[52] | 2004 | Otyli mężczyźni/kobiety | 24 tyg. | NW | 30 | −12,3 | 9,8 | −47,2 | −51,8 | −6 | ||
| NT | 198 | −6,7 | −2,9 | −14,4 | −12,1 | −5,2 | ||||||
| Aude et al.[53] | 2004 | Otyli mężczyźni/kobiety | 12 tyg. | NW | −6,2 | −2,6 | −23,2 | −21,1 | ||||
| NT | −3,4 | −7 | −10,5 | −3,8 | ||||||||
| McAuley et al.[54] | 2004 | Otyłe kobiety | 8 tyg. | NW | 41 | −6,9 | 0,9 | −38,8 | −44,2 | −5,9 | −39,3 | |
| NT | 172 | −4,4 | −6 | −17,5 | −15,1 | −0,1 | −28,4 | |||||
| Dansinger et al.[55] | 2005 | Otyli mężczyźni/kobiety | 2 msc. | NW | 103 | −4,7 | 8,8 | −27,6 | −26,20 | −10 | −29,5 | |
| NT | 183 | −4,3 | −0,6 | −7,1 | −5,60 | −5,7 | −11 | |||||
| UltraNT | 230 | −4,9 | −10,9 | −0,6 | 8,40 | −3,5 | −7,7 |
Legenda: NW – dieta niskowęglowodanowa; NT – dieta niskotłuszczowa; CHO – ilość spożywanych węglowodanów dziennie.
W 2009 roku Hession i współpr. dokonali metaanalizy wyników randomizowanych prób klinicznych porównujących skuteczność diet niskowęglowodanowych i niskotłuszczowych, opublikowanych od stycznia 2001 do marca 2007 roku, trwających przynajmniej 6 miesięcy. Metaanaliza wykazała korzystny wpływ diety niskowęglowodanowej w aspekcie utraty wagi ciału u osób z nadwagą i otyłych (korzystniejszy niż diety niskotłuszczowej), równocześnie wykazano wzrost ryzyka chorób układu krążenia (jednak mniejszy niż w przypadku diet niskotłuszczowych)[18].
Dodatkowo badania wskazują przewagę diet niskowęglowodanowych nad niskotłuszczowymi w aspekcie utraty tkanki tłuszczowej w stosunku do tkanki mięśniowej podczas odchudzania. Young et al. porównali trzy diety izoenergetyczne (każda dostarczała 7,5 MJ energii / dzień) i izoproteinowe (każda dostarczała 115 g białka / dzień), różniące się ilością dostarczanych węglowodanów (odpowiednio 30 g, 60 g, 104 g / dzień). Po 9 tygodniach stosowania diet stosunek utraty tkanki tłuszczowej w stosunku do całkowitej utraty masy ciała wynosił 95%, 84% i 75%[56]. Inne badania potwierdzają te wyniki[57][58][59].
Choroby układu krążenia
W związku z dużym spożyciem nasyconych kwasów tłuszczowych na dietach niskowęglowodanowych, wielu krytyków wskazuje, że zwiększa to ryzyko chorób krążenia[15]. Zarzuty te nie znajdują poparcia w wynikach badań. Nurses’ Health Study, badanie kohortowe obserwujące ponad 115 000 osób przez kilkadziesiąt lat wykazało, że stosowanie diet niskowęglowodanowych, gdzie głównym źródłem energii są tłuszcze i białka pochodzenia roślinnego narażone są na mniejsze ryzyko rozwoju chorób krążenia[17]. To samo badanie wykazało brak korelacji pomiędzy przyjmowaniem tłuszczów pochodzenia zwierzęcego a zwiększonym ryzykiem choroby niedokrwiennej serca.
Na ponad 25 badań skupiających się na związkach pomiędzy chorobami serca a spożyciem nasyconych kwasów tłuszczowych, jedynie cztery z nich wskazały jakąkolwiek korelację. Brak powiązań pomiędzy chorobami serca a spożyciem nasyconych kwasów tłuszczowych potwierdziła metaanaliza dostępnych publikacji dotyczących tej tematyki przeprowadzona w 2010 roku[60].
Wpływ na pracę mózgu
Jako że uważa się, że glukoza jest preferowanym źródłem energii dla mózgu[61], wpływ wykorzystywania ciał ketonowych przez mózg podczas ketozy pozostaje przedmiotem debaty. Komórki mózgu, w czasie głodu i ograniczenia podaży węglowodanów, mogą uzyskać energię z metabolizmu ciał ketonowych (β-hydroksymaślanu i acetyloacetonu). W przeciwieństwie do glukozy, ciała ketonowe są bezpośrednio wprowadzane do cyklu Krebsa, w postaci acetylo-CoA, z pominięciem procesu glikolizy[62]. Badania na szczurach wykazały brak różnic w pH oraz zawartości wody i elektrolitów w mózgach szczurów w stanie ketozy w stosunku do grupy kontrolnej. Co więcej, u szczurów będących w stanie ketozy zaobserwowano zwiększenie stosunku ATP/ADP, co jest zjawiskiem korzystnym[63].
Wskazywane są też potencjalne zalety diety ketogenicznej w terapii choroby Alzheimera. Jednym z czynników przyczyniających się do rozwoju choroby Alzheimera jest niski poziom beta-amyloidów związany z dysfunkcją glikolizy w pewnych obszarach mózgu. Wykazano, że ketoza podnosi poziom beta-amyloidów[64]. Prowadzone są również badania nad wpływem ciał ketonowych na ośrodkowy układ nerwowy w przebiegu choroby Parkinsona. W patogenezie tej jednostki chorobowej bierze się pod uwagę upośledzenie funkcjonowania mitochondriów. Związane jest ono z zaburzeniem funkcji kompleksu dehydrogenazy pirogronianowej[65] i starzeniem się układów chroniących przed wolnymi rodnikami tlenowymi. Uważa się, że zmniejszony poziom Cu/Zn dysmutazy nadlenkowej (SOD- 1)[66] jest ważnym czynnikiem zmniejszającym ilość neuronów dopaminergicznych w istocie czarnej mózgu[67]. Wykazano, że ß-hydroksymaślan zwiększa in vitro przeżywalność komórek bogatych w dopaminę po ich uszkodzeniu neurotoksyną MPP+ w śródmózgowiu[68]. Podobne rezultaty uzyskano in vivo u myszy. Dodatkowo wykazano u nich polepszenie zdolności motorycznych oraz zwiększenie ilości dopaminy w śródmózgowiu[69].
Terapia cukrzycy typu 2
Istnieją badania potwierdzające pozytywny wpływ diety ketogenicznej na leczenie cukrzycy typu 2[51][70]. W jednym z badań skuteczność okazała się na tyle duża, że pozwoliła u większości pacjentów wyeliminować lub zredukować leczenie farmakologiczne[71]. Stężenie glukozy we krwi zależy od ilości spożytych węglowodanów (w gramach), jak i ich rodzaju. Monitorowanie całkowitej zawartości węglowodanów w diecie ma zasadnicze znaczenie dla osiągnięcia optymalnej kontroli glikemii. W toku badań Ajala i wsp. wykazano, że dieta niskowęglowodanowa, z niskim indeksem glikemicznym, śródziemnomorska i wysokobiałkowa prowadziły do poprawy kontroli glikemii (redukcja poziomu hemoglobiny glikowanej o 0,12%, 0,14%, 0,47%, 0,28%, odpowiednio) w porównaniu do diet kontrolnych[72]. Dieta niskowęglowodanowa i śródziemnomorska dały też najlepsze wyniki w sferze odchudzania cukrzyków – prowadziły do spadku masy ciała o 0,69 kg i 1,84 kg. Jak wynika z danych metaanalizy dieta niskowęglowodanowa, a także z niskim indeksem glikemicznym, śródziemnomorska i wysokobiałkowa korzystnie wpływały na redukcję ryzyka sercowo-naczyniowego u chorych na cukrzycę i powinny być uwzględniane w profilaktyce i leczeniu cukrzycy[72].
Wpływ na nowotwory
Modyfikacje żywieniowe u pacjentów onkologicznych – zakładające wprowadzenie niskowęglowodanowej diety ketogenicznej – przestawiają organizm z metabolizmu węglowodanów na metabolizm tłuszczy. Głównym źródłem energii stają się wówczas nie cukry, ale ciała ketonowe powstałe z rozkładu tłuszczów. Udowodniono, że komórki nowotworowe – w przeciwieństwie do zdrowych komórek – nie są zdolne do takiej zmiany metabolicznej i żywią się wyłącznie monosacharydami[73]. Wprowadzenie organizmu w stan ketozy i pozbawienie komórek nowotworowych źródła energii przez drastyczne obniżenie podaży węglowodanów może powodować spowolnienie toczących się w organizmie procesów chorobowych – zahamowanie tempa wzrostu komórek nowotworowych i ich obumieranie[73]. Wpływ niskowęglowodanowej diety ketogenicznej na nowotwory jest obecnie przedmiotem wielu badań[74][75]. Wykazano teraupeutyczny wpływ takiej diety na nowotwory mózgu u myszy i ludzi[76][77]. Istnieją badania wskazujące, że ograniczony poziom glukozy we krwi (zastąpionej przez ciała ketonowe) hamuje także rozwój innych nowotworów[78][79]. Fine i wsp. przeprowadzili próbę zastosowania diety niskowęglowodanowej (5% ogółu energii) przez 4 tygodnie u chorych z zaawansowaną chorobą nowotworową[80]. Schmidt i wsp. poddali niskowęglowodanowej diecie (70 g węglowodanów na dobę z podawaniem koktajli białkowo-tłuszczowych) grupę 16. pacjentów w zaawansowanym stadium choroby nowotworowej z przerzutami, u których nie było możliwe podjęcie żadnych typowych działań terapeutycznych[81]. 3-miesięczną terapię ukończyło 6 pacjentów, z których jeden wznowił chemioterapię. Pozostali pacjenci zmarli w wyniku zaawansowanego procesu chorobowego. Z wyjątkiem czasowych zaparć nie stwierdzono u nich działań niepożądanych stosowanej diety. Nie zaobserwowano także żadnej zmiany w profilu lipidowym krwi. Pacjenci zauważyli poprawę stanu emocjonalnego i jakości snu.
Terapia epilepsji
Niskowęglowodanowe diety ketogeniczne od wielu lat z powodzeniem stosuje się w leczeniu epilepsji u dzieci[82][83]. Skuteczność diety ketogennej w terapii padaczki jest udokumentowana w wielu publikacjach naukowych. U około 50% małych pacjentów donosi się o zmniejszeniu częstości napadów padaczkowych o co najmniej 50%, oraz o całkowitym ustąpieniu napadów u części dzieci z tej grupy[84][85][86].
Pierwsze kliniczne doniesienia o metabolicznych zmianach wywołanych głodem i dietą ketogeniczną imitującą głodzenie, a przez to zmniejszającą liczbę napadów drgawkowych, pochodzą z początku XX wieku – 1911 rok[87]. W 1921 roku po raz pierwszy zwrócono uwagę na znaczenie ketozy w leczeniu padaczki. W związku z tym, że głodzenie przez dłuższy czas nie jest możliwe, Wilder i Winter z Kliniki w Mayo postawili hipotezę, iż metaboliczne efekty oddziaływania na padaczkę są wywołane obecnością ciał ketonowych oraz zaproponowali dietę, która mogłaby przyczyniać się do powstania tych ciał poprzez indukowanie ketozy[88]. Zastosowali oni dietę, w której stosunek zawartości tłuszczów do węglowodanów i białek wynosił co najmniej 2:1 przy jednoczesnym ograniczeniu kaloryczności diety[89]. Wilde argumentował wówczas, że spożywanie produktów bogatych w tłuszcze i ubogich w węglowodany indukuje ketogenezę, ponieważ kiedy występuje dysproporcja między podażą kwasów tłuszczowych i cukrów, powstają ciała ketonowe z tłuszczu i białek. Jednocześnie białka zawarte w diecie ketogennej w sposób wystarczający zapewniają prawidłowy wzrost, rozwój i funkcjonowanie organizmu. Mechanizm zmniejszenia częstości napadów drgawkowych za pomocą leczenia dietą ketogenną wciąż nie został jednoznacznie wyjaśniony. Wśród wielu hipotez rozważa się głównie cztery[90]:
- zaistniałe wskutek ketozy zmiany w pH – kwasica wywiera wpływ hamujący na neurony;
- bezpośredni wpływ hamujący kwasów tłuszczowych (poziom kwasów tłuszczowych pozytywnie koreluje ze zmniejszoną aktywnością drgawkową, a już samo uzupełnienie zwykłej diety o 5 g wielonienasyconych kwasów tłuszczowych obniża ilość napadów);
- zmiany w metabolizmie energetycznym komórek nerwowych (neurony zużywają ciała ketonowe w znacznie większym stopniu niż glukozę);
- zmiany w funkcji neuroprzekaźników i transmisji synaptycznej (wpływ na metabolizm kwasu glutaminowego, noradrenaliny, neuropeptydu Y, galaminy).
Dieta ketogenna – oprócz zmniejszania częstości napadów – przyczynia się również do zmniejszenia u pacjentów z epilepsją dawek leków przeciwpadaczkowych (w niektórych przypadkach nawet ich odstawienia), poprawy stanu ich świadomości przez niwelowanie uczucia senności oraz polepszenia zachowania w kontaktach społecznych[91].
Krytyka
Skutki uboczne przy początkowym stosowaniu
Część osób rozpoczynających stosowanie diety niskowęglowodanowej (zwłaszcza ketogenicznej) skarży się na szereg skutków ubocznych występujących podczas procesu adaptacji organizmu, trwającego zwykle 1–7 dni. Wśród skutków ubocznych można wymienić bóle głowy, nudności, senność i zmęczenie. Pewne badania sugerują, że suplementacja karnityną zmniejsza skutki uboczne procesu adaptacji[92]. U stosujących ją osób – szczególnie u dzieci – oprócz zaparć i nudności mogą pojawić się efekty uboczne wczesne w postaci: wymiotów, utraty apetytu, odwodnienia, sepsy, zapalenia wątroby, zapalenia trzustki, hipoglikemii, hipertriglicerolemii, hiperurykemii, hipertransaminemii, hipercholesterolemii, hipoproteinemii, hipomagnezemii, hiponatremii, kwasicy metabolicznej oraz opóźnienie dojrzewania, niższy wzrost, nadwaga, zaburzenia depresyjne, zmniejszenie gęstości kości, kamica nerkowa, kardiomiopatie, niedobory witamin i soli mineralnych, dyslipidemia, podniesiony poziom długołańcuchowych kwasów tłuszczowych, zaburzenia wątrobowe, neuropatia nerwu wzrokowego, niedokrwistość, zaparcia oraz potencjalnie miażdżyca tętnic[93].
Pacjenci na diecie niskowęglowodanowej powinni być monitorowani pod kątem niedociśnienia ortostatycznego, zawrotów głowy, bólu głowy, zmęczenia, zwiększonej drażliwości, dny moczanowej oraz niewydolności nerek. Nie są znane efekty (korzyści lub zagrożenia) diety niskowęglowodanowej u pacjentów ze współistniejącymi schorzeniami, takimi jak cukrzyca, hiperlipidemia czy osteoporoza[38].
Zaparcia
Osoby długotrwale stosujące dietę niskowęglowodanową narażone są na zaparcia, wynikające z przyjmowania niedostatecznej ilości błonnika. Błonnik nie ulega trawieniu przez enzymy przewodu pokarmowego człowieka[94][95], przez co nie aktywuje procesu glikolizy i nie ma wpływu na poziom insuliny w surowicy krwi. Nowoczesne diety niskowęglowodanowe zalecają spożywanie warzyw bogatych w błonnik (ale o niskiej zawartości węglowodanów i niskim indeksie glikemicznym) przy każdym posiłku. U osób stosujących dietę niskowęglowodanową może pojawić się też biegunka. W celu zminimalizowania ryzyka wystąpienia ewentualnych niepożądanych skutków ubocznych diety niskowęglowodanowej zaleca się odpowiednią suplementację preparatami o składzie dostosowanym do jadłospisu z przewagą tłuszczów i ograniczonym przyjmowaniem węglowodanów. W ich składzie powinien znajdować się błonnik (np. inulina uznawana za rozpuszczalny błonnik pokarmowy i odznaczająca się niskim indeksem glikemicznym), kompleks witamin i minerałów, aminokwasy czy substancje wspomagające pracę wątroby.
Zobacz też
Przypisy
- ↑
 Eric H. Kossoff, Jane R. McGrogan, Renee M. Bluml, Diana J. Pillas, James E. Rubenstein, Eileen P. Vining. A Modified Atkins Diet Is Effective for the Treatment of Intractable Pediatric Epilepsy. „Epilepsia”. 47 (2), s. 421–424, 2006. DOI: 10.1111/j.1528-1167.2006.00438.x. PMID: 16499770.
Eric H. Kossoff, Jane R. McGrogan, Renee M. Bluml, Diana J. Pillas, James E. Rubenstein, Eileen P. Vining. A Modified Atkins Diet Is Effective for the Treatment of Intractable Pediatric Epilepsy. „Epilepsia”. 47 (2), s. 421–424, 2006. DOI: 10.1111/j.1528-1167.2006.00438.x. PMID: 16499770. - ↑
 Tonekaboni SH, Mostaghimi P, Mirmiran P, Abbaskhanian A, Abdollah Gorji F, Ghofrani M, Azizi F. Efficacy of the Atkins diet as therapy for intractable epilepsy in children. „Archives of Iranian Medicine”. 6 (13), s. 492–497, 2010. PMID: 21039004.
Tonekaboni SH, Mostaghimi P, Mirmiran P, Abbaskhanian A, Abdollah Gorji F, Ghofrani M, Azizi F. Efficacy of the Atkins diet as therapy for intractable epilepsy in children. „Archives of Iranian Medicine”. 6 (13), s. 492–497, 2010. PMID: 21039004. - ↑ Ruby M. Schwartz,S. Boyes, A. Aynsley-Green. Metabolic effects of three ketogenic diets in the treatment of severe epilepsy. „Developmental Medicine & Child Neurology”. 31 (2), s. 152–160, 1989. DOI: 10.1111/j.1469-8749.1989.tb03973.x. PMID: 2661288.
- ↑ Guenther Boden, Karin Sargrad, Carol Homko, Maria Mozzoli, T. Peter Stein. Effect of a Low-Carbohydrate Diet on Appetite, Blood Glucose Levels, and Insulin Resistance in Obese Patients with Type 2 Diabetes. „Annals of Internal Medicine”. 142 (6), s. 403–411, 2005. DOI: 10.7326/0003-4819-142-6-200503150-00006. PMID: 15767618.
- ↑ American Diabetes Association. Nutrition Recommendations and Interventions for Diabetes. A position statement of the American Diabetes Association. „Diabetes Care”. 31 (1), s. 61–78, 2008. DOI: 10.2337/dc08-S061. PMID: 18165339.
- ↑ J. A. J. Gowlett. What Actually was the Stone Age Diet?. „Journal of Nutritional and Environmental Medicine”. 13 (3), s. 143–147, 2003. DOI: 10.1080/13590840310001619338.
- ↑ Ehud Weiss i inni, The broad spectrum revisited: evidence from plant remains, „Proceedings of the National Academy of Sciences of the United States of America”, 101 (26), 2004, s. 9551–9555, DOI: 10.1073/pnas.0402362101, PMID: 15210984, PMCID: PMC470712.
- ↑
 Cordain L, Miller JB, Eaton SB, Mann N, Holt SH, Speth JD. Plant-animal subsistence ratios and macronutrient energy estimations in worldwide hunter-gatherer diets. „The American Journal of Clinical Nutrition”. 71 (3), s. 682–692, 2000. DOI: 10.1093/ajcn/71.3.682. PMID: 10702160.
Cordain L, Miller JB, Eaton SB, Mann N, Holt SH, Speth JD. Plant-animal subsistence ratios and macronutrient energy estimations in worldwide hunter-gatherer diets. „The American Journal of Clinical Nutrition”. 71 (3), s. 682–692, 2000. DOI: 10.1093/ajcn/71.3.682. PMID: 10702160. - ↑ William Morgan: Diabetes mellitus: its history, chemistry, anatomy, pathology, physiology and treatment. 1877.
- ↑ Max Einhorn: Lectures on dietetics. 1905.
- ↑ William Banting: Letter on Corpulence Addressed to Public. 1863.
- ↑ Dena M. Bravata i inni, Efficacy and safety of low-carbohydrate diets: a systematic review, „Journal of the American Medical Association”, 289 (14), 2003, s. 1837–1850, DOI: 10.1001/jama.289.14.1837, PMID: 12684364.
- ↑ Irwin Maxwell Stillman: The Doctor’s Quick Weight Loss Diet. 1967. ISBN 978-0440120452.
- ↑ Michael Greger, Atkins Facts - Atkins "Nightmare" Diet [online], www.atkinsexposed.org [dostęp 2018-04-06] [zarchiwizowane z adresu 2014-01-21].
- 1 2 A critique of low-carbohydrate ketogenic weight reduction regimens. A review of Dr. Atkins’ diet revolution. „Journal of the American Medical Association”. 224 (10), s. 1415–1419, 1973. DOI: 10.1001/jama.1973.03220240055018. PMID: 4739993.
- 1 2 3 4
 Iris Shai i inni. Weight Loss with a Low-Carbohydrate, Mediterranean, or Low-Fat Diet. „New England Journal of Medicine”. 359 (3), s. 229–241, 2008. DOI: 10.1056/NEJMoa0708681. PMID: 18635428.
Iris Shai i inni. Weight Loss with a Low-Carbohydrate, Mediterranean, or Low-Fat Diet. „New England Journal of Medicine”. 359 (3), s. 229–241, 2008. DOI: 10.1056/NEJMoa0708681. PMID: 18635428. - 1 2 3
 Halton TL, Willett WC, Liu S i inni. Low-carbohydrate-diet score and the risk of coronary heart disease in women. „The New England Journal of Medicine”. 355 (19), s. 1991–2002, 2006. DOI: 10.1056/NEJMoa055317. PMID: 17093250.
Halton TL, Willett WC, Liu S i inni. Low-carbohydrate-diet score and the risk of coronary heart disease in women. „The New England Journal of Medicine”. 355 (19), s. 1991–2002, 2006. DOI: 10.1056/NEJMoa055317. PMID: 17093250. - 1 2 Hession M, Rolland C, Kulkarni U, Wise A, Broom J. Systematic review of randomized controlled trials of low-carbohydrate vs. low-fat/low-calorie diets in the management of obesity and its comorbidities. „Obesity Reviews”. 10 (1), s. 36–50, 2009. DOI: 10.1111/j.1467-789X.2008.00518.x. PMID: 18700873.
- 1 2
 M.E. Daly i inni, Acute effects on insulin sensitivity and diurnal metabolic profiles of a high-sucrose compared with a high-starch diet, „The American Journal of Clinical Nutrition”, 67 (6), 1998, s. 1186–1196, DOI: 10.1093/ajcn/67.6.1186, PMID: 9625092.
M.E. Daly i inni, Acute effects on insulin sensitivity and diurnal metabolic profiles of a high-sucrose compared with a high-starch diet, „The American Journal of Clinical Nutrition”, 67 (6), 1998, s. 1186–1196, DOI: 10.1093/ajcn/67.6.1186, PMID: 9625092. - ↑ Dieta Atkinsa Efekty, Zasady i Opinie o Dietcie Niskowęglowodanowej, „Medicover GO”, 18 stycznia 2018 [dostęp 2018-04-06].
- ↑
 Last AR, Wilson SA. Low-carbohydrate diets. „American Family Physician”. 73 (11), s. 1942–1948, 2006. PMID: 16770923.
Last AR, Wilson SA. Low-carbohydrate diets. „American Family Physician”. 73 (11), s. 1942–1948, 2006. PMID: 16770923. - ↑ Anthony Accurso i inni, Dietary carbohydrate restriction in type 2 diabetes mellitus and metabolic syndrome: time for a critical appraisal, „Nutrition & Metabolism”, 5, 2008, s. 9, DOI: 10.1186/1743-7075-5-9, PMID: 18397522, PMCID: PMC2359752.
- ↑ Robert K Murray, Daryl K Granner, Victor William Rodwell, Franciszek Kokot, Zenon Aleksandrowicz, Harold A Harper: Biochemia Harpera ilustrowana. Warszawa: Wydawnictwo Lekarskie PZWL, 2008, s. 211. ISBN 978-83-200-3573-5.
- ↑ Reece J, Campbell N: Biology. San Francisco: Benjamin Cummings, 2002. ISBN 0-8053-6624-5.
- 1 2
 Pogozelski Wendy, Arpaia Nicholas, Priore Salvatore. The metabolic effects of low-carbohydrate diets and incorporation into a biochemistry course. „Biochemistry and Molecular Biology Education”. 33 (2), s. 91–100, 2005. DOI: 10.1002/bmb.2005.494033022445. PMID: 21638552.
Pogozelski Wendy, Arpaia Nicholas, Priore Salvatore. The metabolic effects of low-carbohydrate diets and incorporation into a biochemistry course. „Biochemistry and Molecular Biology Education”. 33 (2), s. 91–100, 2005. DOI: 10.1002/bmb.2005.494033022445. PMID: 21638552. - ↑ Robert S. Horn: Insulin and glucagon. [dostęp 2012-01-09]. (ang.).
- ↑ Dorland’s Medical Dictionary for Health Consumers. Saunders, 2007.
- ↑ Mary K. Campbell, Shawn O. Farrell: Biochemistry. Wyd. 5. Cengage Learning, 2006, s. 579. ISBN 0-534-40521-5.
- ↑ David S. Weigle i inni, A high-protein diet induces sustained reductions in appetite, ad libitum caloric intake, and body weight despite compensatory changes in diurnal plasma leptin and ghrelin concentrations, „The American Journal of Clinical Nutrition”, 82 (1), 2005, s. 41–48, DOI: 10.1093/ajcn.82.1.41, PMID: 16002798.
- ↑ Jennifer Warner: Jury Still Out on Low-Carbohydrate Diets. 2004-04-08. [dostęp 2012-01-09]. (ang.).
- 1 2
 Stern L, Iqbal N, Seshadri P i inni. The effects of low-carbohydrate versus conventional weight loss diets in severely obese adults: one-year follow-up of a randomized trial. „Annals of Internal Medicine”. 140 (10), s. 778–785, 2004. DOI: 10.7326/0003-4819-140-10-200405180-00007. PMID: 15148064.
Stern L, Iqbal N, Seshadri P i inni. The effects of low-carbohydrate versus conventional weight loss diets in severely obese adults: one-year follow-up of a randomized trial. „Annals of Internal Medicine”. 140 (10), s. 778–785, 2004. DOI: 10.7326/0003-4819-140-10-200405180-00007. PMID: 15148064. - ↑
 Kappagoda CT, Hyson DA, Amsterdam EA. Low-carbohydrate-high-protein diets: is there a place for them in clinical cardiology?. „Journal of the American College of Cardiology”. 43 (5), s. 725–730, 2004. DOI: 10.1016/j.jacc.2003.06.022. PMID: 14998607.
Kappagoda CT, Hyson DA, Amsterdam EA. Low-carbohydrate-high-protein diets: is there a place for them in clinical cardiology?. „Journal of the American College of Cardiology”. 43 (5), s. 725–730, 2004. DOI: 10.1016/j.jacc.2003.06.022. PMID: 14998607. - ↑
 Gardner CD, Kiazand A, Alhassan S i inni. Comparison of the Atkins, Zone, Ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: the A TO Z Weight Loss Study: a randomized trial. „Journal of the American Medical Association”. 297 (9), s. 969–977, 2007. DOI: 10.1001/jama.297.9.969. PMID: 17341711.
Gardner CD, Kiazand A, Alhassan S i inni. Comparison of the Atkins, Zone, Ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: the A TO Z Weight Loss Study: a randomized trial. „Journal of the American Medical Association”. 297 (9), s. 969–977, 2007. DOI: 10.1001/jama.297.9.969. PMID: 17341711. - ↑ Jørgen Vesti Nielsen, Eva Joensson, Low-carbohydrate diet in type 2 diabetes. Stable improvement of bodyweight and glycemic control during 22 months follow-up, „Nutrition & Metabolism”, 3, 2006, s. 22, DOI: 10.1186/1743-7075-3-22, PMID: 16774674, PMCID: PMC1526736.
- ↑ Grieb P, Kłapcińska B, Smol E, Pilis T i inni. Long-term consumption of a carbohydrate-restricted diet does not induce deleterious metabolic effects. „Nutrition Research”. 28 (12), s. 825–833, 2008. DOI: 10.1016/j.nutres.2008.09.011. PMID: 19083495.
- ↑ Sara B Seidelmann i inni, Dietary carbohydrate intake and mortality: a prospective cohort study and meta-analysis, „Lancet Public Health”, 2018, DOI: 10.1016/S2468-2667(18)30135-X.
- ↑ Reguła J., Charakterystyka i ocena wybranych diet alternatywnych, „Forum Zaburzeń Metabolicznych”, 4 (3), 2013, s. 115–121 [dostęp 2018-04-21].
- 1 2 Gajewska D., Bawa S., Myszkowska-Ryciak J., Strategie leczenia dietetycznego otyłości – czy istnieje optymalna dieta?, „Kosmos”, 54 (3-4), 2010, s. 385–393 [dostęp 2018-04-21].
- ↑ Arne Astrup, Thomas Meinert Larsen, Angela Harper, Atkins and other low-carbohydrate diets: hoax or an effective tool for weight loss?, „The Lancet”, 364 (9437), 2004, s. 897–899, DOI: 10.1016/S0140-6736(04)16986-9, PMID: 15351198.
- ↑ World Health Organization (WHO), The challenge of obesity in the European region and the strategies for response [online], 2007.
- ↑ Jeff S. Volek, Richard D. Feinman, Carbohydrate restriction improves the features of Metabolic Syndrome. Metabolic Syndrome may be defined by the response to carbohydrate restriction, „Nutrition & Metabolism”, 2, 2005, s. 31, DOI: 10.1186/1743-7075-2-31, PMID: 16288655, PMCID: PMC1323303.
- ↑
 Sharman MJ, Kraemer WJ, Love DM, Avery NG, Gomez AL, Scheett TP, Volek JS. A ketogenic diet favorably affects serum biomarkers for cardiovascular disease in normal-weight men. „The Journal of Nutrition”. 132 (7), s. 1879–1885, 2002. DOI: 10.1093/jn/132.7.1879. PMID: 12097663.
Sharman MJ, Kraemer WJ, Love DM, Avery NG, Gomez AL, Scheett TP, Volek JS. A ketogenic diet favorably affects serum biomarkers for cardiovascular disease in normal-weight men. „The Journal of Nutrition”. 132 (7), s. 1879–1885, 2002. DOI: 10.1093/jn/132.7.1879. PMID: 12097663. - ↑
 Brehm BJ, Seeley RJ, Daniels SR, D’Alessio DA. A randomized trial comparing a very low carbohydrate diet and a calorie-restricted low fat diet on body weight and cardiovascular risk factors in healthy women. „The Journal of Clinical Endoctrinology and Metabolism”. 88 (4), s. 1617–1623, 2003. DOI: 10.1210/jc.2002-021480. PMID: 12679447.
Brehm BJ, Seeley RJ, Daniels SR, D’Alessio DA. A randomized trial comparing a very low carbohydrate diet and a calorie-restricted low fat diet on body weight and cardiovascular risk factors in healthy women. „The Journal of Clinical Endoctrinology and Metabolism”. 88 (4), s. 1617–1623, 2003. DOI: 10.1210/jc.2002-021480. PMID: 12679447. - ↑ Sondike SB, Copperman N, Jacobson MS. Effects of a low-carbohydrate diet on weight loss and cardiovascular risk factor in overweight adolescents. „The Journal of Pediatrics”. 142 (3), s. 253–258, 2003. DOI: 10.1067/mpd.2003.4. PMID: 12640371.
- ↑
 Samaha FF, Iqbal N, Seshadri P, Chicano KL i inni. A low-carbohydrate as compared with a low-fat diet in severe obesity. „The New England Journal of Medicine”. 348 (21), s. 2074–2081, 2003. DOI: 10.1056/NEJMoa022637. PMID: 12761364.
Samaha FF, Iqbal N, Seshadri P, Chicano KL i inni. A low-carbohydrate as compared with a low-fat diet in severe obesity. „The New England Journal of Medicine”. 348 (21), s. 2074–2081, 2003. DOI: 10.1056/NEJMoa022637. PMID: 12761364. - ↑
 Foster GD, Wyatt HR, Hill JO, McGuckin BG, Brill C, Mohammed BS, Szapary PO, Rader DJ, Edman JS, Klein S. A randomized trial of a low-carbohydrate diet for obesity. „The New England Journal of Medicine”. 348 (21), s. 2082–2090, 2003. DOI: 10.1056/NEJMoa022207. PMID: 12761365.
Foster GD, Wyatt HR, Hill JO, McGuckin BG, Brill C, Mohammed BS, Szapary PO, Rader DJ, Edman JS, Klein S. A randomized trial of a low-carbohydrate diet for obesity. „The New England Journal of Medicine”. 348 (21), s. 2082–2090, 2003. DOI: 10.1056/NEJMoa022207. PMID: 12761365. - ↑
 Volek JS, Sharman MJ, Gómez AL, Scheett TP, Kraemer WJ. An isoenergetic very low carbohydrate diet improves serum HDL cholesterol and triacylglycerol concentrations, the total cholesterol to HDL cholesterol ratio and postprandial pipemic responses compared with a low fat diet in normal weight, normolipidemic women. „The Journal of Nutrition”. 133 (9), s. 2756–2761, 2003. DOI: 10.1093/jn/133.9.2756. PMID: 12949361.
Volek JS, Sharman MJ, Gómez AL, Scheett TP, Kraemer WJ. An isoenergetic very low carbohydrate diet improves serum HDL cholesterol and triacylglycerol concentrations, the total cholesterol to HDL cholesterol ratio and postprandial pipemic responses compared with a low fat diet in normal weight, normolipidemic women. „The Journal of Nutrition”. 133 (9), s. 2756–2761, 2003. DOI: 10.1093/jn/133.9.2756. PMID: 12949361. - ↑
 Allick G, Bisschop PH, Ackermans MT, Endert E, Meijer AJ, Kuipers F, Sauerwein HP, Romijn JA. A low-carbohydrate/high-fat diet improves glucoregulation in type 2 diabetes mellitus by reducing postabsorptive glycogenolysis. „The Journal of Clinical Endoctrinology and Metabolism”. 89 (12), s. 6193–6197, 2004. DOI: 10.1210/jc.2004-1041. PMID: 15579777.
Allick G, Bisschop PH, Ackermans MT, Endert E, Meijer AJ, Kuipers F, Sauerwein HP, Romijn JA. A low-carbohydrate/high-fat diet improves glucoregulation in type 2 diabetes mellitus by reducing postabsorptive glycogenolysis. „The Journal of Clinical Endoctrinology and Metabolism”. 89 (12), s. 6193–6197, 2004. DOI: 10.1210/jc.2004-1041. PMID: 15579777. - ↑
 Sharman MJ, Gómez AL, Kraemer WJ, Volek JS. Very low-carbohydrate and low-fat diets affect fasting lipids and postprandial lipemia differently in overweight men. „The Journal of Nutrition”. 134 (4), s. 880–885, 2004. DOI: 10.1093/jn/134.4.880. PMID: 15051841.
Sharman MJ, Gómez AL, Kraemer WJ, Volek JS. Very low-carbohydrate and low-fat diets affect fasting lipids and postprandial lipemia differently in overweight men. „The Journal of Nutrition”. 134 (4), s. 880–885, 2004. DOI: 10.1093/jn/134.4.880. PMID: 15051841. - ↑
 Brehm BJ, Spang SE, Lattin BL, Seeley RJ, Daniels SR, D’Alessio DA. The role of energy expenditure in the differential weight loss in obese women on low-fat and low-carbohydrate diets. „The Journal of Clinical Endoctrinology and Metabolism”. 90 (3), s. 1475–1482, 2004. DOI: 10.1210/jc.2004-1540. PMID: 15598683.
Brehm BJ, Spang SE, Lattin BL, Seeley RJ, Daniels SR, D’Alessio DA. The role of energy expenditure in the differential weight loss in obese women on low-fat and low-carbohydrate diets. „The Journal of Clinical Endoctrinology and Metabolism”. 90 (3), s. 1475–1482, 2004. DOI: 10.1210/jc.2004-1540. PMID: 15598683. - 1 2
 Meckling KA, O’Sullivan C, Saari D. Comparison of a low-fat diet to a low-carbohydrate diet on weight loss, body composition, and risk factors for diabetes and cardiovascular disease in free-living, overweight men and women. „The Journal of Clinical Endoctrinology and Metabolism”. 89 (6), s. 2717–2723, 2004. DOI: 10.1210/jc.2003-031606. PMID: 15181047.
Meckling KA, O’Sullivan C, Saari D. Comparison of a low-fat diet to a low-carbohydrate diet on weight loss, body composition, and risk factors for diabetes and cardiovascular disease in free-living, overweight men and women. „The Journal of Clinical Endoctrinology and Metabolism”. 89 (6), s. 2717–2723, 2004. DOI: 10.1210/jc.2003-031606. PMID: 15181047. - ↑ Yancy WS Jr, Olsen MK, Guyton JR, Bakst RP, Westman EC. A low-carbohydrate, ketogenic diet versus a low-fat diet to treat obesity and hyperlipidemia: a randomized, controlled trial. „The Annals of Internal Medicine”. 140 (10), s. 769–777, 2004. PMID: 15148063.
- ↑
 Aude YW, Agatston AS, Lopez-Jimenez F, Lieberman EH, Marie Almon, Hansen M, Rojas G, Lamas GA, Hennekens CH. The national cholesterol education program diet vs a diet lower in carbohydrates and higher in protein and monounsaturated fat: a randomized trial. „Archives of Internal Medicine”. 164 (19), s. 2141–2146, 2004. DOI: 10.1001/archinte.164.19.2141. PMID: 15505128.
Aude YW, Agatston AS, Lopez-Jimenez F, Lieberman EH, Marie Almon, Hansen M, Rojas G, Lamas GA, Hennekens CH. The national cholesterol education program diet vs a diet lower in carbohydrates and higher in protein and monounsaturated fat: a randomized trial. „Archives of Internal Medicine”. 164 (19), s. 2141–2146, 2004. DOI: 10.1001/archinte.164.19.2141. PMID: 15505128. - ↑
 McAuley KA, Hopkins CM, Smith KJ, McLay RT, Williams SM, Taylor RW, Mann JI. Comparison of high-fat and high-protein diets with a high-carbohydrate diet in insulin-resistant obese women. „Diabetologia”. 48 (1), s. 8–16, 2004. DOI: 10.1007/s00125-004-1603-4. PMID: 15616799.
McAuley KA, Hopkins CM, Smith KJ, McLay RT, Williams SM, Taylor RW, Mann JI. Comparison of high-fat and high-protein diets with a high-carbohydrate diet in insulin-resistant obese women. „Diabetologia”. 48 (1), s. 8–16, 2004. DOI: 10.1007/s00125-004-1603-4. PMID: 15616799. - ↑
 Dansinger ML, Gleason JA, Griffith JL, Selker HP, Schaefer EJ. Comparison of the Atkins, Ornish, Weight Watchers, and Zone diets for weight loss and heart disease risk reduction: a randomized trial. „The Journal of the American Medical Association”. 293 (1), s. 43–53, 2005. DOI: 10.1001/jama.293.1.43. PMID: 15632335.
Dansinger ML, Gleason JA, Griffith JL, Selker HP, Schaefer EJ. Comparison of the Atkins, Ornish, Weight Watchers, and Zone diets for weight loss and heart disease risk reduction: a randomized trial. „The Journal of the American Medical Association”. 293 (1), s. 43–53, 2005. DOI: 10.1001/jama.293.1.43. PMID: 15632335. - ↑ Young CM, Scanlan SS, Im HS, Lutwak L. Effect of body composition and other parameters in obese young men of carbohydrate level of reduction diet. „The American Journal of Clinical Nutrition”. 24 (3), s. 290–296, 1971. DOI: 10.1093/ajcn/24.3.290. PMID: 5548734.
- ↑ Willi SM, Oexmann MJ, Wright NM, Collop NA, Key LL Jr. The effects of a high-protein, low-fat, ketogenic diet on adolescents with morbid obesity: body composition, blood chemistries, and sleep abnormalities. „Pediatrics”. 101 (1), s. 61–67, 1998. DOI: 10.1542/peds.101.1.61. PMID: 9417152.
- ↑ Meckling KA, Gauthier M, Grubb R, Sanford J. Effects of a hypocaloric, low-carbohydrate diet on weight loss, blood lipids, blood pressure, glucose tolerance, and body composition in free-living overweight women. „Canadian Journal of Physiology and Pharmacology”. 80 (11), s. 1095–1105, 2002. PMID: 12489929.
- ↑ Volek JS, Sharman MJ, Love DM, Avery NG, Gómez AL, Scheett TP, Kraemer WJ. Body composition and hormonal responses to a carbohydrate-restricted diet. „Metabolism”. 51 (7), s. 864–870, 2002. DOI: 10.1053/meta.2002.32037. PMID: 12077732.
- ↑ Patty W. Siri-Tarino i inni, Meta-analysis of prospective cohort studies evaluating the association of saturated fat with cardiovascular disease, „The American Journal of Clinical Nutrition”, 91 (3), 2010, s. 535–546, DOI: 10.3945/ajcn.2009.27725, PMID: 20071648, PMCID: PMC28241528.
- ↑ Nieuwenhuys R, Donkelaar, HJ, Nicholson C: The Central Nervous System of Vertebrates. T. 1. Springer, 1998, s. 11–14. ISBN 978-3-540-56013-5.
- ↑
 Amanda E. Greene, Mariana T. Todorova, Thomas N. Seyfried, Perspectives on the metabolic management of epilepsy through dietary reduction of glucose and elevation of ketone bodies, „Journal of Neurochemistry”, 86 (3), 2003, s. 529–537, DOI: 10.1046/j.1471-4159.2003.01862.x, PMID: 12859666.
Amanda E. Greene, Mariana T. Todorova, Thomas N. Seyfried, Perspectives on the metabolic management of epilepsy through dietary reduction of glucose and elevation of ketone bodies, „Journal of Neurochemistry”, 86 (3), 2003, s. 529–537, DOI: 10.1046/j.1471-4159.2003.01862.x, PMID: 12859666. - ↑ Devivo DC, Leckie MP, Ferrendelli JS, McDougal Jr DB. Chronic ketosis and cerebral metabolism. „Annals of Neurology”. 3 (4), s. 331–337, 1978. DOI: 10.1002/ana.410030410. PMID: 666275.
- ↑ Tim E Cullingford. The ketogenic diet; fatty acids, fatty acid-activated receptors and neurological disorders. „Prostaglandins, Leukotrienes and Essential Fatty Acids”. 70 (3), s. 253–264, 2004. DOI: 10.1016/j.plefa.2003.09.008. PMID: 14769484.
- ↑ H. Li, G. Dryhurst, Oxidative metabolites of 5-Scysteinyldopamine inhibit the pyruvate dehydrogenase complex, „Journal of Neural Transmission”, 108 (12), 2001, s. 1363–1374, DOI: 10.1007/s007020100013, PMID: 11810401.
- ↑ Grazyna Kunikowska, Peter Jenner, Alterations in m-RNA expression for Cu,Zn-superoxide dismutase and glutathione peroxidase in the basal ganglia of MPTP-treated marmosets and patients with Parkinson's disease, „Brain Research”, 968 (2), 2003, s. 206–218, DOI: 10.1016/S0006-8993(03)02240-6, PMID: 12663090.
- ↑ Javier Blesa i inni, Oxidative stress and Parkinson's disease, „Frontiers in Neuroanatomy”, 9, 2015, s. 91, DOI: 10.3389/fnana.2015.00091, PMID: 26217195, PMCID: PMC4495335.
- ↑ Kashiwaya Y., Takeshima T., Mori N., D-β-hydroxybutyrate protects neurons in models of Alzheimer’s and Parkinson’s disease, „Proceedings of the National Academy of Sciences U.S.A”, 97 (10), 2000, s. 5440-5444, DOI: 10.1073/pnas.97.10.5440, PMID: 10805800, PMCID: PMC25847.
- ↑ Kim Tieu i inni, D-β-hydroxybutyrate rescues mitochondrial respiration and mitigates features of Parkinson disease, „The Journal of Clinical Investigation”, 112 (6), 2003, s. 892–901, DOI: 10.1172/JCI18797, PMID: 12975474, PMCID: PMC193668.
- ↑
 Frank Q. Nuttall, Kelly Schweim, Heidi Hoover, Mary C. Gannon. Metabolic effect of a LoBAG30 diet in men with type 2 diabetes. „American Journal of Physiology - Endocrinology and Metabolism”. 291 (4), s. 786–791, 2006. DOI: 10.1152/ajpendo.00011.2006. PMID: 16720631.
Frank Q. Nuttall, Kelly Schweim, Heidi Hoover, Mary C. Gannon. Metabolic effect of a LoBAG30 diet in men with type 2 diabetes. „American Journal of Physiology - Endocrinology and Metabolism”. 291 (4), s. 786–791, 2006. DOI: 10.1152/ajpendo.00011.2006. PMID: 16720631. - ↑ William S Yancy i inni, A low-carbohydrate, ketogenic diet to treat type 2 diabetes, „Nutrition & Metabolism”, 2, 2005, s. 34, DOI: 10.1186/1743-7075-2-34, PMID: 16318637, PMCID: PMC1325029.
- 1 2 Ajala O. i inni, Systematic review and meta-analysis of different dietary approaches to the management of type 2 diabetes, „The American Journal of Clinical Nutrition”, 97 (3), 2013, s. 505–516, DOI: 10.3945/ajcn.112.042457, PMID: 23364002.
- 1 2 Katarzyna Dudziak, Bożena Regulska-Ilow, Znaczenie ładunku glikemicznego diety w rozwoju chorób nowotworowych, „Postępy Higieny i Medycyny Doświadczalnej”, 67, 2013, s. 449–462 [dostęp 2018-04-22] [zarchiwizowane z adresu 2017-06-27].
- ↑
 Nuria Camarero, Cristina Mascaró, Cristina Mayordomo, Felip Vilardell, Diego Haro, Pedro F. Marrero. Ketogenic HMGCS2 Is a c-Myc Target Gene Expressed in Differentiated Cells of Human Colonic Epithelium and Down-Regulated in Colon Cancer. „Molecular Cancer Research”. 4 (9), s. 645-653, 2006. DOI: 10.1158/1541-7786.MCR-05-0267. PMID: 16940161.
Nuria Camarero, Cristina Mascaró, Cristina Mayordomo, Felip Vilardell, Diego Haro, Pedro F. Marrero. Ketogenic HMGCS2 Is a c-Myc Target Gene Expressed in Differentiated Cells of Human Colonic Epithelium and Down-Regulated in Colon Cancer. „Molecular Cancer Research”. 4 (9), s. 645-653, 2006. DOI: 10.1158/1541-7786.MCR-05-0267. PMID: 16940161. - ↑ Christoph Otto i inni, Growth of human gastric cancer cells in nude mice is delayed by a ketogenic diet supplemented with omega-3 fatty acids and medium-chain triglycerides, „BMC cancer”, 8, 2008, s. 122, DOI: 10.1186/1471-2407-8-122, PMID: 18447912, PMCID: PMC2408928.
- ↑ Weihua Zhou i inni, The calorically restricted ketogenic diet, an effective alternative therapy for malignant brain cancer, „Nutrition & Metabolism”, 4, 2007, s. 5, DOI: 10.1186/1743-7075-4-5, PMID: 17313687, PMCID: PMC1819381.
- ↑
 Thomas N Seyfried, Michael Kiebish, Jeremy Marsh, Purna Mukherjee. Targeting energy metabolism in brain cancer through calorie restriction and the ketogenic diet. „Journal of Cancer Research & Therapeutics”. 5 (9), s. 7–15, 2009. DOI: 10.4103/0973-1482.55134. PMID: 20009300.
Thomas N Seyfried, Michael Kiebish, Jeremy Marsh, Purna Mukherjee. Targeting energy metabolism in brain cancer through calorie restriction and the ketogenic diet. „Journal of Cancer Research & Therapeutics”. 5 (9), s. 7–15, 2009. DOI: 10.4103/0973-1482.55134. PMID: 20009300. - ↑ Nebeling LC, Lerner E. Implementing a ketogenic diet based on medium-chain triglyceride oil in pediatric patients with cancer. „Journal of Cancer Research & Therapeutics”. 96 (6), s. 693–697, 1995. DOI: 10.1016/S0002-8223(95)00189-1. PMID: 7759747.
- ↑ Nebeling LC, Lerner E. Effects of a ketogenic diet on tumor metabolism and nutritional status in pediatric oncology patients: two case reports. „Journal of the American College of Nutrition”. 14 (2), s. 202–208, 1994. DOI: 10.1080/07315724.1995.10718495. PMID: 7790697.
- ↑ Fine E.J. i inni, A pilot safety and feasibility trial of a reduced carbohydrate diet in patients with advanced cancer, „Journal of Clinical Oncology”, 29 (15 (suppl.)), 2011, e13573, DOI: 10.1200/jco.2011.29.15_suppl.e13573.
- ↑ Melanie Schmidt i inni, Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: A pilot trial, „Nutrition & Metabolism”, 8 (1), 2011, s. 54, DOI: 10.1186/1743-7075-8-54, PMID: 21794124, PMCID: PMC3157418.
- ↑
 Hartman AL, Vining EP. Clinical aspects of the ketogenic diet. „Epilepsia”. 48 (1), s. 31–42, 2007. DOI: 10.1111/j.1528-1167.2007.00914.x. PMID: 17241206.
Hartman AL, Vining EP. Clinical aspects of the ketogenic diet. „Epilepsia”. 48 (1), s. 31–42, 2007. DOI: 10.1111/j.1528-1167.2007.00914.x. PMID: 17241206. - ↑ John Freeman,Eric Kossoff, Millicent Kelly: The Ketogenic Diet: A Treatment for Children and Others with Epilepsy. Wyd. 4. New York: Demos, 2007. ISBN 978-1-932603-18-7.
- ↑ J.M. Freeman i inni, The efficacy of the ketogenic diet–1998. A prospective evaluation of intervention in 150 children, „Pediatrics”, 102 (6), 1998, s. 1358–1363, DOI: 10.1542/peds.102.6.1358, PMID: 9832569.
- ↑ S.L. Kinsman i inni, Efficacy of the ketogenic diet for intractable seizure disorders: review of 58 cases, „Epilepsia”, 33 (6), 1992, s. 1132–1136, DOI: 10.1111/j.1528-1157.1992.tb01770.x, PMID: 1464275.
- ↑ Hoon Chul Kang i inni, Efficacy and safety of the ketogenic diet for intractable childhood epilepsy: Korean multicentric experience, „Epilepsia”, 46 (2), 2005, s. 272–279, DOI: 10.1111/j.0013-9580.2005.48504.x, PMID: 15679508.
- ↑ Elizabeth E. Bailey, Heidi H. Pfeifer, Elizabeth A. Thiele, The use of diet in the treatment of epilepsy, „Epilepsy & Behavior”, 6 (1), 2005, s. 4–8, DOI: 10.1016/j.yebeh.2004.10.006, PMID: 15652725.
- ↑ Francis J. DiMario, Jessica Holland, The ketogenic diet: a review of the experience at Connecticut Children's Medical Center, „Pediatric Neurology”, 26 (4), 2002, s. 288–292, DOI: 10.1016/S0887-8994(01)00405-2, PMID: 11992756.
- ↑ Kardasz M., Pawłowska D., Dieta ketogenna jako terapia w lekoopornej dziecięcej epilepsji, „Nowa Pediatria”, 3/2009, s. 79–89 [dostęp 2018-04-22].
- ↑ Stafstrom C. E., Rho J. M., Epilepsy and the Ketogenic Diet., „Humana Press Inc”, 2004, ISBN 1-58829-295-9.
- ↑ Marek Bachański, Dieta ketogenna w leczeniu padaczki opornej na leki u dzieci, „Opieka Paliatywna Nad Dziećmi”, 15, 2007, s. 201-205 [dostęp 2018-04-22].
- ↑
 Berry-Kravis Elizabeth, Booth Gayle, Sanchez Ana Carolina, Woodbury-Kolb Jean. Carnitine Levels and the Ketogenic Diet. „Epilepsia”. 42 (11), s. 1445–1451, 2001. DOI: 10.1046/j.1528-1157.2001.18001.x. PMID: 11879348.
Berry-Kravis Elizabeth, Booth Gayle, Sanchez Ana Carolina, Woodbury-Kolb Jean. Carnitine Levels and the Ketogenic Diet. „Epilepsia”. 42 (11), s. 1445–1451, 2001. DOI: 10.1046/j.1528-1157.2001.18001.x. PMID: 11879348. - ↑ John Mark Freeman, Jennifer B. Freeman, Millicent T. Kelly, The ketogenic diet: A treatment for epilepsy, New York 2000, s. 236, ISBN 1-888799-39-0.
- ↑ Dembiński Łukasz, Banaszkiewicz Aleksandra, Radzikowski Andrzej. Dieta bogatoresztkowa - definicja, korzyści i normy w pediatrii. „Pediatria Współczesna. Gastroenterologia, Hepatologia i Żywienie Dziecka”. 12 (2), s. 139–145, 2010. ISSN 1507-5532.
- ↑ Bartnikowska Elżbieta. Włókno pokarmowe w żywieniu człowieka. Część II. „Przemysł spożywczy”. 51, s. 43-48, 5 1997.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.