Są to związki, w cząsteczkach których występuje jako grupa funkcyjna grupa karboksylowa –COOH. Grupa ta składa się z grupy karbonylowej oraz hydroksylowej.
Ogólny wzór kwasu monokarboksylowego:
R — COOH, gdzie: R – atom wodoru lub dowolna grupa alkilowa lub arylowa.
Biorąc pod uwagę liczbę grup karboksylowych oraz rodzaj reszty węglowodorowej kwasy można podzielić na:
- nasycone monokarboksylowe:

- nienasycone monokarboksylowe:
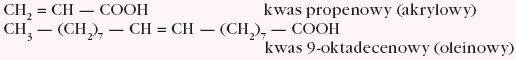
- cykloalifatyczne monokarboksylowe

- aromatyczne monokarboksylowe
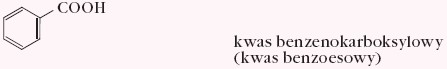
- nasycone dikarboksylowe

- nienasycone dikarboksylowe
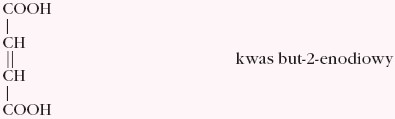
- cykloalifatyczne dikarboksylowe

- aromatyczne dikarboksylowe

W szeregu homologicznym nasyconych monokarboksylowych kwasów ze wzrostem liczby atomów węgla w cząsteczce:
- zmienia się stan skupienia – od cieczy do ciał stałych,
- maleje rozpuszczalność w wodzie,
- wzrasta temperatura wrzenia i topnienia,
- maleje reaktywność,
- maleje moc.
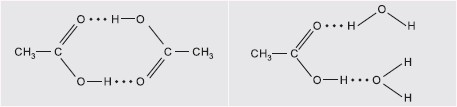
Polarność wiązań w grupie karboksylowej powoduje, że pomiędzy cząsteczkami kwasów karboksylowych występują wiązania wodorowe. Ich obecność wywołuje stosunkowo wysokie temperatury wrzenia tych związków, jak również wpływa na rozpuszczalność w wodzie. Asocjacja cząsteczek występuje nie tylko w fazie ciekłej,ale i gazowej. Kwas etanowy w fazie gazowej występuje w postaci cyklicznego dimeru, co przedstawia m.in. poniższy rysunek:
Rozpuszczalne w wodzie kwasy ulegają dysocjacji jonowej z odszczepieniem kationów H+, co przedstawiono poniższymi równaniami:![]()
Kwasy karboksylowe, podobnie jak kwasy nieorganiczne, reagują z metalami, tlenkami metali i wodorotlenkami tworząc sole. Reakcje te przebiegają z udziałem wodoru grupy karboksylowej (pęka wiązanie tlen-wodór):
2 CH3COOH + Mg → (CH3COO)2Mg + H2 ↑ etanian magnezu
2 CH3COOH + CuO → (CH3COO)2Cu + H2O etanian miedzi(II)
CH3COOH + KOH → CH3COOK + H2O etanian potasu
Duże znaczenie przemysłowe mają sole sodowe lub potasowe wyższych kwasów tłuszczowych, zwane mydłami. Mydła te ulegają hydrolizie anionowej jak sole słabych kwasów i mocnych zasad, np. wodny roztwór stearynianu potasu ma odczyn zasadowy, co potwierdza jonowy zapis tego procesu:![]()
O zdolności mydła do usuwania brudu, czyli na ogół cząsteczek tłuszczu, decyduje ich budowa. Anion R-COO– składa się z długiego ogona (niepolarny łańcuch węglowodorowy) o charakterze hydrofobowym oraz grupy –COO–, tzw. głowy o właściwościach hydrofilowych. Ogon wnika do cząsteczki tłuszczu, a hydrofilowa głowa pozostaje na jej powierzchni umożliwiając jej zwilżanie przez wodę. Mydła powodują zmniejszenie napięcia powierzchniowego wody, dzięki czemu łatwo wnikają w pory skóry czy tkanin, usuwając brud. Mydło w wodzie twardej, czyli zawierającej jony Ca2+ i Mg2+ bardzo źle siępieni. Powstają wówczas nierozpuszczalne w wodzie sole, np.![]()
Kwasy karboksylowe w odpowiednich warunkach ulegają dekarboksylacji:
R — COOH → R — H + CO2
Kwasy karboksylowe w odpowiednich warunkach ulegają redukcji:
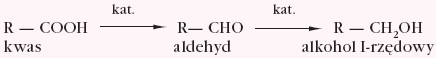
Charakterystyczną właściwością kwasów karboksylowych jest zdolność do reagowania z alkoholami i tworzenia estrów. Reakcja ta przebiega z rozerwaniem wiązania węgiel-tlen grupy karboksylowej (mechanizm reakcji poznano używając w badaniach izotopu tlenu 18O):
![]()
Przedstawiona ogólnym zapisem reakcja, katalizowana jonami H+, nosi nazwę reakcji estryfikacji. Jest to reakcja odwracalna. Proces odwrotny do estryfikacji to hydroliza. Hydroliza może zachodzić w obecności mocnego kwasu lub zasady. Należy pamiętać, że hydroliza kwasowa jest prostym odwróceniem reakcji estryfikacji, która również jest katalizowana jonami H+.Hydroliza zasadowa jest procesem nieodwracalnym, gdyż jony OH– są w niej reagentem, a nie katalizatorem.
