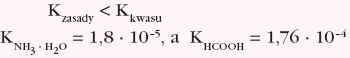Odczyn kwaśny posiadają wodne roztwory kwasów, zasadowy – roztwory zasad. A jaki odczyn mają wodne roztwory soli? Rozpuszczalne w wodzie sole nie tylko ulegają procesowi dysocjacji elektrolitycznej, ale również hydrolizie.
Hydroliza soli to reakcja odwracalna zachodząca między kationem lub/i anionem soli a cząsteczką wody. Hydrolizie ulegają wszystkie sole rozpuszczalne w wodzie z wyjątkiem soli mocnych kwasów i mocnych zasad, np. K2SO4 , NaCl. Odczyn roztworu wodnego tych soli jest obojętny.
- sole mocnych kwasów i słabych zasad posiadają kwaśny odczyn roztworu wodnego → hydroliza kationowa
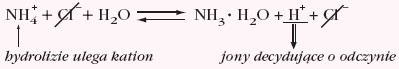
- sole mocnych zasad i słabych kwasów posiadają zasadowy odczyn roztworu wodnego → hydroliza anionowa
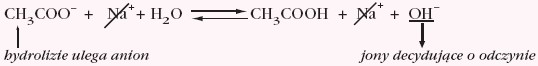
- sole słabych kwasów i słabych zasad posiadają w przybliżeniu obojętny odczyn roztworu wodnego (aby dokładnie określić odczyn, który będzie np. słabo kwaśny lub słabo zasadowy należy porównać wartości stałych dysocjacji słabego kwasu i słabej zasady) → hydroliza kationowo-anionowa
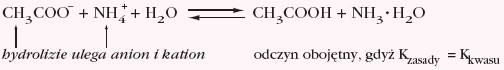
ale w przypadku np. metanianu (mrówczanu) amonu odczyn jego roztworu wodnego jest słabo kwaśny (pH < 7), gdyż: