Aby węglowodór został zaliczony do węglowodorów aromatycznych, jego cząsteczka musi:
- mieć budowę cykliczną,
- być płaska (orbitale walencyjne atomów węgla tworzących pierścień są w stanie hybrydyzacji sp2),
- posiadać wiązanie zdelokalizowane (chmura elektronowa) zawierające (4n + 2) elektronów π (reguła Hückla).
Benzen i jego homologi zaliczamy do węglowodorów aromatycznych. Benzen to węglowodór o wzorze sumarycznym C6H6. Poniżej przedstawiono schemat nakładania orbitali atomowych w cząsteczce benzenu wraz z wzorem tej cząsteczki:
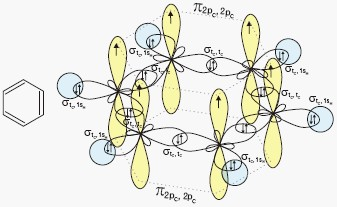
W sześcioczłonowym pierścieniu benzenu każdy atom węgla wiąże się trwałym wiązaniem σ z dwoma sąsiednimi atomami węgla i z jednym atomem wodoru, wykorzystując w tym celu 3 hybrydy sp2. Atomy węgla leżą w wierzchołkach sześciokąta foremnego, a kąty między wiązaniami wynoszą 120°. Wiązania pomiędzy atomami węgla w pierścieniu mają jednakową długość 139 pm. Każdy atom węgla posiada jeszcze po jednym elektronie walencyjnym, którego stan opisuje orbital atomowy 2p. Te elektrony tworzą zdelokalizowane wiązanie typu π.
| stan hybrydyzacji orbitali walencyjnych atomów węgla w pierścieniu | długość wiązania węgiel–węgiel w pierścieniu | energia wiązania węgiel–węgiel w pierścieniu |
| sp2 | 139 pm | 490 kJ/mol |
Charakterystyczną właściwością węglowodorów aromatycznych jest trwałość pierścienia oraz zdolność do ulegania reakcjom substytucji. Wiadomo, że każdy z sześciu atomów wodoru w cząsteczce benzenu może ulec podstawieniu, dając ten sam produkt, tak więc atomy węgla są równocenne przy tworzeniu monopochodnej.
 Benzen to bezbarwna, lotna ciecz o charakterystycznym zapachu. Jest cieczą niepolarną. Stanowi dobry rozpuszczalnik innych związków organicznych, np. tłuszczy. Jest łatwopalny – pali się kopcącym płomieniem. Benzen jest toksyczny i posiada właściwości rakotwórcze.
Benzen to bezbarwna, lotna ciecz o charakterystycznym zapachu. Jest cieczą niepolarną. Stanowi dobry rozpuszczalnik innych związków organicznych, np. tłuszczy. Jest łatwopalny – pali się kopcącym płomieniem. Benzen jest toksyczny i posiada właściwości rakotwórcze.
