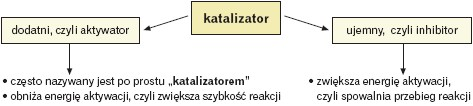
Katalizator to substancja, która wprowadzona do reagującego układu zwiększa (obniża energię aktywacji) lub zmniejsza (podwyższa energię aktywacji) szybkość reakcji. Fakt ten zdeterminowany jest po prostu zmianą drogi reakcji zachodzącej z udziałem katalizatora w stosunku do drogi reakcji zachodzącej bez udziału katalizatora. Katalizator bierze udział w reakcji chemicznej, ale zostaje w układzie w niezmienionej ilości po jej zakończeniu.
Katalizatorem może być jeden ze składników jednorodnej fazy, w której zachodzi reakcja – wtedy katalizator występuje w tym samym stanie skupienia co reagenty. Tak przebiegającą reakcję nazywamy katalizą jednorodną (homogeniczną). Jeżeli katalizator stanowi odrębną fazę w układzie reagującym, to jest to kataliza niejednorodna (heterogeniczna). Katalizator w stanie stałym umieszczony w środowisku gazowym lub ciekłym nosi nazwę kontaktu. Działanie kontaktu polega na adsorpcji na swojej powierzchni substratów i stąd ważna jest dla przebiegu katalizy wielkość powierzchni i struktura katalizatora.
Przeprowadzenie wielu reakcji chemicznych jest możliwe dzięki użyciu katalizatora, np.:

Działalność katalizatora polega na obniżeniu energii aktywacji, czyli energii potrzebnej do utworzenia przejściowego połączenia substratu z katalizatorem. Poniżej zamieszczono wykres reakcji przebiegającej w obecności katalizatora (K) wg równania:
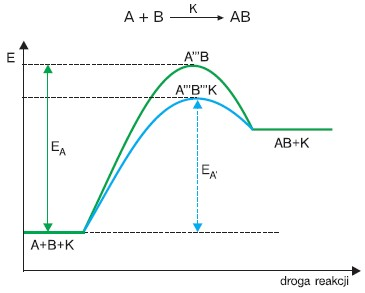
Z przejściowego połączenia katalizatora z substratami powstają produkty i odtwarza się katalizator. Energia aktywacji przejściowego połączenia substratów z katalizatorem(EA’) jest niższa od energii przejściowego połączenia substratów bez obecności katalizatora (EA). Katalizator wpływa więc na energię aktywacji reakcji.
Reakcją, której szybkość może być regulowana dodatkiem katalizatora, jest np. rozkład nadtlenku wodoru:
![]()
Rozkład nadtlenku wodoru (wody utlenionej) może być katalizowany tlenkiem manganu(IV) (kataliza heterogeniczna), wodnym roztworem chlorku żelaza(III) (kataliza homogeniczna). Natomiast dodatek kwasu fosforowego(V) do wody utlenionej umożliwia jej długotrwałe przechowywanie (spowolnienie reakcji rozkładu). Rozkład H2O2 możliwy jest również pod wpływem enzymu – katalazy. Jest to przykład reakcji enzymatycznej.
Reakcja, w której powstający produkt pełni rolę katalizatora tej reakcji, nosi nazwę autokatalizy. Reakcja, początkowo przebiegająca powoli, ulega coraz większemu przyspieszeniu, w miarę powstawania produktów pełniących funkcję katalizatora,np.:
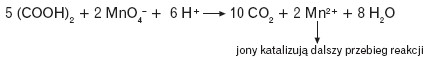
W przypadku reakcji zachodzących z udziałem związków organicznych od użytego katalizatora zależy rodzaj i struktura cząsteczki powstającego związku.
Odrębną grupą katalizatorów są enzymy. Są to w większości białka katalizujące reakcje biochemiczne zachodzące w organizmach żywych. Enzymy nazywane są też biokatalizatorami. Ich charakterystyczną cechą jest duża specyficzność substratowa i wysoka wydajność.
