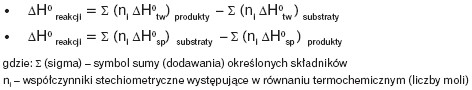Efekty cieplne reakcji można obliczyć, korzystając z prawa Lavoisiera-Laplace’a oraz prawa Hessa. Prawa te wykorzystuje się do wyznaczenia nieznanych efektów cieplnych reakcji chemicznych na podstawie innych reakcji, dla których znane są efekty cieplne.
Podczas rozwiązywania zadań łączymy poszczególne równania chemiczne (dodajemy stronami, odejmujemy stronami, mnożymy) tak, aby otrzymać równanie tej reakcji, której efekt cieplny liczymy. Te manipulacje matematyczne, które zostały dokonane na równaniach reakcji, należy w następnej kolejności wykonać na wartościach ciepeł poszczególnych reakcji chemicznych (dodać, odjąć, podzielić, pomnożyć).
Prawo Lavoisiera-Laplace’a:
Efekt cieplny danej reakcji i efekt cieplny reakcji przebiegającej w kierunku przeciwnym różnią się tylko znakiem.
Jeżeli dla reakcji: A + B --> C efekt cieplny wynosi ΔH0 = – 13 kJ/mol, to dla reakcji przebiegającej w kierunku odwrotnym: C --> A + B wynosi ΔH0 = 13 kJ/mol.
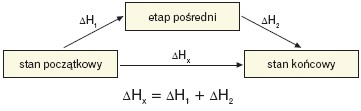
Prawo Hessa:
Niezależnie od tego, czy reakcja chemiczna przebiega od stanu początkowego do stanu końcowego bezpośrednio czy przez reakcje pośrednie, całkowity efekt cieplny reakcji jest w obu przypadkach taki sam.
Założono, że wszystkie procesy muszą zachodzić w ustalonych warunkach izotermiczno-izobarycznych lub izotermiczno-izochorycznych.
W obliczeniach można również wykorzystać stabelaryzowane wartości standardowych molowych entalpii tworzenia ΔH0tw oraz standardowych molowych entalpii spalania ΔH0sp (dla substancji organicznych) zgodnie z poniższymi wzorami: