Rozdrobnione żelazo spala się w tlenie, tworząc tlenek żelaza(II) diżelaza(III) – ciało stałe o czarnej barwie:
![]()
Tlenek ten powstaje też w reakcji żelaza z gorącą parą wodną.
![]()
Żelazo tworzy także inne tlenki:
- FeO – tlenek żelaza(II) powstający w wyniku termicznego rozkładu soli żelaza, np. szczawianu lub węglanu żelaza(II):
![]()
- Fe2O3 – tlenek żelaza(III) – powstający w wyniku termicznego rozkładu wodorotlenku lub soli żelaza(III):
![]()
Żelazo reaguje z chlorem. W wyniku takiej reakcji w podwyższonej temperaturze tworzy się chlorek żelaza(III):
![]()
Żelazo znajduje się w szeregu aktywności metali przed wodorem. Reaguje z kwasami słabo utleniającymi, takimi jak HCl i rozcieńczony H2SO4:
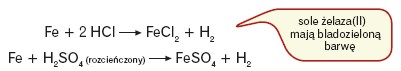
Żelazo nie reaguje z zimnymi, stężonymi kwasami siarkowym(VI) i azotowym(V); w kontakcie z tymi substancjami pokrywa się warstwą tlenków (pasywacja). W reakcji z gorącymi, stężonymi H2SO4 i HNO3 tworzy sole żelaza(III).
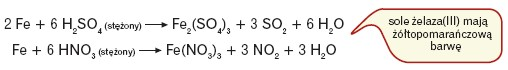
Żelazo tworzy dwa wodorotlenki: Fe(OH)2 i Fe(OH)3. Związki te można otrzymać w wyniku reakcji strąceniowych.
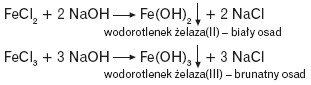
Wodorotlenek żelaza(II) na powietrzu szybko brunatnieje, przechodząc w wodorotlenek żelaza(III) pod wpływem działania tlenu zawartego w powietrzu:
![]()
Żelazo tworzy też liczne związki koordynacyjne, wśród nich najbardziej znane są związki z jonami z CN– i SCN–:
- Fe4[Fe(CN)6]3 – heksacyjanożelazian(II) żelaza(III), tzw. błękit pruski
- Fe3[Fe(CN)6]2 – heksacyjanożelazian(III) żelaza(II), tzw. błękit Turnbulla
Są to związki o niebieskiej barwie stosowane jako pigmenty.
[Fe(SCN)6]3– – anion heksatiocyjanianożelazianowy(III) występujący np. w K3[Fe(SCN)6],to związek o intensywnie krwistoczerwonej barwie, mający zastosowanie do wykrywania obecności i oznaczania stężenia i jonów żelaza(III).
