Berylowce reagują z tlenem. Magnez w reakcji z tlenem tworzy tlenek magnezu, podobnie jak wapń; bar i stront utworzą natomiast nadtlenki.
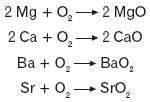
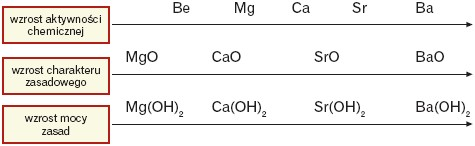
Wśród tlenków berylowców tylko tlenek berylu ma właściwości amfoteryczne, pozostałe mają charakter zasadowy. Tlenek berylu – w przeciwieństwie do innych tlenków berylowców – nie reaguje z wodą.
Nasycony roztwór Ca(OH)2 to woda wapienna. Woda wapienna służy do wykrywania tlenku węgla(IV). Zawiesina Ca(OH)2 w wodzie to mleko wapienne (układ nietrwały).
Wodorotlenki wapnia i magnezu mają charakter zasadowy. Wodorotlenek berylu ma właściwości amfoteryczne.
| związek | właściwości fizyczne | zastosowanie |
| Mg(OH)2 wodorotlenek magnezu |
biała, krystaliczna substancja trudno rozpuszczalna w wodzie | stosowany w przemyśle kosmetycznym,np. do produkcji past do zębów; jest też składnikiem leków neutralizujących nadmiar kwasów w żołądku |
| Ca(OH)2 wodorotlenek wapnia |
biała, krystaliczna substancja trudno rozpuszczalna w wodzie | stosowany do bielenia drzew i ścian budynków; jest też składnikiem zaprawy murarskiej; stosowany również do produkcji materiałów stomatologicznych |
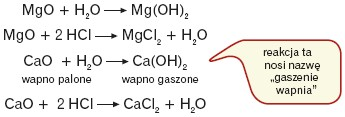
Wszystkie berylowce (z wyjątkiem berylu) tworzą mocne zasady. Wodorotlenki te można otrzymać w reakcjach:
- metali z wodą
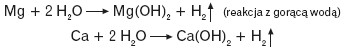
- tlenków metali z wodą
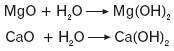
- strąceniowych
![]()
Węglany berylowców poddane prażeniu tworzą odpowiedni tlenek oraz CO2:
![]()
Analizując tablicę rozpuszczalności, można łatwo zauważyć, że rozpuszczalność wodorotlenków berylowców wzrasta, a rozpuszczalność siarczanów(VI) maleje w grupie wraz ze wzrostem liczby atomowej berylowca.
Berylowce tworzą związki chemiczne z wodorem, czyli wodorki. Wodorki berylowców to zwykle białe ciała stałe. Wodorki berylu i magnezu są kowalencyjne, wodorki wapnia, strontu i baru to wodorki typu soli. Wodorki wapnia i magnezu można otrzymać w wyniku bezpośredniej syntezy z pierwiastków, w odpowiednich warunkach ciśnienia i temperatury:
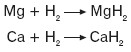
Wodorek wapnia łatwo reaguje z wodą.
![]()
Reakcja ta służy do otrzymywania wodoru.
W grupie berylowców ze wzrostem liczby atomowej wzrasta aktywność berylowca, charakter zasadowy tlenków i moc zasad (wyjątek: beryl).