Jest szczególnym przypadkiem wiązania kowalencyjnego. Wiązanie to nazywane jest wiązaniem donorowo - akceptorowym, gdyż tworząca je para elektronowa pochodzi od jednego z atomów zwanego donorem, a atom ją przyjmujący zwany jest akceptorem. Wiązanie to ilustruje się strzałką skierowaną od donora do akceptora.
![]()
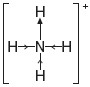
Kation wodoru potrzebuje 2 elektronów do spełnienia reguły dubletu, atom azotu w cząsteczce amoniaku posiada już 8 elektronów, czyli spełniona jest dla niego reguła oktetu. Atom azotu oddając swoją wolną parę elektronową (2 elektrony z 8) na„wspólne użytkowanie” z kationem wodoru nic nie traci, a kation wodoru dzięki temu zyskuje 2 elektrony.
W jonie amonowym NH4+ występują trzy wiązania atomowe spolaryzowane oraz jedno koordynacyjne.
Połączenie pomiędzy cząsteczką amoniaku (donor pary elektronowej) a cząsteczką fluorku boru (akceptor pary elektronowej) jest możliwe dzięki wiązaniu koordynacyjnemu. Cząsteczka BF3 reprezentuje przykład układu z tzw. niedoborem elektronów. Dla atomów fluoru jest spełniona reguła oktetu, a dla atomu boru – nie: atom boru ma teraz 6 elektronów, czyli do oktetu brakuje mu 2 elektronów.
![]()
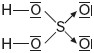
W cząsteczce kwasu siarkowego(VI) wiązania koordynacyjne występują pomiędzy atomem siarki i atomami tlenu.