| Harlequin ichthyosis | |
 | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|
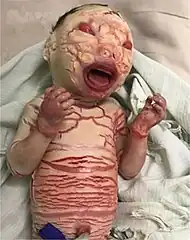
Płód arlekin (rybia łuska arlekinowa, płód arlekin, ang. Harlequin ichthyosis, HI, harlequin fetus, ichthyosis fetalis) – rzadka choroba genetyczna, o dziedziczeniu autosomalnym recesywnym. Rybia łuska arlekinowa należy do genodermatoz i razem z kilkoma podobnymi schorzeniami do grupy autosomalnie recesywnie dziedziczonej wrodzonej rybiej łuski (ang. autosomal recessive congenital ichthyosis, ARCI). Obraz kliniczny charakteryzuje się pokrywającymi całą powierzchnię skóry łuskami hiperkeratotycznego naskórka o kształcie rombów i wielokątów, o ułożeniu przywodzącym na myśl kostium arlekina – stąd nazwa jednostki chorobowej. Ponadto stwierdza się niską masę urodzeniową, erytrodermię, wywinięcie warg (eclabium) i powiek (ektropion). Z powodu utraty wody i sepsy oraz nieprawidłowej termoregulacji noworodek umiera zwykle w ciągu tygodnia. Przynajmniej część przypadków wiąże się z mutacjami genu ABCA12 na chromosomie 2[2].
Epidemiologia
W piśmiennictwie przedstawiono do tej pory więcej niż 100 przypadków choroby. Częstość jest wyższa w zamkniętych społecznościach, gdzie dochodzi do związków między blisko spokrewnionymi osobami; wśród Indian Nawaho w Gallup w Nowym Meksyku między 1970 a 1989 urodziło się pięcioro dzieci z tym schorzeniem, co daje częstość rzędu 1:5000 żywych urodzeń[3].
Etiologia
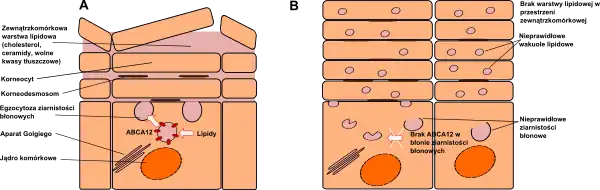
Rybia łuska arlekinowa spowodowana jest mutacjami powodującymi utratę funkcji białka transportującego lipidy w ziarnistościach błonowych keratynocytów. Zanim zdefiniowano defekt molekularny leżący u podłoża choroby, wiedziano, że mutacje punktowe genu ABCA12 są związane z wrodzoną rybią łuską blaszkowatą dziedziczoną autosomalnie recesywnie (OMIM#601277). W rybiej łusce arlekinowej mutacje mają charakter dużych delecji lub mutacji nonsensownych, skutkujących skróceniem łańcucha polipeptydowego ABCA11 (protein truncation). Rybia łuska blaszkowata i rybia łuska typu arlekinowego są zatem schorzeniami allelicznymi.
Mikroskopowo stwierdzono, że ziarnistości błonowe nie są właściwie formowane, a lipidy niezbędne do utworzenia prawidłowej warstwy rogowej naskórka (np. glukozyloceramid) ulegały nieprawidłowej sekrecji.
Mutacje w genach białek o podobnej budowie, ABCA1 i ABCA4, wywołują, odpowiednio, chorobę wyspy Tangier i chorobę Stargardta. Mutacje genu ABCA3 skutkują letalnym zaburzeniem metabolizmu surfaktantu (ASMDP3, OMIM#610921).
Objawy i przebieg
Objawy zespołu obecne są od urodzenia. Na jego obraz kliniczny składają się:
- bardzo pogrubiała skóra z dużymi, błyszczącymi łuskami, romboidalnego lub wielokątnego kształtu, jasnej barwy, wielkości 4–5 cm, rozdzielonymi czerwonymi rozpadlinami;
- obustronny ciężki ektropion, powieki górne i dolne są wywinięte, często ulegają urazom i wysuszeniu;
- wywinięte wargi (eclabium), otwarte usta: dziecko nie może prawidłowo przyjmować matczynego pokarmu;
- inne cechy pseudodysmorficzne twarzy (wtórne do zmian skórnych): spłaszczenie nosa, małżowiny uszne mogą być małe, szczątkowe lub nieobecne;
- przykurcze stawów i ułożenie zgięciowe kończyn spowodowane zmianami skórnymi;
- mikrocefalia;
- niekiedy hipoplazja palców dłoni i stóp, hipoplazja paznokci, opisywano polidaktylię;
- nieprawidłowości budowy ośrodkowego układu nerwowego objawiające się niekiedy drgawkami.
Leczenie i rokowanie
Leczenie jest zachowawcze, a rokowanie zwykle bardzo złe. Jedne z dłuższych opisanych okresów przeżycia to 22 miesiące[5], 2,5 roku u dziecka leczonego etretynatem[6], 9 lat[7] i 29 lat[8].
W leczeniu podtrzymującym stosuje się nawadnianie, pielęgnację skóry i błon śluzowych, oraz podaż silnych leków przeciwbólowych (np. opioidów), ponieważ dziecko ma prawidłowo rozwinięty układ nerwowy i odpowiedź bólową na uszkodzenie tkanek[9].
Rozpoznanie
Rozpoznanie opiera się na obrazie klinicznym. Niekiedy możliwe jest rozpoznanie prenatalne zespołu; dawniej oparte na fetoskopowej biopsji skóry, obecnie coraz częściej na stwierdzeniu w USG charakterystycznych, chociaż nieswoistych objawów: płaskiego profilu twarzy, dużych ust, hipoplazji nosa, dysplastycznych małżowin usznych, obrzęku ud i stóp, wewnątrzmacicznego zahamowania wzrostu. Dodatni wywiad rodzinny w kierunku HI powinien ukierunkować ultrasonografistę na drobne, ale znaczące objawy zespołu[10].
Różnicowanie
W diagnostyce różnicowej powinny być uwzględnione inne choroby z grupy autosomalnie recesywnie dziedziczonej wrodzonej rybiej łuski (ARCI)[11]:
- zespół dziecka kolodionowego (collodion baby),
- rybia łuska blaszkowata (classic lamellar ichthyosis, LI),
- wrodzony niepęcherzowy rumień skóry podobny do rybiej łuski (nonbullous congenital ichthyosiform erythroderma, NCIE).
Wszystkie choroby z grupy ARCI różnicuje się ponadto z następującymi jednostkami chorobowymi:
- zespół Sjögrena-Larssona
- zespół Nethertona
- choroba Gauchera
- zespół keratitis-ichthyosis-głuchota (zespół KID)
- trichotiodystrofia
- zespół Chanarina-Dorfmana
- zespół Conradiego-Hünermanna
- hipohydrotyczna dysplazja ektodermalna
- rybia łuska zwykła
- niedobór sulfatazy steroidowej.
Historia
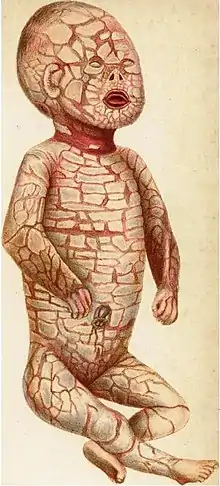
Pierwszy opis choroby autorstwa wielebnego Olivera Harta z Charleston pochodzi z roku 1750[12]:
W czwartek 5 kwietnia 1750, udałem się zobaczyć najbardziej godne pożałowania dziecko, urodzone ostatniej nocy z Mary Evans w Charleston. Wszyscy którzy je widzieli byli zdumieni, i ja też ledwo wiedziałem jak to opisać. Skóra była sucha i twarda, i wyglądała jak popękana na małe kawałki, nieco przypominając łuski ryby. Usta były duże, okrągłe i otwarte. Nie miało nosa zewnętrznego, ale dwa otwory w miejscu gdzie powinien znajdować się nos. Oczy wydawały się być kawałkami skrzepłej krwi, wybałuszone, wielkości śliwek, stanowiąc przerażający widok. Nie było uszu zewnętrznych, tylko otwory gdzie powinny się znajdować. Dłonie i stopy wyglądały na opuchnięte, były skurczone i dosyć twarde. Tylna część głowy była otwarta. Wydawało dziwny krzyk, bardzo niski, którego nie potrafię opisać. Żyło około 48 godzin i było jeszcze przy życiu gdy je zobaczyłem.
W XIX wieku przedstawiono szczegółowe opisy przypadków dotkniętych chorobą dzieci: Hebra nazwał ją wrodzoną rybią łuską, Ludwik Siewruk – wrodzoną hipertrofią naskórka[13], Eduard Kyber wprowadził termin keratoma diffusa[14], a Vrolik – cutis formatio prteternatucralis[15]. Autorem terminu "płodu arlekina" był Samuel Wilks[16].
Przypisy
- ↑ JB. Sutton. A Case of General Seborrhœa or "Harlequin" Fœtus.. „Med Chir Trans”. 69, s. 291-296.1, 1886. PMID: 20896676. PMCID: PMC2121560.
- ↑ Kelsell DP, Norgett EE, Unsworth H, Teh MT, Cullup T, Mein CA, Dopping-Hepenstal PJ, Dale BA, Tadini G, Fleckman P, Stephens KG, Sybert VP, Mallory SB, North BV, Witt DR, Sprecher E, Taylor AE, Ilchyshyn A, Kennedy CT, Goodyear H, Moss C, Paige D, Harper JI, Young BD, Leigh IM, Eady RA, O'Toole EA. Mutations in ABCA12 underlie the severe congenital skin disease harlequin ichthyosis. „Am J Hum Genet”. 76, s. 794-803, 2005. PMID: 15756637.
- ↑ Patricia N. Olney, Richard S. Olney. Harlequin Ichthyosis among the Navajo: Counseling issues. „Journal of Genetic Counseling”. 2. 1, 1993. DOI: 10.1007/BF00962555.
- ↑ Hovnanian A. Harlequin ichthyosis unmasked: a defect of lipid transport. „J Clin Invest”. 115. 7, s. 1708-10, 2005. DOI: 10.1172/JCI25736. PMID: 16007249.
- ↑ Prasad RS, Pejaver RK, Hassan A, Al Dusari S, Wooldridge MA. Management and follow up of harlequin siblings. „Br J Dermatol”. 130, s. 650-653, 1994. PMID: 8204475.
- ↑ Lawlor F. Progress of Harlequin fetus to nonbullous ichthyosiform erythroderma. „Pediatrics”. 82, s. 870-873, 1988.
- ↑ Roberts LJ. Long term survival of a harlequin fetus. „J Am Acad Dermatol”. 21, s. 335-339, 1989. PMID: 2754067.
- ↑ My Skin Could Kill Me - Harlequin Ichthyosis - Extraordinary Children, „Extraordinary Children”, 2 lipca 2015 [dostęp 2016-11-19] [zarchiwizowane z adresu 2016-11-20] (ang.).
- ↑ Zapałowicz K, Wygledowska G, Roszkowski T, Bednarowska A. Harlequin ichthyosis--difficulties in prenatal diagnosis. „J Appl Genet”. 47. 2, s. 195-197, 2006. PMID: 16682764.
- ↑ Berg C, Geipel A, Kohl M, Krokowski M, Baschat AA, Germer U, Gembruch U. Prenatal sonographic features of Harlequin ichthyosis. „Arch Gynecol Obstet”. 268. 1, s. 48-51, 2003. PMID: 12673476.
- ↑ Sherri J Bale, Gabriele Richard: Autosomal Recessive Congenital Ichthyosis. GeneReviews.
- ↑ Waring JI. Early mention of a harlequin fetus in America. „Am J Dis Child”. 43, s. 442, 1932.
- ↑ Siewruk: De congenita epidermidis hypertrophia. Moskwa: 1843.
- ↑ Kyber E. Eine Untersuchung uber das universale diffuse congenitale Keratom der menschlichen Haut. „Medizinische Jahrbucher”, s. 397, 1880.
- ↑ Vrolik W: Tabule ad illustrandam embryogenesin hominis et mammalium. Amsterdam: 1849.
- ↑ Wilks S, Moxon W: Lectures on pathological anatomy. Wyd. 2nd ed. Londyn: Churchill, 1875, s. 596.
Linki zewnętrzne
- Ichthyosis Congenita, Harlequin Fetus Type w bazie Online Mendelian Inheritance in Man (ang.)
- Sheila Au: Ichthyosis Fetalis. eMedicine Dermatology. (ang.).
- Sherri J Bale, Gabriele Richard: Autosomal Recessive Congenital Ichthyosis. GeneReviews. [zarchiwizowane z tego adresu (2009-01-24)].
- DermAtlas. [dostęp 2007-12-22]. [zarchiwizowane z tego adresu (2007-07-01)].
- S. Boopathy Vijayaraghavan: Congenital icthyosis. TheFetus.net.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.