| |||||||||||||
 | |||||||||||||
| |||||||||||||
| Ogólne informacje | |||||||||||||
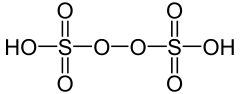
| Wzór sumaryczny |
H2S2O8 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
HO3SOOSO3H | ||||||||||||
| Masa molowa |
194,14 g/mol | ||||||||||||
| Wygląd |
bezbarwne ciało stałe | ||||||||||||
| Identyfikacja | |||||||||||||
| Numer CAS | |||||||||||||
| PubChem | |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| Podobne związki | |||||||||||||
| Podobne związki | |||||||||||||
| Pochodne |
nadtlenodisiarczany (nadsiarczany) | ||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||
Kwas nadtlenodisiarkowy (kwas nadsiarkowy), H
2S
2O
8 – nieorganiczny związek chemiczny z grupy kwasów tlenowych. Otrzymywany przez elektrolityczne utlenianie kwasu siarkowego na elektrodach platynowych. Sole tego kwasu to nadsiarczany (np. nadsiarczan amonu).
Właściwości
- stosunkowo trwały w suchym powietrzu
- bezbarwna substancja krystaliczna o silnych własnościach utleniających
- reaguje wybuchowo z substancjami organicznymi
- w roztworach wodnych ulega hydrolizie w której wyniku powstaje kwas nadtlenosiarkowy (kwas Caro, H
2SO
5)
Zastosowanie
- do produkcji barwników
- w analizie chemicznej
- jako półprodukt do otrzymywania nadtlenku wodoru (pod wpływem wody ulega rozkładowi z wydzieleniem H2O2)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.