| Turdus merula[1] | |||||
| Linnaeus, 1758 | |||||
%252C_%D0%91%D0%B8%D1%82%D1%86%D0%B5%D0%B2%D1%81%D0%BA%D0%B8%D0%B9_%D0%BB%D0%B5%D1%81.jpg.webp) Samiec | |||||
| Systematyka | |||||
| Domena | |||||
|---|---|---|---|---|---|
| Królestwo | |||||
| Typ | |||||
| Podtyp | |||||
| Gromada | |||||
| Podgromada | |||||
| Infragromada | |||||
| Rząd | |||||
| Podrząd | |||||
| Rodzina | |||||
| Podrodzina | |||||
| Rodzaj | |||||
| Gatunek |
kos | ||||
| |||||
| Podgatunki | |||||
| |||||
| Kategoria zagrożenia (CKGZ)[12] | |||||
 | |||||
| Zasięg występowania | |||||
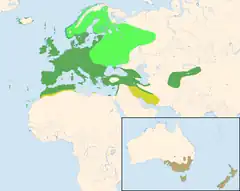 siedliska całoroczne obszary lęgowe przez większą część roku zimowiska obszar introdukcji | |||||
Kos[13] (Turdus merula) – gatunek średniej wielkości ptaka częściowo wędrownego z rodziny drozdowatych (Turdidae). W Europie jest jednym z najbardziej rozpowszechnionych członków tej rodziny, jest też jednym z najbardziej znanych ptaków. Długość ciała wynosi od 24 do 27 cm. Samce są zabarwione na czarno z żółtym dziobem. Upierzenie samic jest w dużej części ciemnobrązowe. Głośne i melodyjne pieśni godowe można usłyszeć w Europie Środkowej pomiędzy początkiem marca a końcem lipca już przed świtem, a także wieczorem i czasem w ciągu dnia.
Kosy gniazdują w niemal całej Europie poza daleką północą i krańcami południowo-wschodnimi. Poza tym zamieszkują fragmenty Afryki Północnej i Azji, głównie Bliski Wschód i Azję Środkową. Zostały introdukowane w Australii i Nowej Zelandii. W Europie Środkowej część ptaków opuszcza na zimę tereny lęgowe i wędruje do Europy Południowej oraz Afryki Północnej.
Pierwotnie kos był ptakiem leśnym. W dalszym ciągu można go spotkać w lasach, jednak w XIX stuleciu rozpoczął się proces synurbizacji. Kosy, zasiedlając początkowo parki i ogrody w pobliżu osad ludzkich, wkrótce przeniosły się także do centrów miast. Pożywienia szukają zwykle na ziemi. Odżywiają się przeważnie pokarmem zwierzęcym, głównie dżdżownicami i chrząszczami. Chętnie zjadają też jagody i inne owoce. Budują gniazda zazwyczaj wśród gałęzi drzew i krzewów.
Systematyka
Kos został opisany przez Linneusza w dziesiątej edycji jego Systema Naturae w 1758 jako Turdus merula (opisany jako T. ater, rostro palpebrisque fulvis)[14]. Binominalna nazwa pochodzi od dwóch łacińskich słów: turdus = „drozd” i merula = „kos”. Pierwsi przedstawiciele rodzaju Turdus pochodzą ze wschodniej Palearktyki z późnego miocenu. We wczesnym pliocenie rodzaj Turdus rozprzestrzenił się na Afrykę i stamtąd na pozostałe kontynenty, jednocześnie podlegając radiacji adaptacyjnej. Prawdopodobnie w środkowym pliocenie wyodrębnił się kos. Jest rzeczą dyskusyjną, z którymi drozdami z rodzaju Turdus kosy są najbliżej spokrewnione[15]. Według Clementa kos jest najbliższy ewolucyjnie do zamieszkującego Azję Południowo-Wschodnią i wyspy południowo-zachodniego Pacyfiku drozda wyspowego (T. poliocephalus)[16]. Według Voelkera kosy należą do euroazjatyckiego kladu w obrębie rodzaju Turdus i są uważane za klad bazalny tej grupy, choć brak jest jednoznacznego potwierdzenia przez badania genetyczne[17]. Według analiz Nylandera kosy, wraz z również zamieszkującymi Eurazję droździkami (T. iliacus), należy zaliczyć do jednego kladu z południowoamerykańską grupą drozdów[15].
IOC wyróżnia obecnie siedem podgatunków kosa: T. m. merula, T. m. azorensis, T. m. cabrerae, T. m. mauritanicus, T. m. aterrimus, T. m. syriacus i T. m. intermedius[18].
Na początku XXI wieku z gatunku Turdus merula wyodrębniono trzy nowe gatunki:
- drozd himalajski (Turdus maximus)
- drozd indyjski (Turdus simillimus)[19][20][15]
- drozd okopcony (Turdus mandarinus)[18]
Na kariotyp kosa składa się 40 par chromosomów (wliczając w to chromosomy płci, co daje 2n=80). Długość chromosomów wynosi od 4,2 μm do 0,4 μm. Chromosom płciowy Z jest metacentryczny i mierzy 2,6 μm, zaś chromosom W jest telocentryczny i ma długość 1,4 μm[21] (system determinacji płci ZW).
Charakterystyka

Dorosłe kosy wykazują wyraźny dymorfizm płciowy. Upierzenie samców jest jednolicie czarne, dziób krzykliwie jasnożółty do pomarańczowego. Samce mają też wyraźną obrączkę oczną o podobnym do dzioba kolorze, tylko nieco bardziej brązowawą. Obrączka oczna kontrastuje silnie z ciemnobrązową tęczówką[22]. Intensywność barwy jest związana z metabolizmem karotenoidów i świadczy o zdrowiu ptaka[23]. Mniej odznaczające się są obrączki oczne u samic. Także dziób ma bardziej stonowaną barwę. Kolorystyka upierzenia samic jest bardziej zróżnicowana, oliwkowobrązowa, miejscami wpadająca w szarość i kolor czerwonobrązowy. Obie płcie mają ciemnobrązowe nogi i pazury[22][24]. W porównaniu z także ciemno upierzonymi i często przebywającymi na ziemi szpakami kosy są nieco większe i mają wyraźnie dłuższy ogon[25].
Upierzenie dorosłych kosów
.jpg.webp)
Upierzenie dorosłych samców jest jednolicie czarne. Przede wszystkim na spodzie ciała, ale też na plecach pióra mają nierzadko szare lub brązowawe końcówki. Można to zauważyć jednak tylko w odpowiednim oświetleniu. Upierzenie przypomina wtedy nieco łuski gada[22][26]. Pióra konturowe mogą rozjaśniać się wiosną[22].
Samice z wierzchu są zabarwione na ciemny kolor oliwkowobrązowy do oliwkowoszarego. Czoło jest często nieco ciemniejsze. Zabarwienie jaśniejszego spodu ciała może być bardzo różne u poszczególnych osobników. Podgardle jest jasne, brudnoszare do czerwonawobrązowego z ciemniejszym prążkowaniem. Pierś jest brązowoszara, żółtobrązowa do czerwonobrązowej, bardziej lub mniej pstrokata. Brzuch jest brązowy, szarobrązowy lub szary z jaśniejszymi końcówkami piór, wyraźnie przypominającymi łuski. Pióra ogona są ciemno- do czarnobrązowych, sterówki i lotki ciemnobrązowe z oliwkowymi chorągiewkami zewnętrznymi[22].
Młode ptaki i pierzenie
Młode ptaki po wylocie z gniazda są podobne do samic. Spód ciała mają bardziej plamisty a pióra grzbietu i pokryw skrzydeł posiadają rzucające się w oczy, jasne osie. Dziób jest brązowy. Upierzenie skrzydeł i ogona wydaje się wyraźnie oddzielone od reszty. U młodych samców jest ciemnobrązowe do brunatnoczarnego, u młodych samic nieco jaśniejsze, przechodzące w brąz[22][26].

Młode ptaki pierzą się po raz pierwszy w roku urodzenia między latem a jesienią. Wymieniają wtedy pióra konturowe korpusu i część piór skrzydeł[26]. U samców, które wykluły się wczesną wiosną, podległe pierzeniu partie piór stają się brązowoczarne lub czarne, w odróżnieniu od młodzieńczych, brązowych piór na ogonie i części korpusu. Samce, które wykluły się później, uzyskują ten pośredni pomiędzy młodzieńczym a dorosłym wygląd w następnym roku. Także u jednorocznych samic widoczna jest różnica pomiędzy zmienionymi a niezmienionymi partiami upierzenia. Te ostatnie są wyraźnie jaśniejsze[22].
Regularne, całkowite pierzenie rozpoczyna się z reguły dwa tygodnie po wyprowadzeniu młodych. W Europie pierzenie następuje zwykle pomiędzy czerwcem a końcem października. Prawie wszystkie dorosłe kosy pierzą się w sierpniu[27][24].
Odmienne zabarwienia

Typowy dla drozdów plamkowany wzór na upierzeniu można rozpoznać też u kosów, choć u samców jest on przykryty przez intensywne odkładanie się melanin w piórach. Można więc traktować melanizm jako charakterystyczną dla tego gatunku adaptację. Nietypowe jest natomiast zmniejszenie ilości pigmentu lub jego utrata. Może ono występować w rozmaitych formach i stopniach intensywności. Związana z albinizmem zmniejszona zawartość melanin w piórach prowadzi do wystąpienia ziemistego zabarwienia. W pełni albinotyczne białe ptaki z czerwonymi oczami, w związku ze swoją zmniejszoną zdolnością widzenia, praktycznie nie mają szansy przeżycia w naturze. Białe zwierzęta z brązowymi lub czarnymi oczami są leucystyczne. Stłumiony leucyzm prowadzi do łaciatego ubarwienia[28][29].
W niektórych latach łaciate ptaki występują często na danym obszarze. Powstałe symetryczne lub niesymetryczne wzory na upierzeniu są bardzo różnorodne. To białe zabarwienie może być zaburzeniem odziedziczonym lub występującym podczas rozwoju piór – eksperymentalnie dowiedziono, że białe pióra mają związek z odżywianiem się, przede wszystkim w okresie pierzenia. Pokarm ubogi w białko faworyzuje wystąpienie albinizmu[29].
Zmienione ubarwienie jest obecnie obserwowane przede wszystkim u ptaków na terenach zaludnionych. Było ono jednak znane na długo przed tym, jak kosy zamieszkały w pobliżu człowieka. O białych kosach pisał już Arystoteles[22].
Rozmiary i masa ciała
Osiągając długość ciała pomiędzy 24 a 27 centymetrów, są kosy podgatunku T. m. merula tylko nieznacznie mniejsze od paszkota, największego ze środkowoeuropejskich drozdów[30]. Samce są nieco większe niż samice. Długość skrzydeł samców wynosi średnio 133 mm, a samic 128 mm[22]. Odpowiada to rozpiętości skrzydeł pomiędzy 34 a 38,5 centymetrów[31]. Długość ogona wynosi od 104 do 116 milimetrów[22]. Czaszka ma długość od 47 do 52 mm, z czego 23–27 mm przypada na dziób[32].
U europejskich kosów obserwuje się znaczne różnice masy ciała w poszczególnych porach roku[33]. Na podstawie wieloletnich, przeprowadzonych w Wielkiej Brytanii obserwacji ustalono, że masa ciała może wynosić od 71 do 150 gramów. Dorosłe samce mają masę przeciętnie 102,8 grama. Dorosłe samice są nieco lżejsze (100,3 grama). Jednoroczne ptaki są przeciętnie o 3 gramy lżejsze. Jedynie w porze składania jaj samice są nieco cięższe od samców. Największą masę środkowoeuropejskie kosy mają w styczniu, najmniejszą w lipcu lub sierpniu, po porze godów. Przyrost masy jest rezultatem magazynowania rezerw tłuszczu[34].
Występowanie
Kosy zasiedlają niemal całą Europę. W Azji i północnej Afryce występują przeważnie wyspowo, sięgając na wschodzie gór Azji Środkowej. Kosy zostały introdukowane w Australii i Nowej Zelandii i stamtąd bez udziału człowieka zasiedliły okoliczne wyspy. Na większości obszaru występowania kosy są ptakami częściowo wędrownymi. Na dalekiej północy migrują prawie wszystkie ptaki, w przeciwieństwie do osiadłych populacji południowych. W niektórych okolicach ptaki na zimę zlatują do cieplejszych i niżej położonych miejsc, ale także w Alpach i Karpatach niektóre ptaki pozostają na wysoko położonych terenach lęgowych[35].
Środowisko

Kosy, gatunek drozdów o najciemniejszym upierzeniu, zamieszkiwały pierwotnie wnętrza wilgotnych, gęstych lasów. Także dzisiaj gniazdują w ciemnych lasach z bujnym podszytem, szukając pożywienia na pozbawionej wegetacji lub porośniętej niską roślinnością ziemi. W takim siedlisku nadzwyczajnie dobre, jak na ptaki śpiewające, widzenie po zmroku jest dużą zaletą. Z drugiej strony ptaki te zamieszkują dzisiaj ruchliwe centra wielkich miast, przez co mówi się o populacjach kosów leśnych i miejskich[36].

_-_Turdus_merula_(016f).jpg.webp)
Kos zamieszkuje dzisiaj prawie wszystkie rodzaje krajobrazu kulturowego, w tym ogrody, parki, skwery, ogródki działkowe, dzielnice willowe, grupy drzew i krzewów na obszarach przemysłowych, sady, porośnięte krzewami wrzosowiska, a także otwarte pola, o ile osłonięte są czyżniami lub żywopłotami. Obok zbliżonych do natury starych lasów pierwotnych zamieszkuje także monokulturowe lasy gospodarcze, przy czym preferowane są lasy liściaste względem borów. Kosy gniazdują także w szuwarach[37]. Szukające pożywienia na ziemi ptaki nie oddalają się nigdy zbyt daleko od oferujących schronienie zarośli[36]. Poza nielicznymi wyjątkami wielkość opadów na zajmowanych przez kosy obszarach przekracza 300 mm rocznie[38].
Najwyższe zagęszczenie populacji występuje w miastach, gdzie nierzadko osiąga cztery lub więcej gniazdujących par na hektar. Na cmentarzu w Ravensburgu w następujących po sobie latach gniazdowało od pięciu do siedmiu par na hektar[37]. Zagęszczenie w lasach jest wyraźnie mniejsze i rzadko przekracza 0,5 pary na hektar. Na obszarach wiejskich przyjmuje wartości pośrednie między lasem a miastem[36].
Kosy zasiedliły także lasy górskie. W Alpach występują po górną granicę lasu. W Atlasie Wysokim można je spotkać do wysokości 2300 metrów[38]. W polskich Karkonoszach występują na obszarach położonych do 1200 m n.p.m., a w Tatrach – do 1400 m n.p.m.[39]
Naturalne rozprzestrzenienie
Najdalej na zachód kosy występują na Azorach, Wyspach Kanaryjskich i Maderze. W Afryce Północnej zamieszkują obszar pomiędzy Morzem Śródziemnym a Saharą od Maroka do Tunezji, a czasami także bardziej na południe, w pustynnych oazach. Gniazdują w prawie całej Europie, włączając Wyspy Brytyjskie i Wyspy Owcze. Na Islandii pierwsze gniazdo zaobserwowano w 1985. Północna granica zasięgu znajduje się na 70° szerokości północnej w Skandynawii i na 60° dalej na wschód w Rosji. Na wschodzie Ural stanowi granicę obszaru występowania. Pozbawiony kosów jest również obszar Europy na południowy wschód od linii łączącej Krym z południowym Uralem[40].
Zachodnia część azjatyckiego obszaru występowania obejmuje Azję Mniejszą i wschodnie wybrzeża Morza Śródziemnego. Jego północna granica przebiega od Krymu przez Nizinę Kubańską, Stawropol i północny Kaukaz po południowe wybrzeże Morza Kaspijskiego. Południowa granica leży na wschód od Morza Śródziemnego mniej więcej na 34. równoleżniku. Dalej na wschód znajdują się kolejne, odseparowane obszary występowania w górach Zagros, Elburs i Kopet-dag oraz dalej na wschód w Ałaju, Tienszanie i Hindukuszu[30][40].
Synurbizacja
W początkach XIX wieku kosy zaczęły wkraczać do ludzkich osad. Nastąpiło to niezależnie od siebie w kilku ośrodkach, z których następnie ptaki kolonizowały inne miasta. Kosy przybywały do miast w pierwszej kolejności na terenach, na których przez długi czas utrzymywał się wysoki poziom urbanizacji i utrzymywała się wysoka liczebność leśnych populacji. Początkowo ptaki jedynie zimowały na terenach zurbanizowanych[41]. Hamującym czynnikiem synurbizacji są polowania mające jeszcze miejsce na przykład w południowej Francji. Jednym z czynników zachęcających do osiedlania się jest łagodniejszy mikroklimat w miastach. Poza tym sztuczne oświetlenie pozwala na przedłużenie okresu gniazdowania oraz przez cały rok dostępne są źródła pokarmu[42]. Do osiedlania się zachęcały też zmiany zachodzące w środowisku miejskim – zakładanie parków, sadzenie krzewów oraz rozpowszechnienie dokarmiania ptaków zimą. Miejskie kosy wykazują cechy genetycznego przystosowania do środowiska takie jak mniejsze wydzielanie kortykosteronu pod wpływem stresu i bardziej osiadły tryb życia z mniejszą skłonnością do migracji[41].
W bawarskim Bambergu i pobliskim Erlangen odnotowano miejskie kosy już w 1820[41]. Z kolei pierwsza wzmianka o stałym przebywaniu kosów w mieście pochodzi z 1828 i dotyczy Rzymu[43]. Około roku 1890 zasiedliły duże miasta Dolnego Śląska[39]. W Londynie zadomowiły się w dużych parkach dopiero w latach trzydziestych XX wieku[42]. Do roku 2000 zasiedliły miasta w dużej części swojego obszaru występowania. W Europie niezasiedlone pozostawały miasta wschodniej Litwy, Białorusi, Rosji i południowej Francji[41].
Introdukcje
Pierwsze kosy na kontynencie australijskim zostały przywiezione w roku 1857 do Melbourne. Być może już wówczas niektóre z nich zostały wypuszczone na wolność. W następnych latach, aż po wiek XX, udokumentowano wiele wypuszczeń tych ptaków. Można się spodziewać, że było również wiele nieudokumentowanych wypuszczeń przez osoby prywatne. Główny obszar występowania w Australii leży w południowo-wschodniej części kontynentu, na południe od 33., 34. równoleżnika. Kosy wkraczają coraz dalej na północ. Na południe od kontynentu występują także na Tasmanii i wyspach Cieśniny Bassa. Kosy uważane są w wielu częściach Australii za szkodniki, powodujące szkody w plantacjach owoców, ogrodach i winnicach, i często tępione przez właścicieli plantacji[31].
W latach 60. XIX wieku introdukowano kosy w Nowej Zelandii. Liczne ptaki zostały wypuszczone na Wyspie Północnej i Wyspie Południowej. Obecnie zamieszkują, oprócz całego obszaru obu głównych wysp, także okoliczne wysepki[31]. Możliwe, że tamtejsze kosy ułatwiają rozprzestrzenianie introdukowanych gatunków roślin[44].
Wiadomo o nieudanych próbach introdukcji kosów w Ameryce Północnej, południowej Afryce oraz na wyspach Świętej Heleny i Fidżi[31].
Wędrówki

W Europie udział wędrujących osobników jest największy na północy i wschodzie kontynentu. W Szwecji migruje 76 procent, a w Finlandii 89 procent osobników populacji. W Europie Środkowej na zimowiska wyrusza tylko 25% osobników. Wędrówka odbywa się głównie w kierunku południowo-zachodnim. Wędrujące ptaki zasilają zimą populacje w zachodniej i południowej części kontynentu[45]. Przykładowo ptaki gniazdujące w Badenii-Wirtembergii zimują w północnych Włoszech, północnej Hiszpanii, a przede wszystkim w południowo-zachodniej i południowej Francji. Ich ulubiony zimowiskiem jest dolina dolnego Rodanu[37].
Na obszarach zaludnionych udział migrujących kosów jest niższy niż w lasach. Na zimowiska wyrusza też mniej samców niż samic. Starsze samce jeszcze częściej pozostają na lęgowiskach. Samce, które pozostały na zimę, mogą liczyć na większy sukces rozrodczy niż odlatujące ptaki. Pozostanie na terenie lęgowym wiąże się wprawdzie z wyższą śmiertelnością, ale osiadłe samce mogą zająć lepsze terytoria[35][46]. Badania przeprowadzone w latach 1998–2000 w rejonie Monachium sugerują, że mniejsza chęć do wędrówek miejskich kosów może być już warunkowana genetycznie[47].
W lipcu w Europie Środkowej zaczynają się pierwsze wędrówki kosów. Podejmują je młode ptaki, które opuszczają gniazda w poszukiwaniu własnych terytoriów. W drugiej połowie września zaczynają się migracje kosów na zimowiska. Ich szczyt przypada na środek października. Pod koniec października natężenie migracji się zmniejsza i wygasa w listopadzie. Przy ekstremalnej pogodzie zimą pozostałe na terenach gniazdowych ptaki mogą zdecydować się na ucieczkę przed zimnem. Powrót z zimowisk następuje w Europie Środkowej między połową lutego a połową kwietnia[37].
Kosy wędrują głównie nocą lub we wczesnych godzinach porannych. Podróż przebiega w małych etapach z częstymi, ale krótkimi przerwami. Pogoda nie ma wielkiego wpływu na wędrówkę. Wędrujące kosy pokonują takie przeszkody jak Morze Północne, Morze Śródziemne czy Alpy[35].
Kosy w Australii i Nowej Zelandii są prawie wyłącznie osiadłe. Nieliczne obserwacje świadczą o ich migracjach. Niektóre ptaki mogą przekraczać Cieśninę Bassa[31].
Pożywienie

Kosy odżywiają się różnymi rodzajami pokarmu. Do początku sezonu lęgowego kosy żywią się prawie wyłącznie pokarmem zwierzęcym: głównie bezkręgowcami, spośród których preferują dżdżownice i chrząszcze. Polują na chrząszcze nieprzekraczające rozmiarami chrabąszcza majowego. Regularnie zjadane są również ślimaki, pijawki, wije, pajęczaki oraz różne stadia owadów. Obok licznych innych bezkręgowców do spektrum żywieniowego wliczają się także niewielkie kręgowce, między innymi jaszczurkowate, płazy ogoniaste i bezogonowe, myszy i ryjówkowate, a w wyjątkowych przypadkach również węże. Zaobserwowano nawet kosy łowiące ryby[48][49]. W przypadku braku pożywienia kosy muszą się zadowalać mniejszymi owadami, jak na przykład mszycami[50].
W Europie Środkowej w diecie kosów od połowy maja rośnie udział jagód i owoców. Udział ten może być u kosów największy ze wszystkich drozdów[37]. Jesienią i zimą zjadają głównie jagody oraz miękkie owoce[51]. Preferowane są owoce najbardziej dojrzałe i zawierające najwięcej cukru. Udział soczystych owoców w diecie osiąga maksimum od października do listopada. W winnicach i sadach mogą powstawać w tym czasie duże stada kosów. Zimą w Europie owoce bluszczu pospolitego stanowią jedyne dostępne dla kosów pożywienie roślinne. W okresach braku żywności kosy na obszarach zamieszkałych korzystają też z karmników. Zjadają wtedy duże ilości ziaren, te są jednak prawie nie trawione, podobnie jak ziarna zjadanych owoców. Kosy szukają pożywienia również wśród śmieci[50].
Kosy szukają pożywienia skacząc po ziemi. Charakterystyczne dla poszukiwania pożywienia na ziemi jest podskakiwanie na krótkich odcinkach zakończone zatrzymaniem się, podczas którego kos przechyla głowę, ustala punkt i błyskawicznie uderza weń dziobem. Można też zaobserwować jak kosy szybkimi dziobnięciami chwytają suche liście, przekręcają je i odrzucają na bok. Oprócz jagód i innych owoców leżących na ziemi zbierane są one także z drzew i krzewów lub czasami strząsane w krótkim locie[48][52]. Kosy potrafią, podobnie jak inne drozdy, wyjeść miąższ owocu i pozostawić samą skórkę[53]. Kosy tworzą wypluwki[54]. Jest wiele obserwacji niezwykle wyglądających zwyczajów żywieniowych kosów. Wlicza się tu plądrowanie gniazd innych gatunków drozdów i łuszczaków oraz pożeranie wypadłych z gniazd młodych wróbli. Zjadana jest też padlina. Znane są raporty o koprofagii i kanibalizmie[48].
Kosy piją rzadko, gdyż przyjmowany pokarm z reguły zawiera wystarczającą ilość wody. Podczas picia wchodzą po brzuch do płytkiej wody i zanurzają w niej dziób[48]. W dość płynnych odchodach kosów często znajdują się ziarna i pestki, nierzadko odchody zabarwione są sokiem z owoców[55].
Tryb życia i zachowanie
Przez większą część roku początek aktywności przypada na świt, a jej koniec na zmierzch. Między lutym a końcem czerwca środkowoeuropejskie kosy podnoszą krzyk na długo przed świtem. W lipcu i czerwcu, tak jak i w środku zimy, ptaki kończą aktywność już o zachodzie słońca lub nawet przed nim. Na czas aktywności mają wpływ różnice w oświetleniu związane z pogodą oraz sztuczne źródła światła[52].
Odpoczynek

.jpg.webp)
W ciągu całego roku kosy wybierają specjalne miejsca do snu, choć w okresie lęgowym samice a często i samce pozostają na noc w swoich rewirach. Miejsca do snu znajdują się zwykle na drzewach iglastych lub gęsto ulistnionych drzewach lub krzewach liściastych, zazwyczaj na wysokości 1 do 2,5 m nad ziemią. Kosy nocują głównie samotnie, ale czasami w grupach. W lasach w pobliżu miast może zbierać się 700 lub więcej ptaków. Na obszarach zamieszkałych kosy nocują często na cmentarzach i w parkach. Do swoich miejsc do snu kosy zwykle muszą pokonać dystans poniżej kilometra, ale zdarza się, że jest to ponad 4 kilometry. Szczególnie w miastach te odległości są większe. Ptaki wykorzystują często te same drogi do noclegowisk, ale poszczególne osobniki nie nocują codziennie w tych samych miejscach[52].
U kosów występują fazy snu wolnofalowego (SWS) i paradoksalnego (PS). W fazie SWS kosy spędzają około 32,2%, a w fazie PS około 7,2% cyklu dobowego. Podobnie jak u ssaków faza SWS zawsze poprzedza fazę PS. W ciągu nocy skraca się czas fazy SWS a wydłuża PS. Gdy jest ciemno, kosy obracają głowę, tak że dziób skierowany jest do tyłu. Uważa się, że taka postawa świadczy o tym, że ptak śpi. Niekiedy kosy będąc w fazie PS kiwają głową z dziobem skierowanym ku przodowi. W czasie snu ptaki mają zamknięte oczy[56]. Kos jest jednym z gatunków, u których występuje jednopółkulowy sen wolnofalowy. Jedna połowa mózgu śpi, podczas gdy EEG niskonapięciowe drugiej jest typowe dla stanu czuwania[57]. Epizody jednopółkulowego snu trwają od 2 do 4 sekund. Ptak ma w ich trakcie dziób zwrócony ku przodowi. Ogółem w ciągu nocy ten rodzaj snu trwa 140–200 sekund[58].
Przed udaniem się na spoczynek kosy często czyszczą pióra lub biorą kąpiel. Kąpiele można obserwować przez cały rok. Częstsze są przy zachmurzonym niebie i deszczu, rzadsze przy dobrej pogodzie. Kosy biorą też chętnie, zwłaszcza popołudniami w pełni lata, kąpiele słoneczne. W typowy dla drozdów sposób kładą się płasko na ziemi, rozcapierzają ogon, rozciągają pióra i wystawiają na działanie promieni słonecznych. Pozostają tak, dopóki nie zaczną wykazywać objawów stresu cieplnego. Przyczyna tych intensywnych kąpieli słonecznych jest niejasna. Kąpiele słoneczne i mrówkowe są szczególnie częste bezpośrednio przed pierzeniem. Kosy łączą też często oba typy kąpieli, kładąc się na przykład na gniazdo podziemnic zwyczajnych[52][59].
Zachowania społeczne
Podczas pory lęgowej kosy zachowują się wobec osobników swojego gatunku wybitnie terytorialnie, szczególnie w fazie budowania gniazda, a nieco mniej w fazie wychowywania młodych. Obie płcie biorą udział w obronie rewiru. Samce przepędzają wszystkie osobniki swojego gatunku, a samice tylko inne samice. Jeśli intruz nie daje się przepędzić, może dojść do walki. Ptaki dziobią się nawzajem lub stykając się piersiami, wznoszą się na wysokość 3 metrów i złączone pazurami, ciągle walcząc, spadają na ziemię. Szczególnie intensywne są walki pomiędzy samicami. Mogą się skończyć nawet śmiercią przegranego ptaka[52].
Wygląd dzioba jest istotny dla relacji między kosami. Broniący swego terytorium samiec jest bardziej agresywny wobec podsuwanych modeli ptaków z pomarańczowymi dziobami niż tymi z żółtymi dziobami. Najsłabiej reaguje na brązowy kolor dzioba, typowy dla jednorocznych samców. Samice są dość obojętne na kolor dzioba, ale reagują gwałtowniej, gdy dziób mocniej odbija ultrafiolet[60].
Poza okresem lęgowym kosy są przeważnie społeczne i mogą wspólnie wykorzystywać dogodne źródła pożywienia. Nie są niczym nadzwyczajnym obserwacje grup liczących do 30 ptaków podczas zbierania pokarmu lub kąpieli. Gdy jednak późną jesienią pokarm staje się trudniej dostępny, nawet nieterytorialne ptaki mogą walczyć o ostatnie jagody z przedstawicielami swojego gatunku lub innymi drozdami. Bardziej zwinne i potrafiące się przystosować szpaki ustępują kosom podczas zbioru jagód[52].
Poruszanie się i lot
Kosy spędzają większość dnia na ziemi lub w jej pobliżu. W zależności od rodzaju podłoża poruszają się biegając lub podskakując. Aby wyhamować po wylądowaniu lub sekwencji skoków, kos musi przebiec jeszcze kilka kroków, przy czym ogon podnosi się w charakterystyczny sposób[52].
Głos
Kosy są szczególnie kreatywne w wynajdywaniu, kombinowaniu i zmienianiu motywów. Melodyjne strofy są chwytliwe i miłe dla ludzkiego ucha, całkiem przeciwnie niż dźwięki wydawane przez wzburzone ptaki obu płci, jak jazgot („dakderrigigigi duk duk”) i wysokie, powtarzane dźwięki „diks diks”[61].
Śpiew godowy

Śpiew godowy spełnia podwójną funkcję. Przy jego pomocy samce starają się przyciągnąć towarzyszkę i jednocześnie ogłosić swoje prawa do terytorium. Poszczególne cechy pieśni mają za zadanie przedstawić różne aspekty jakości samca. Przekaz ten jest skierowany do przedstawicieli zarówno własnej, jak i przeciwnej płci[62]. Samce śpiewają pieśń godową zwykle z dwóch lub trzech różnych, eksponowanych, zmienianych co chwila stanowisk, takich jak wysokie drzewo, antena telewizyjna lub dach dużego budynku[61]. Jedna strofa tej pieśni trwa zwykle nieco ponad dwie sekundy. W sezonie lęgowym, o świcie kosy śpiewają przez 20 do 30 minut. Pauzy między strofami mają około trzech sekund. Podczas wieczornej pieśni pauzy są nieco dłuższe[63].
Strofę można podzielić na gwizdaną część motywu i cichszy, bardziej świergotliwy dodatek. Część motywu jest nieco dłuższa. Czasami dodatek nie występuje wcale. Część motywu składa się z dwóch do pięciu, a czasami nawet dziewięciu elementów trwających około 0,2 sekundy. Między elementami są słyszalne pauzy. Samce posiadają w repertuarze nierzadko ponad 30 motywów, będących kombinacjami różnych elementów[63]. Im samce są większe, tym ich repertuar jest bogatszy[62]. Samce mają dwa do pięciu ulubionych motywów. Wykorzystuje się to do identyfikacji poszczególnych osobników po śpiewie. Dodatki są bardziej różnorodne od części motywu. Ich widmo częstotliwościowe jest znacznie szersze. Natężenie dźwięków osiąga maksimum przy ponad 10 kHz, podczas gdy dla części motywu leży między 1,5 a 3 kHz[63]. Typowe dla sąsiadujących ze sobą kosów jest wzajemne odpowiadanie na swoje strofy. Ptaki przejmują motyw sąsiada i odpowiadają podobną strofą[61].

Pieśń jest częściowo wrodzona. Śpiew wychowanych w izolacji samców jest zgodny w dużej części ze śpiewem innych przedstawicieli gatunku. Wiele elementów pieśni przejmują kosy od ojców i od innych samców. Imitowane są także śpiewy innych gatunków ptaków, na przykład odgłosy sikor lub chichot dzięciołów zielonosiwego czy zielonego. Kosy na obszarach zasiedlonych przejmują do swych pieśni również odgłosy cywilizacji, jak syreny karetek czy dzwonki telefonów komórkowych[64].
Pierwsze regularne pieśni godowe można usłyszeć w Europie Środkowej już w lutym. Większość kosów rozpoczyna śpiewać w połowie marca, a najwyższe nasilenie osiągają między majem a czerwcem, szczególnie przy ciepłej i wilgotnej pogodzie. Śpiewy kończą się w połowie lipca, ale szczególnie na obszarach zamieszkanych można usłyszeć głośno śpiewającego kosa także jesienią i zimą, przeważnie przy ciepłej pogodzie. Wiosną kosy rozpoczynają swoje śpiewy jako jedne z pierwszych ptaków. Śpiewają już na długo przed świtem. Drugie maksimum śpiewu przypada na wieczór. W osiedlach ludzkich kosy mogą śpiewać nawet nocą w oświetlonym, np. przydrożną lampą, miejscu[64].
Inne odgłosy
W przypadku zagrożenia, na przykład ze strony srok lub kotów, kosy alarmują szybkimi, ostrymi dźwiękami „diks diks”. Przy jeszcze większym wzburzeniu dźwięki te mogą przejść w jazgot. Kosy jazgoczą też na przedstawicieli własnego gatunku. Jazgoczące kosy nie wykazują chęci ucieczki, lecz próbują przepędzić konkurenta lub wroga. Bardzo głośne, wysokie i przenikliwe „ssiih” (opadające z 9 do 7 kHz) służy jako ostrzeżenie przed wrogami, zwłaszcza przy zagrożeniu z powietrza[61].
Samice wydają dźwięki stłumione, ale poza tym podobne do samczych śpiewów, na przykład przylatując do gniazda lub w odpowiedzi na śpiew samców. Do łączenia w pary samice zapraszają rwanymi, bardzo cichymi i często bardzo wysokimi dźwiękami[61].
Po porze godów starsze samce śpiewają z zamkniętymi dziobami specjalną pieśń jesienną. Jest ona wyraźnie cichsza niż pieśń wiosenna, poza tym nie różni się jednak od niej bardzo. Pieśń jesienna przypomina pieśń młodzieńczą. Tę ostatnią wykonują zarówno samce, jak i samice od 19 dnia życia. W jej trakcie wibruje gardło, ciało i ogon, a dziób jest zamknięty lub tylko lekko otwarty. Po sposobie śpiewania można odróżnić ćwiczące młode samce od dorosłych kosów[61].
Lęgi

_chicks_2_days_old.jpg.webp)
Kosy stają się z reguły gotowe do rozmnażania wiosną, pod koniec pierwszego roku życia. W ciągu sezonu lęgowego para kosów prowadzi przeważnie monogamiczny tryb życia. U ptaków mieszkających w skrzynkach lęgowych, szczególnie na Wyspach Brytyjskich, pary są bardziej trwałe i mogą przetrwać kilka sezonów[65]. Przy tym jednak partnerzy samic nie są ojcami około 18% młodych[66]. Bigynia została zaobserwowana, jest jednak rzadka[65].
Kosy odlatujące na zimowiska częściej szukają po powrocie nowych partnerów, niż te które pozostają w miejscu gniazdowania. W Polsce północno-zachodniej po zimie rozstaje się około 50% par, w Niemczech (Bonn) około 30%, a w Anglii około 20%. Kosy mające doświadczenie w związkach są mniej skłonne do rozwodów, niż te które nie mają takiego doświadczenia. Na częstotliwość rozwodów ma wpływ także czas, w którym ptaki zajmują terytoria. Te, które zrobiły to wcześniej, rzadziej zmieniają partnera. Rozwodowi towarzyszy zwykle zmiana terytorium. Motywem rozstania jest często zła jakość terytorium, wyznaczona niską liczbą wyprowadzonych piskląt. Statystycznie po rozwodzie sukces lęgowy jednak się zmniejsza[67].
Kosy przystępują do lęgów wcześnie, w Europie Środkowej już pod koniec lutego lub na początku marca. Regułą są dwa lub trzy lęgi w roku, ostatnie są możliwe w końcu sierpnia. Na wielu obszarach kosy mają tylko dwa lęgi w roku. Często samica składa ponownie jaja, gdy młode z poprzedniego lęgu nie wyleciały jeszcze z gniazda[65]. Na obszarach zamieszkałych w szczególnie łagodne zimy ptaki mogą próbować zakładać gniazda, a nawet dochować się potomstwa[68]
Toki
Godowe piosenki oznaczające terytoria kosów słychać już późną zimą. W tym celu zajmują wysokie miejsca – czubki drzew lub anteny. Wyznaczanie swoich rewirów może mieć brutalny przebieg, a nierzadko dochodzi do prawdziwych walk, w trakcie których ptaki mogą się kaleczyć[65]. Szczególnie cenione są terytoria, na których rośnie bluszcz[69].
W Europie Środkowej samce, które nie odleciały na zimę, mogą już w listopadzie formować na nowo swe terytoria. W tym czasie przede wszystkim u miejskich kosów można zaobserwować pierwsze oznaki tworzenia par. Dorosłe samce już w zimie towarzyszą swym wybrankom i próbują utrzymać konkurentów na odległość. Także zimujące ptaki mogą powrócić na tereny lęgowe już w parach. Z reguły jednak tworzenie par zachodzi dopiero późną zimą lub wiosną. Samice wybierają wtedy samców dysponujących odpowiednim terytorium. Młode ptaki osiedlają się w marcu lub kwietniu pomiędzy zajętymi terytoriami lub próbują przejąć obcy rewir[65].
Choć kosy mogły utworzyć pary już wcześniej, to właściwe toki rozpoczynają się w Europie Środkowej zazwyczaj w marcu. Samotne ptaki mogą wówczas znaleźć partnerów. Typowy rytuał zalotów zaczyna się często po porannym śpiewie godowym[65]. Próbując zaimponować samicy, samiec wykonuje podbiegi po skosie połączone ze skinięciami głową i zduszonym śpiewem. Samica pozostaje nieruchoma do czasu, gdy podniesieniem głowy i ogona zezwoli na kopulację[70]. Czasami dochodzi do kopulacji bez zalotów[65]. W pojedynczym cyklu reprodukcyjnym para kosów kopuluje średnio 24,2 razy. To dużo więcej niż jest potrzebne do zapłodnienia jaj. Przypuszczalnie samica wydłuża okres aktywności seksualnej aby skłonić samca do opieki i zmonopolizować jego wysiłek rodzicielski. Samiec zajęty opieką nad samicą ma mniej czasu na poszukiwanie seksu poza związkiem. Nie szuka też lepszej alternatywy dla swojej obecnej partnerki. Z kolei samiec dzięki wysokiej częstości kopulacji zyskuje przewagę w konkurencji plemników z innymi samcami[71].
Gniazdo


Kosy budują gniazda przeważnie na drzewach lub krzewach, ale także na ziemi. Jest dyskusyjne, jaką rolę odgrywają przy wyborze miejsca na gniazdo samce. Niektórzy autorzy uważają, że samica podejmuje decyzję samodzielnie, inni przyjmują, że samiec wskazuje samicy możliwe miejsca na gniazdo lub w jakiś inny sposób ma wpływ na wybór[65].
Gniazdo jest budowane zwykle na stabilnym podłożu i jest zabezpieczone od góry. Preferowane są na wpół ciemne stanowiska na wieczniezielonych roślinach drzewiastych, w szczególności na drzewach iglastych. W naturalnych siedliskach gniazda kosa są lepiej schowane niż te drozda śpiewaka lub kwiczoła. Położone są też bliżej ziemi, zwykle na wysokości między 1,5 a 2 metra. Gniazda budowane w późniejszych porach roku leżą przeciętnie wyżej, co można wytłumaczyć zwiększonym wykorzystaniem drzew liściastych[65].
W osiedlach ludzkich gniazda są względnie wyżej położone. Często wykorzystywane są pnącza porastające fasady domów i mury, a także, podobnie jak w naturalnych siedliskach, wieczniezielone rośliny drzewiaste. Także w osiedlach gniazda założone na wysokości powyżej 7 metrów są wyjątkiem. Kosy budują tam, podobnie jak kopciuszki, gniazda na legarach lub w niszach. Istnieją doniesienia o nietypowych miejscach na gniazda, na przykład w komorze silnika zaparkowanego samochodu, na pracującym dźwigu lub na literach neonów – z preferencją do okrągłych liter i przy unikaniu czerwonego koloru[65].
Samica sama buduje miseczkowate gniazda. Materiał na nie zbierany jest wyłącznie na ziemi. Na początku samica wznosi z cienkich gałązek, grubych łodyg, mchu i porostów bazę gniazda umacnianą dodatkiem wilgotnej ziemi. Potem formuje z cienkich łodyg, liści i mchu nieckę gniazda i pokrywa ją gliną lub wilgotnym szlamem. W zależności od pogody samica czeka na wyschnięcie konstrukcji od 12 do 24 godzin. Na koniec wyścieła nieckę cienkimi źdźbłami traw i liśćmi oraz poruszeniami ciała nadaje gniazdu ostateczny kształt[72]. Do budowy bazy gniazda kosy, zarówno miejskie, jak i leśne, często wykorzystują kawałki papieru lub plastiku, tekstylia i podobne sztuczne materiały[65].
Forma i wielkość gniazda zależą od stanowiska. Gniazda w widłach konarów i w niszach są mniejsze, te na płaskiej podstawie jak legary czy kloce drzew – większe. Średnica zewnętrzna nie zawsze okrągłych gniazd wynosi średnio 16 centymetrów, średnica niszy 10 centymetrów[19][72]. Według badań przeprowadzonych w parkach miejskich na wielkość gniazda mają wpływ szybkość jego budowy, wysokość nad ziemią i doświadczenie samic. Mniejsze gniazda są także trudniejsze do wykrycia przez drapieżniki[73]. Samica potrzebuje na wybudowanie gniazda od 2 do 5 dni. Przy następujących po sobie lęgach może to trwać krócej. Najczęściej do każdego lęgu budowane jest nowe gniazdo. Na osłoniętych stanowiskach, szczególnie w miastach, gniazdo może zostać po naprawie użyte ponownie[65].
Składanie jaj i wysiadywanie

Po ukończeniu budowy gniazda mijają zazwyczaj jeden do trzech dni do złożenia pierwszego jaja. Następne jaja są składane w odstępie 24 godzin. Lęg składa się zwykle z 4 do 5 jaj. Na początku sezonu lęgowego są to jednak częściej tylko trzy lub nawet tylko dwa jaja. Zdarzają się większe lęgi z 6 lub 7 jaj, pochodzą jednak wtedy od więcej niż jednej samicy[74].
Jaja są przeważnie owalne, czasem lekko eliptyczne. Jaja są najczęściej niebieskozielone z czerwono-brązowymi plamkami[70], ale ich kolor i wzór może być bardzo zmienny. Wielkość jaj europejskich kosów wynosi przeciętnie 29,5 × 21,5 milimetra, a masa to nieco ponad siedem gramów[65].
Jaja wysiaduje z reguły tylko samica. Są jednak także doniesienia o wysiadujących samcach. Zwykle jednak pod nieobecność samicy samiec siada na gnieździe i pilnuje lęgu. Samica zwykle już po złożeniu drugiego jaja nocuje w gnieździe, wysiaduje jednak dopiero od trzeciego jaja. Wówczas ptak opuszcza gniazdo tylko dla zdobycia pożywienia[74]. Karmienie samicy przez samca zdarza się niezwykle rzadko[52]. Czas wysiadywania wynosi od 10 do 19 dni, średnio 13 dni[45].
Pisklęta

Pisklęta wykluwają się nagie i ślepe w ciągu dwóch dni. Karmione są przez oboje rodziców. W normalnym przypadku ogrzewane są tylko przez samicę. Jeśli samica umrze, zadanie to może przejąć samiec i samodzielnie wychować młode. Pisklę zjada przeciętnie 16 gramów pożywienia dziennie. Na początku okresu rozrodczego jest to niemal wyłącznie pokarm zwierzęcy, później uzupełniają go jagody i mięsiste owoce. Nowo wyklute pisklęta maja masę ciała od 5 do 7 gramów. Przy opuszczaniu gniazda po 13-15 dniach mają masę około 65 gramów[52][74].
Po opuszczeniu gniazda młode ptaki są początkowo niezdolne do latania. W ciągu dnia pozostają cicho w ukryciu na ziemi. Rodzice dzielą między sobą pisklęta, którymi się opiekują[52]. Jeśli samica rozpoczyna budowę nowego gniazda, opieka nad młodymi spada wyłącznie na samca[70]. W wieku około 18 dni młode potrafią już latać. Po 19 do 32 dniach stają się samodzielne. W wieku 7 do 8 tygodni młode opuszczają terytorium swoich rodziców[52].
Sukces rozrodczy
W osiedlach ludzkich dochodzi wprawdzie do większej ilości lęgów w roku, ale w sukcesie rozrodczym przeszkadzają ludzie i duża liczba kotów domowych. W efekcie poza miastami kosy nierzadko mogą wychować większą liczbę potomstwa w ciągu roku. Na obszarach z dużą ilością krukowatych, w szczególności srok, może dochodzić do seryjnej utraty lęgów. Wiele badań zostało poświęconych związkowi pomiędzy odosobnieniem gniazda a udziałem piskląt, które dożywały do wylotu z gniazda[30]. Stwierdzono, że straty całych lęgów są rzadsze, gdy gniazdo jest nisko położone, niż gdy znajduje się powyżej 2,5 m nad ziemią. Przyczyną jest to, że nisko położone gniazda są mniej widoczne dla zagrażających im rabusiom[75]. W Wielkiej Brytanii pisklęta wykluły się w 56% z 1428 przebadanych gniazd. 41% z tych gniazd opuścił co najmniej jeden młody ptak[45]. W ludzkich osiedlach wiele młodych po opuszczeniu gniazda pada ofiarą ruchu ulicznego lub kotów[75].
Status, zagrożenia i ochrona

Gatunek nie jest globalnie zagrożony według danych IUCN (status LC – least concern). Szacuje się, że w Europie gniazduje od 40 do 82 milionów par, co daje od 120 do 246 milionów osobników. Na podstawie tego, że Europa stanowi 50–74% globalnego zasięgu gatunku, przyjmuje się, że na świecie może żyć między 162 a 492 milionów kosów[76].
W ustawodawstwie europejskim kos został ujęty w Załączniku II Konwencji Berneńskiej jako gatunek podlegający ochronie[77]. W Polsce kos jest objęty ścisłą ochroną gatunkową[78]. Na Czerwonej liście ptaków Polski został sklasyfikowany jako gatunek najmniejszej troski (LC)[79]. Według szacunków Monitoringu Pospolitych Ptaków Lęgowych, w latach 2013–2018 jego populacja na terenie kraju liczyła 2 786 000 – 3 865 000 par lęgowych, zaś od 2007 do 2018 roku odnotowano przyrost populacji o około 59%[80]. Kos od dawna zwiększa liczebność, do czego przyczyniły się zaprzestanie na początku XX wieku odłowów do celów konsumpcyjnych oraz synantropizacja, zasiedlanie miast. Jedną z przyczyn może być też ocieplenie klimatu – wskazuje na to wzrost liczebności w Białowieskim Parku Narodowym, czyli środowisku w niewielkim stopniu przekształconym przez człowieka[39].
Zagrożenia i długość życia


Pogoda ma duży wpływ na śmiertelność. Latem ptaki cierpią z powodu przedłużającej się suszy, zimą przez mróz i mocny wiatr. Wszelako kosy, dzięki szerokiemu spektrum pokarmowemu, wytrzymują długotrwałe zimowe warunki dużo lepiej niż inne drozdy[81].
Gatunek ten pada czasami ofiarą pasożytniczych kukułek. Zdarza się to jednak bardzo rzadko, gdyż kosy rozpoznają ptaki pasożytniczych gatunków i ich niemimetyczne jaja[82]. W Wielkiej Brytanii tylko w 3 gniazdach na 59 770 sprawdzonych (0,005%) znaleziono jaja kukułek[83]. Kosy introdukowane w Nowej Zelandii, gdzie kukułki nie występują, utraciły w ciągu 130 lat zdolność rozpoznawania dorosłych kukułek, lecz nie zaprzestały odrzucania niemimetycznych jaj[84].
Podobnie jak u innych wróblowych częste jest występowanie pasożytów. 88% kosów jest nosicielami pasożytów układu pokarmowego, najczęściej z rodzajów Isospora i Capillaria[85]. U ponad 80% ptaków stwierdzono obecność pasożytów układu krwionośnego, należących do rodzajów Leucocytozoon, zarodziec, Haemoproteus, a także świdrowców[86]. Do pozostałych pasożytów wewnętrznych należą przywry wnętrzniaki[87]. U kosów stwierdzono obecność 13 gatunków przywr, z czego w Polsce wykryto 6 gatunków[88].
Kosy spędzają większość czasu poszukując pokarmu na ziemi. Mogą tam zostać zaatakowane przez kleszcze, które zwykle przyczepiają się do głowy ptaka. We Francji kleszcze z rodzaju Ixodes wykryto u 74% wiejskich kosów, lecz tylko u 2% ptaków żyjących w miastach. Wynika to z faktu, iż kleszcze są liczniejsze na terenach wiejskich, gdzie mają dostęp do większej liczby nosicieli, takich jak lisy, sarny i dziki. Choć kleszcze mogą przenosić chorobotwórcze wirusy i bakterie oraz wiadomo, że przenoszą boreliozę u ptaków, to nie ma dowodów, że wpływają niekorzystnie na sprawność kosów poza sytuacją, gdy ptaki są wyczerpane po migracji[89]. Do pasożytów zewnętrznych należą też przykładowo larwy much Neottiophilum praeustum, żyjące w materiale gniazda i żywiące się krwią piskląt[87].
Znany dawniej jedynie w Afryce, należący do przenoszonych przez komary flawiwirusów wirus usutu powodował od roku 2001 w Europie Środkowej znaczącą umieralność wśród ptaków. Szczególnie dotkniętym gatunkiem były kosy, stąd mówiono o tej chorobie jako o „umieraniu kosów”. Po raz pierwszy wystąpiło ono w 2001 roku w pobliżu Wiednia i rozszerzyło się na Węgry, Szwajcarię i Włochy[90]. Latem 2011 roku wirus usutu został uznany za przyczynę licznych padłych zwierząt na północy Niziny Górnoreńskiej w Niemczech. Oszacowano, że zginęło tam około 100 tysięcy osobników[91]. W Austrii, gdzie wirus pojawił się po raz pierwszy, od 2004 roku liczba przypadków śmiertelnych zaczęła spadać, a w 2006 roku sytuacja wróciła do stanu sprzed epizootii. Przyczyną było to, że austriackie ptaki rozwinęły odporność populacyjną[91].

Kosy padają ofiarą rozmaitych drapieżników. Warto przy tym zauważyć, że częściej pożerane są nie samce, śpiewające w eksponowanych miejscach, lecz samice. Najprawdopodobniej jest to spowodowane tym, że samice dłużej przebywają w poszukiwaniu pokarmu na ziemi[92]. W oryginalnym środowisku najskuteczniejsze w polowaniu na kosy są różne gatunki sokołów, krogulec, jastrząb, myszołów oraz kania ruda, a w Australii i Nowej Zelandii błotniak moczarowy. Spośród sów typowymi drapieżnikami są puszczyk, puchacz i uszatka. Łupem różnych krukowatych padają jaja i pisklęta. Większe ich gatunki jak czarnowrony polują również na słabe i chore stare ptaki. Zagrożeniem dla kosów są także różne gatunki łasicowatych i lisów. Poza tym kosy padają często ofiarami kotów domowych, szczurów wędrownych i wiewiórek. Szczury i wiewiórki zjadają z reguły jaja i nieumiejące jeszcze fruwać młode ptaki[87]. Z powodu drapieżnictwa kotów i kun notuje się wysoką śmiertelność dorosłych ptaków (samców – ok. 40%, samic – ok. 60%, co wynika z większego narażenia na atak podczas wysiadywania jaj) oraz duże straty w lęgach (ok. 40%). W populacjach miejskich bardziej zagrożone są lęgi, w leśnych – osobniki dorosłe[93].
Na obszarach zaludnionych ruch uliczny powoduje liczne ofiary wśród kosów. Szczególnie niebezpieczne są drogi szybkiego ruchu przebiegające wśród terenów zielonych. Niektóre kosy przeżywają wiele wypadków drogowych. Szanse wyleczenia wydają się większe w miastach z powodu większej ilości pożywienia i mniejszego zagrożenia ze strony drapieżników[87]. W wielu częściach obszaru występowania tępienie jako szkodniki (na przykład w Australii) i polowania (na przykład we Francji) stanowią istotną przyczynę śmierci[81].
Śmiertelność w pierwszym roku życia jest znacząco wyższa niż w kolejnych. Badania przeprowadzone we Francji ustaliły prawdopodobieństwo przeżycia pierwszego roku na 31%. Dla kolejnych lat było to 55%. Badania w wielkich miastach północno-zachodnich Niemiec wyznaczyły przeciętną długość życia na 3,6 roku. Nierozstrzygnięte pozostaje zagadnienie, czy przeciętna długość życia jest większa w oryginalnym środowisku, czy też w obszarach zaludnionych. Przeprowadzone badania dostarczają sprzeczne wyniki. Pojedyncze ptaki mogą osiągnąć znaczny wiek. Wielokrotnie spotykano ptaki mające ponad 10 lat. Najstarszym dotychczas znanym kosem była samica zaobrączkowana na Helgolandzie w 1974. Została ponownie schwytana po 22 latach i 3 miesiącach i możliwe, że była jeszcze starsza[94].
Podgatunki
| Wyróżniane podgatunki[18][95] | ||
|---|---|---|
| T. m. merula Linnaeus, 1758 | Podgatunek nominatywny. Należą do niego prawie wszystkie europejskie kosy (z wyjątkiem ptaków z południowo-wschodniej części). W obrębie dużego obszaru zasięgu tego podgatunku występują różnice w wyglądzie. Stały się one podstawą do propozycji wydzielenia dalszych podgatunków – na przykład ticehursti dla nieco ciemniej zabarwionych populacji Szkocji i Irlandii. Propozycje te nie zostały jednak formalnie przyjęte. Naturalizowane populacje Australii i Nowej Zelandii pochodzą w większości od brytyjskich kosów. Należą one do formy nominalnej. Dotąd nie znaleziono cech wyraźnie różniących je od kosów europejskich. Przykładowo pieśni kosów nowozelandzkich i europejskich mają taką samą strukturę i elementy[64]. | (js)07.jpg.webp) |
| T. m. aterrimus (Madarász, 1903) | Samce tego podgatunku mają nieco bardziej matowe ubarwienie niż u formy nominalnej. Samice mają bledszy spód ciała. Dziób jest nieco dłuższy i węższy. Zamieszkuje obszar od Bałkanów, Słowenii i południowej Rumunii przez Krym, Grecję i Turcję po Kaukaz i północny Iran na wschodzie[96]. |  |
| T. m. azorensis Hartert, 1905 | Przedstawiciele podgatunku endemicznego na Azorach są nieco mniejsi od formy nominalnej i mają krótsze ogony. Upierzenie samców jest ciemniejsze i bardziej błyszczące niż u formy nominalnej[96]. |  |
| T. m. cabrerae Hartert, 1905 | Podgatunek zamieszkujący Maderę i zachodnie Wyspy Kanaryjskie przypomina T. m. azorensis. Upierzeniem, wielkością i długością ogona nie odróżnia się jednak tak wyraźnie od formy nominalnej[96]. | .jpg.webp) |
| T. m. intermedius (Richmond, 1896) | Ten podgatunek gniazduje w pasie od północno-wschodniego Afganistanu po Tienszan. Na zimę ptaki wędrują w doliny południowego Afganistanu i do południowego Iraku. Przedstawiciele tego podgatunku są więksi niż T. m. syriacus i T. m. aterrimus, ogon jest relatywnie dłuższy, a dziób mocniejszy[45]. | |
| T. m. mauritanicus Hartert, 1902 | Do tego podgatunku należą kosy północno-zachodniej Afryki. Upierzenie samców jest głęboko czarne i błyszczące. Dziób jest trochę mocniejszy niż u formy nominalnej. Południe Hiszpanii to obszar, na którym kosy wykazują cechy pośrednie z formą nominalną[96]. |  |
| T. m. syriacus Hemprich & Ehrenberg, 1833 | Podgatunek zamieszkuje wschodnie wybrzeża Morza Śródziemnego na południe od T. m. aterrimus od południowej Turcji po Jordanię i Izrael oraz północny Synaj. Występuje na północy Iraku i południu Iranu. Dla kosów południowych wysp Grecji zaproponowano wydzielenie podgatunku T. m. insularum, są one jednak trudne do odróżnienia od T. m. syriacus i dlatego zaliczane zwykle do tego podgatunku[97]. | -Jerusalem_Mountains.jpg.webp) |
Hodowla
Już w starożytnym Rzymie tuczono kosy w wielkich ptaszarniach. Ich mięso uchodziło za przysmak[98]. Do tradycyjnych dań kuchni korsykańskiej należy Pâté de Merle, pasztet z kosów[99]. Miłośnicy śpiewu kosów chętnie trzymali te ptaki w klatkach. Zalecano chwytanie starych kosów, aby móc doznawać przyjemności słuchania śpiewu „w jego pełnej czystości”[100]. Hodowane od małego kosy dawały się z kolei nauczyć melodii. Kosy chętnie trzymano w wolierach. W przeciwieństwie do hodowanych z jaj osobników te złapane na wolności nie były łagodne i zachowywały się bardzo agresywnie wobec innych ptaków, szczególnie własnego gatunku[98].
XVIII-wieczny polski biolog Jan Krzysztof Kluk radził trzymane w niewoli ptaki karmić maczanymi w mleku kaszą jaglaną lub białym chlebem oraz sercem bydlęcym i nerkami baranimi[101].
Znaczenie dla człowieka
Wierzenia ludowe

Z powodu swojego kojarzonego z żałobą koloru oraz samotnego życia w lesie wiązano często kosy w symbolice chrześcijańskiej z pobożnymi pustelnikami. Przykładem może być tu legenda o świętym Kewinie, któremu kos uwił gniazdo w złożonych do modlitwy dłoniach. Dzięki długości modlitwy pustelnika kos mógł wyprowadzić lęg[102].
Przesądy od dawna przypisywały kosom magiczne moce. Wzmogło się to jeszcze po synurbizacji tych ptaków. Na przykład wierzono, że piorun nie uderza w dom, w którym przebywa kos. Jeśli w domu zawiesi się na nitce pióro z prawego skrzydła kosa, mieszkańcy nie zaznają snu. Jeśli serce kosa położy się pod poduszkę śpiącego, będzie on później musiał na zadane pytania odpowiadać zgodnie z prawdą[103]. W północnych Włoszech trzy ostatnie dni stycznia, zwykle zimne, nazywane są „dniami kosa” (I giorni della merla). Odnosi się to do legendy, według której dawniej kosy były białe, ale w zimie schroniły się w kominie i sczerniały od sadzy[104]. Według angielskiego przesądu, gdy młoda dziewczyna w dzień świętego Walentego zobaczy kosa, wyjdzie za mąż za pastora[104][105] lub osobę zaangażowaną w pomoc humanitarną[105]. Irlandzkie przysłowie mówi, że Prędzej kosy będą białe, niż nieprzychylna kobieta zdecyduje się na zamążpójście (ang. There’ll be white blackbirds before an unwilling woman ties the knot; tie the knot to idiom oznaczający poślubić)[106].
Literatura i muzyka
Kosy jako powszechnie znane ptaki o melodyjnym śpiewie zwracały uwagę poetów i pisarzy. Jan Brzechwa stworzył żartobliwy wierszyk pod tytułem „Kos”. O ptakach tych pisali: Alfred de Musset w Histoire d’un merle blanc, Robert Musil w Die Amsel i Walter Kappacher w Die Amseln von Parsch. Zespół The Beatles nagrał piosenkę Blackbird wykorzystując śpiew kosa. Ptak ten symbolizował tam czarną dziewczynę (ang. blackbird = kos, black = czarna, bird w slangu = dziewczyna)[107]. Utwór znalazł się w albumie White Album (1968). Wcześniej w 1926 Gene Austin nagrał bluesowy utwór Bye bye blackbird, którzy spopularyzowali inni twórcy, m.in. Eddie Cantor, Frank Sinatra i Peggy Lee[104].
Ludzie wiele razy zwracali uwagę, że śpiew kosa jest bardzo bliski człowieczemu rozumieniu muzyki. W przeciwieństwie do wielu innych odgłosów ptaków daje się on całkiem dobrze przedstawić w notacji muzycznej. Niemiecki kompozytor i dyrygent Heinz Tiessen (1887–1971) prowadził szczególnie intensywne rozważania na temat śpiewu kosa. W jego opinii kos był „muzycznie najwyżej stojącym ptakiem śpiewającym Europy Środkowej”. Zakres głosu znacznie przekracza oktawę. Często chwalony za swój śpiew słowik rdzawy wykorzystuje w mniejszym stopniu swoje możliwości. Kos jest bardziej utalentowanym kompozytorem: „Zakres tonalnej wypowiedzi rozciąga się od najprostszego do najbardziej zróżnicowanego, od czystych trójdźwięków i diatonicznych interwałów w wyrazistej tonacji aż do chromatyki i poza nią, w tonalnie i harmonicznie niepojęte obszary”[108]. Podobną miłością darzył śpiew kosa francuski kompozytor Olivier Messiaen (1908–1992). Poświęcił mu Le Merle noir, utwór kameralny na flet i fortepian. Kosy zainspirowały również Richarda Straussa, który wiernie oddał ich śpiew w Kawalerze srebrnej róży. Na początku pierwszego aktu, gdy kurtyna idzie w górę, motyw śpiewu kosa jest odgrywany przez pierwszy klarnet[109].
Inne przykłady
Pierwsi europejscy osadnicy w Australii nazywali w slangu rdzenną ludność tego kontynentu kosami (blackbird). Rekreacyjne polowania na Aborygenów określano mianem blackbird shooting. Termin blackbird catching, skrócony następnie do blackbirding, odnosił się do porywania mieszkańców wysp Południowego Pacyfiku do pracy na plantacjach w drugiej połowie XIX wieku[110].
Nazwę Kosowo wywodzi się według legendy od serbskich bohaterów, którzy po śmierci w bitwie na Kosowym Polu zostali zamienieni w kosy i w tej postaci swym śpiewem opowiadają o dawnej klęsce. Etymologia wywodząca nazwę krainy od ptaków służyła za argument uzasadniający serbskie prawa do tych ziem. Powstaniu legendy nie przeszkodził fakt, że jeszcze do niedawna Kosowo pozostawało niezasiedlone przez kosy. Według innej interpretacji nazwa Kosowa pochodzi nie od ptaków, lecz od słowa kosić, które zarówno w języku serbskim, jak i albańskim brzmi podobnie kosit/kositi[111].
Jeden z amerykańskich samolotów zwiadowczych nazwany został Lockheed SR-71 Blackbird[104].
Zobacz też
Przypisy
- ↑ Turdus merula, [w:] Integrated Taxonomic Information System (ang.).
- ↑ F. de Lafresnaye. Travaux Inédits. „Rev. Zool.[Paris]”, s. 65, 1840. (fr.).
- ↑ G. Madarász. Drei neue palearktische Vogelarten. „Annales Historico-Naturales Musei Nationalis Hungarici”. 1, s. 559, 1903. (niem.).
- ↑ G. Madarász. Merula aterrima n. sp. „Ornithologische Monatsberichte”. 11, s. 186, 1903. (niem.).
- ↑ O. Kleinschmidt. Neubeschreibungen von Vögeln und Schmetterlingen. „Falco”. 14 (2), s. 15, 1918. (niem.).
- ↑ R. Meinertzhagen, A. Meinertzhagen. Turdus merula buddæ, subsp. nov. „Bulletin of the British Ornithologists’ Club”. 46, s. 98, 1926. (ang.).
- ↑ P.A. Clancey. Some Remarks on Western Scottish Birth. „Ibis”. 80 (4), s. 750, 1938. DOI: 10.1111/j.1474-919X.1938.tb00214.x. (ang.).
- ↑ W.N. Koelz. New birds from Asia, chiefly from India. „Proceedings of the Biological Society of Washington”. 52, s. 67, 1939. (ang.).
- ↑ J. Niethammer. „Anzeiger / Kaiserliche Akademie der Wissenschaften in Wien. Mathematisch-Naturwissenschaftliche Klasse”. 80 (3), s. 8, 1943. (niem.).
- ↑ H. Volsøe. „Dansk Orn. For. Tidskr.”. 43, s. 82, 1949. (duń.).
- ↑ A. v. Jordans. „Syll. Biol., Leipzig”, s. 172, 1950. (niem.).
- ↑ BirdLife International, Turdus merula, [w:] The IUCN Red List of Threatened Species 2016, wersja 2019-2 [dostęp 2019-09-11] (ang.).
- ↑ Systematyka i nazwa polska za: P. Mielczarek & M. Kuziemko: Podrodzina: Turdinae Rafinesque, 1815 – drozdy (wersja: 2020-02-28). [w:] Kompletna lista ptaków świata [on-line]. Instytut Nauk o Środowisku Uniwersytetu Jagiellońskiego. [dostęp 2020-05-07].
- ↑ Linneusz 1758 ↓, s. 170.
- 1 2 3 Nylander i in. 2008 ↓.
- ↑ Clement 2000 ↓.
- ↑ Voelker 2007 ↓.
- 1 2 3 F. Gill, D. Donsker & P. Rasmussen (red.): Thrushes. IOC World Bird List (v11.1). [dostęp 2021-03-18]. (ang.).
- 1 2 Collar 2005 ↓.
- ↑ Rasmussen i Anderton 2005 ↓.
- ↑ Hammar 1970 ↓.
- 1 2 3 4 5 6 7 8 9 10 Glutz von Blotzheim 1988 ↓, s. 842–848.
- ↑ Baeta i in. 2008 ↓.
- 1 2 Stephan 1999 ↓, s. 18–24.
- ↑ Higgins 2006 ↓.
- 1 2 3 Stephan 199 ↓, s. 18–24.
- ↑ Glutz von Blotzheim 1988 ↓, s. 849.
- ↑ van Grouw 2006 ↓, s. 79–89.
- 1 2 Stephan 1999 ↓, s. 28.
- 1 2 3 del Hoyo 2005 ↓, s. 645.
- 1 2 3 4 5 Higgins 2006 ↓, s. 1844–1866.
- ↑ Brown i in. 2006 ↓, s. 279.
- ↑ Stephan 1999 ↓, s. 31–35.
- ↑ Macleod i in. 2005 ↓, s. 292–302.
- 1 2 3 Glutz von Blotzheim 1988 ↓, s. 866–871.
- 1 2 3 Glutz von Blotzheim 1988 ↓, s. 871–875.
- 1 2 3 4 5 Hölzinger 1999 ↓.
- 1 2 Stephan 1999 ↓, s. 61–72.
- 1 2 3 Tomiałojć L., Stawarczyk T., 2003, Awifauna Polski. Rozmieszczenie, liczebność i zmiany, PTPP „pro Natura”, Wrocław, s. 609.
- 1 2 Stephan 1999 ↓, s. 61-72.
- 1 2 3 4 Evans i in. 2010 ↓.
- 1 2 Stephan 1999 ↓, s. 73–86.
- ↑ Menno Schilthuizen: Ewolucja w miejskiej dżungli. s. 289–290. ISBN 978-83-7229-841-6.
- ↑ Williams 2006 ↓, s. 285–291.
- 1 2 3 4 Collar 2005 ↓, s. 645.
- ↑ Stephan 1999 ↓, s. 218-232.
- ↑ Partecke i Gwinner 2007 ↓, s. 882–890.
- 1 2 3 4 Stephan 1999 ↓, s. 87–98.
- ↑ Raes, Lefebvre i Jordaens 2008 ↓, s. 231–234.
- 1 2 Glutz von Blotzheim 1988 ↓, s. 920–924.
- ↑ Klaus Richarz & Anne Puchta: Ptaki. Przewodnik. Warszawa: Muza SA, 2006, s. 300. ISBN 978-83-7495-018-3.
- 1 2 3 4 5 6 7 8 9 10 11 Glutz von Blotzheim 1988 ↓, s. 892–919.
- ↑ Brown i in. 2006 ↓, s. 107.
- ↑ Brown i in. 2006 ↓, s. 133.
- ↑ Brown i in. 2006 ↓, s. 136.
- ↑ Szymczak, Helb i Kaiser 1993 ↓.
- ↑ Rattenbourg, Amlaner i Lima 2000 ↓.
- ↑ Szymczak i in. 1996 ↓.
- ↑ Stephan 1999 ↓, s. 148–151.
- ↑ Bright i Waas 2002 ↓.
- 1 2 3 4 5 6 Glutz von Blotzheim 1988 ↓, s. 850–861.
- 1 2 Hesler i in. 2012 ↓.
- 1 2 3 Dabelsteen 1984 ↓, s. 227–239.
- 1 2 3 Stephan 1999 ↓, s. 51–60.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 Glutz von Blotzheim 1988 ↓, s. 875–889.
- ↑ Garamszegia i Møller 2004 ↓, s. 508–519.
- ↑ Wysocki 2004 ↓.
- ↑ Stephan 1999 ↓, s. 172–176.
- ↑ Pruscini i in. 2014 ↓.
- 1 2 3 Snow 1988 ↓.
- ↑ Wysocki i Halupka 2004 ↓.
- 1 2 Stephan 1999 ↓, s. 160–172.
- ↑ Wysocki i in. 2015 ↓.
- 1 2 3 Stephan 1999 ↓, s. 177–190.
- 1 2 Glutz von Blotzheim 1988 ↓, s. 889–892.
- ↑ IUCN 103888106 ↓.
- ↑ Convention on the Conservation of European Wildlife and Natural Habitats, Appendix III: Protected fauna species. – tekst Konwencji berneńskiej (ang.), Berno, 19.IX.1979; poprawiony: 1 marca 2002; dostęp: 10 czerwca 2015.
- ↑ Rozporządzenie Ministra Środowiska z dnia 16 grudnia 2016 r. w sprawie ochrony gatunkowej zwierząt (Dz.U. z 2016 r. poz. 2183).
- ↑ Wilk T., Chodkiewicz T., Sikora A., Chylarecki P., Kuczyński L.: Czerwona lista ptaków Polski. OTOP, Marki, 2020.
- ↑ Chodkiewicz T., Chylarecki P., Sikora A., Wardecki Ł., Bobrek R., Neubauer G., Marchowski D., Dmoch A., Kuczyński L.. Raport z wdrażania art. 12 Dyrektywy Ptasiej w Polsce w latach 2013–2018: stan, zmiany, zagrożenia. „Biuletyn Monitoringu Przyrody”. 20, s. 1–80, 2019.
- 1 2 Glutz von Blotzheim 1988 ↓, s. 890–892.
- ↑ Davies i Brooke 1989 ↓.
- ↑ Glue i Morgan 1972 ↓.
- ↑ Hale i Briskie 2007 ↓.
- ↑ Misof 2005 ↓.
- ↑ Hatchwell i in. 2000 ↓.
- 1 2 3 4 Stephan 1999 ↓, s. 118–121.
- ↑ Rząd i in. 2011 ↓.
- ↑ Gregoire i in. 2002 ↓.
- ↑ Chvala-Mannsberger 2007 ↓.
- 1 2 Konrad 2011 ↓.
- ↑ Post i Götmark 2006 ↓.
- ↑ Kruszewicz A.G.: Ptaki Polski, cz. II. Wróblowe – ptaki śpiewające. Warszawa: MULTICO Oficyna Wydawnicza, 2006, s. 66. ISBN 978-83-7073-455-8.
- ↑ Hüppop i Hüppop 2009 ↓, s. 201, 215.
- ↑ Common Blackbird (Turdus merula). IBC: The Internet Bird Collection. [zarchiwizowane z tego adresu (2016-04-04)]. (ang.).
- 1 2 3 4 Snow i Perrins 1998 ↓, s. 1215–1218.
- ↑ Clement, Hathway i Wilczur 2000 ↓.
- 1 2 Naumann 2009 ↓, s. 304–309.
- ↑ Die Küche Korsikas. [w:] www.cuisimonde.com [on-line]. [dostęp 2015-06-07]. (niem.).
- ↑ Brehm i Gourcy-Droitaumont 1832 ↓, s. 114.
- ↑ Kluk 1779 ↓, s. 285–286.
- ↑ Friedreich 1858 ↓, s. 512.
- ↑ Hoffmann-Krayer i Baechtold-Staeubli 2002 ↓, s. 372.
- 1 2 3 4 Leci, leci kos, a tu... nos!. „Polskie ptaki”. 16. Kos, s. 12–13, 2010.
- 1 2 Alexander Chancellor: Call me unromantic, but Valentine’s Day is grossly commercialised. The Guardian, 12 lutego 2010. [dostęp 2015-06-07].
- ↑ Irish proverbs. Irish Abroad. [dostęp 2015-06-07]. [zarchiwizowane z tego adresu (2018-08-30)].
- ↑ Miles 1997 ↓, s. 603.
- ↑ Tiesen 1989 ↓, s. 34, 67, 50 i 84.
- ↑ Tiesen 1989 ↓, s. 94.
- ↑ Quinion 2002 ↓.
- ↑ Földes 1999 ↓.
Bibliografia
- R. Baeta, B. Faivre, S. Motreuil, M. Gaillard i inni. Carotenoid trade-off between parasitic resistance and sexual display: an experimental study in the blackbird (Turdus merula). „Proceedings of the Royal Society B”, 2008. Royal Society Publishing. DOI: 10.1098/rspb.2007.1383. PMID: 18055388. (ang.).
- Ashleigh Bright, Joseph R. Waas. Effects of bill pigmentation and UV reflectance during territory establishment in blackbirds. „Animal Behaviour”. 64 (2), s. 207–213, sierpień 2002. DOI: 10.1006/anbe.2002.3042. (ang.).
- Christian Ludwig Brehm, Felix von Gourcy-Droitaumont: Handbuch für den Liebhaber der Stuben-, Haus- und aller der Zähmung werthen Vögel. Ilmenau: 1832. [dostęp 2015-04-27]. (niem.).
- BirdLife International, Turdus merula, [w:] The IUCN Red List of Threatened Species [dostęp 2015-05-16] (ang.).
- Epizootiologie von Usutu-Virus-assoziiertem Vogelsterben in Österreich, [w:] Sonja Chvala-Mannsberger i inni, Austrian Contributions to Veterinary Epidemiology (ACVE), t. 4, 2007, ISBN 978-3-9502042-3-0 [dostęp 2015-04-27] (niem.).
- Peter Clement, Hathway, Ren, Wilczur, Jan: Thrushes (Helm Identification Guides). Christopher Helm Publishers Ltd, 2000. ISBN 0-7136-3940-7. (ang.).
- N.B. Davies, M. de L. Brooke. An experimental study of co-evolution between the Cuckoo, Cuculus canorus, and its hosts. I. Host egg discrimination. „Journal of Animal Ecology”. 58 (1), s. 207–224, 1989. DOI: 10.2307/4996. (ang.).
- N.J. Collar: Common Blackbird (Turdus merula). W: Josep del Hoyo, A. Elliott, D.A. Christie: Handbook of the Birds of the World. T. 10: Cuckoo-shrikes to thrushes. Barcelona: Lynx Edicions, 2005. ISBN 84-87334-72-5. (ang.).
- Torben Dabelsteen. An analysis of the full song of the Blackbird Turdus merula with respect to message coding and adaptations for acoustic communication. „Ornis Scandinavia”. 15, grudzień 1984. Nordic Society Oikos. DOI: 10.2307/3675931. [dostęp 2015-05-23]. (ang.).
- Karl L. Evans, Ben J. Hatchwell, Mark Parnell, Kevin J. Gaston. A conceptual framework for the colonisation of urban areas: the blackbird Turdus merula as a case study. „Biological Reviews”. 85 (3), s. 643–667, 2010. Cambridge Philosophical Society. DOI: 10.1111/j.1469-185X.2010.00121.x. ISSN 1469-185X. [dostęp 2015-06-20]. (ang.).
- Csaba Földes. Ortsnamen im Spannungsfeld von Öffentlichkeitssprache und sprachlichem Wandel. Germanistisch-linguistische Bemerkungen anhand der Kosovo-Krise. „Muttersprache”, s. 303–315, 1999. Wiesbaden. [dostęp 2015-06-23]. (niem.).
- Johannes Baptista Friedreich: Die Symbolik und Mythologie der Natur. Würzburg: Stahel, 1858. [dostęp 2015-04-27]. (niem.).
- László Zsolt Garamszegi, Anders Pape Møller, Extrapair paternity and the evolution of bird song, „Behavioral Ecology”, 15, 2004, DOI: 10.1093/beheco/arh041 (ang.).
- David Glue, Robert Morgan. Cuckoo hosts in British habitats. „Bird Study”. 19 (4), s. 187–192, 1972. DOI: 10.1080/00063657209476342. (ang.).
- Echte Drosseln: Turdidae. W: Urs N. Glutz von Blotzheim: Handbuch der Vögel Mitteleuropas. T. 11/II. Wiesbaden: Aula, 1988. ISBN 3-89104-486-0. (niem.).
- Arnaud Gregoire, Bruno Faivre, Philipp Heeb, Frank Cezilly. A comparison of infestation patterns by Ixodes ticks in urban and rural populations of the Common Blackbird Turdus merula. „Ibis”. 144 (4), s. 640–645, 2002. DOI: 10.1046/j.1474-919X.2002.00102.x. (ang.).
- Hein van Grouw. Not every white bird is an albino: sense and nonsense about colour aberrations in birds. „Dutch Birding”. 28 (2), 2006. [dostęp 2015-05-23]. (ang.).
- Katrina Hale, James V. Briskie. Response of introduced European birds in New Zealand to experimental brood parasitism. „Journal of Avian Biology”. 38 (2), s. 198–204, marzec 2007. DOI: 10.1111/j.2007.0908-8857.03734.x. ISSN 0908-8857. [zarchiwizowane z adresu 2016-03-03]. (ang.).
- Bo Hammar. The karyotypes of thirty-one birds. „Hereditas”. 65 (1), s. 46–47, 1970. (ang.).
- Hatchwell, B.J.; Wood; Anwar, M.J.M.; Perrins C.M. The prevalence and ecology of the haematozoan parasites of European blackbirds, Turdus merula. „Canadian Journal of Zoology”. 78 (4), s. 684–687, 2000. DOI: 10.1139/z99-228. (ang.).
- Nana Hesler, Roger Mundry, Thomas Sacher, Timothy Coppack. Song repertoire size correlates with measures of body size in Eurasian blackbirds. „Behaviour”. 149, s. 645–665, 2012. ISSN 1568-539X. (ang.).
- P.J. Higgins: Handbook of Australian, New Zealand and Antarctic Birds. T. 7: Boatbill to Starlings. Melbourne/Oxford: Oxford University Press, 2006. ISBN 978-0-19-553996-7. (ang.).
- Eduard Hoffmann-Krayer, Hanns Baechtold-Staeubli: Handwörterbuch des deutschen Aberglaubens. T. 1. Berlin: de Gruyter, 2002. ISBN 3-11-016860-X. (niem.).
- Jochen Hölzinger: Die Vögel Baden-Württembergs. Stuttgart: Ulmer, 1999. ISBN 3-8001-3493-4. (niem.).
- Kathrin Hüppop, Ommo Hüppop. Atlas zur Vogelberingung auf Helgoland – Teil 5. „Vogelwarte”. 47 (3), 2009. [dostęp 2015-05-09]. (niem.).
- Jan Krzysztof Kluk: Zwierząt domowych i dzikich, osobliwie krajowych, historii naturalnej początki i gospodarstwo. Potrzebnych i pożytecznych domowych chowanie, rozmnożenie, chorób leczenie, dzikich łowienie, oswojenie, zażycie, szkodliwych zaś wygubienie. T. 2: O ptastwie. Warszawa: XX. Scholarum Piarum, 1779. (pol.).
- Armin Konrad. Usutuviren-assoziierter Bestandseinbruch bei Amseln in der nördlichen Oberrheinischen Tiefebene im Sommer 2011. „Avifauna-Nordbaden”. 42, 11 2011. [dostęp 2015-05-09]. [zarchiwizowane z adresu 2015-09-23]. (niem.).
- Karol Linneusz: Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata. Holmiae (Laurentii Salvii), 1758, s. 170. (łac.).
- J. MacKinnon, K. Phillipps: A Field Guide to the Birds of China. Oxford: Oxford University Press, 2000. ISBN 0-19-854940-7. (ang.).
- R. Macleod i inni, Body mass change strategies in blackbirds Turdus merula the starvation–predation risk trade-off, „Journal of Animal Ecology”, 74, 2005, DOI: 10.1111/j.1365-2656.2005.00923.x (ang.).
- Barry Miles: Paul McCartney. Many Years From Now. Secker and Warburg, 1997. ISBN 0-8050-5249-6. OCLC 40284619. (ang.).
- Katharina Misof: Eurasian Blackbirds (Turdus merula) and their gastrointestinal parasites: A role for parasites in life-history decisions?. Doctoral dissertation, Bonn, 2005. (ang.).
- Johann Friedrich Naumann: Die Vögel Mitteleuropas. Frankfurt am Main: Eichborn, 2009. ISBN 978-3-8218-6223-1. (niem.).
- Johan A.A. Nylander, Urban Olsson, Per Alström, Isabel Sanmartín. Accounting for Phylogenetic Uncertainty in Biogeography: A Bayesian Approach to Dispersal-Vicariance Analysis of the Thrushes (Aves: Turdus). „Systematic Biology”. 57 (2), s. 257–268, 2008. DOI: 10.1080/10635150802044003. (ang.).
- Jesko Partecke, Eberhard Gwinner. Increased sedentariness in European blackbirds following urbanization: a consequence of local adaptation?. „Ecology”. 88 (4), s. 882–890, 2006. Ecological Society of America. [dostęp 2015-05-23]. (ang.).
- Peter Post, Frank Götmark. Foraging behavior and predation risk in male and female Eurasian Blackbirds (Turdus merula) during the breeding season. „The Auk”. 123 (1), s. 162–170, 2006. The American Ornithologists’ Union. DOI: 10.1093/auk/123.1.162. (ang.).
- Fabio Pruscini, Federico Morelli, Davide Sisti, Marco Bruno. Role of ivy in determining the attractiveness of the Blackbird Turdus merula territory. „Avocetta”. 38, s. 83–87, 2014. ISSN 0404-4266. OCLC 806683897. (ang.).
- Michael Quinion: Blackbirding. World Wide Words, październik 2002. [dostęp 2015-06-12]. (ang.).
- Adam Raes, Louis Lefebvre, Kurt Jordaens. First report of fishing in the European Blackbird. „Acta Ornithologica”. 43, s. 231–234, 2008. DOI: 10.3161/000164508X395351. ISSN 0001-6454. (ang.).
- Pamela C. Rasmussen, John C. Anderton: Birds of South Asia: The Ripley Guide. Cz. 2. Waszyngton i Barcelona: Smithsonian Inst. and Lynx Edicions, 2005. ISBN 84-87334-67-9. (ang.).
- Neils C. Rattenbourg, C.J. Amlaner, S.L. Lima. Behavioral, neurophysiological and evolutionary perspectives on unihemispheric sleep. „Neuroscience and Biobehavioral Reviews”. 24 (8), s. 817–842, 2000. DOI: 10.1016/S0149-7634(00)00039-7. PMID: 11118608. (ang.).
- Klaus Richarz: Ptaki – Przewodnik. Warszawa: Muza, 2009. ISBN 978-83-7495-018-3.
- Craig Robson: A Field Guide to the Birds of Thailand. New Holland Press, 2004. ISBN 1-84330-921-1. (ang.).
- Izabella Rząd, Jilji Sitko, Dariusz Wysocki, Krzysztof Stępniewski. Digenean trematodes from six species of birds (Passeriformes, Piciformes and Strigiformes) from north-western Poland. „Wiadomości Parazytologiczne”. 57 (4), s. 271–276, 2011. ISSN 1944-6705. (ang.).
- David Snow: A Study of Blackbirds. British Museum (Natural History), 1988. ISBN 0-565-01021-2. (ang.).
- David Snow, Christopher M. Perrins: The Birds of the Western Palearctic concise edition (2 volumes). Oxford: Oxford University Press, 1998. ISBN 0-19-854099-X. (ang.).
- Burkhard Stephan: Die Amsel. Wyd. 2. Hohenwarsleben: Neue Brehm Bücherei, 1999. ISBN 3-89432-455-4. (niem.).
- J.T. Szymczak, H.-W. Helb, W. Kaiser. Electrophysiological and behavioral correlates of sleep in the blackbird (Turdus merula). „Physiology & Behavior”. 53 (6), s. 1201–1210, czerwiec 1993. DOI: 10.1016/0031-9384(93)90380-X. (ang.).
- J.T. Szymczak, H.-W. Helb, W. Kaiser, B. Beszczyńska. A study of sleep in the European blackbird. „Physiology & Behavior”. 60 (4), s. 1115–1120, październik 1996. DOI: 10.1016/0031-9384(96)00231-4. (ang.).
- Heinz Tiessen: Musik der Natur. Wyd. 2. Zürich: Atlantis, 1989. ISBN 3-254-00157-5. (niem.).
- Pavel Vasak: Ptaki leśne. Warszawa: Delta, 1993. ISBN 83-85817-28-X.
- Gary Voelkera i inni, Molecular systematics of a speciose, cosmopolitan songbird genus: Defining the limits of, and relationships among, the Turdus thrushes, „Molecular Phylogenetics and Evolution”, 42, 2007, s. 422–434 (ang.).
- Peter A. Williams. The role of blackbirds (Turdus merula) in weed invasion in New Zealand. „New Zealand Journal of Ecology”. 30 (2), s. 285–291, 2006. The New Zealand Ecological Society. [dostęp 2015-05-23]. (ang.).
- Dariusz Wysocki. Factors affecting the between-season divorce rate in the urban populations of European Blackbird Turdus merula in north-western Poland. „Acta Ornithologica”. 41 (1), s. 71–78, 2004. DOI: 10.3161/068.041.0101. [dostęp 2015-07-04]. (ang.).
- Dariusz Wysocki, Łukasz Jankowiak, José L. Greño, Anna Cichocka i inni. Factors affecting nest size in a population of Blackbirds Turdus merula. „Bird Study”. 62 (2), s. 208–216, kwiecień 2015. DOI: 10.1080/00063657.2015.1030722. ISSN 1944-6705. (ang.).
- Dariusz Wysocki, Konrad Halupka. The Frequency and Timing of Courtship and Copulation in Blackbirds, Turdus Merula, Reflect Sperm Competition and Sexual Conflict. „Behaviour”. 141 (4), s. 501–512, 2004. DOI: 10.1163/156853904323066766. ISSN 0005-7959. (ang.).
- Roy Brown, John Ferguson, Michael Lawrence, David Lees: Tropy i ślady ptaków. Muza SA, 2006. ISBN 83-7319-860-1.
Linki zewnętrzne
- Zdjęcia i materiały multimedialne. [w:] eBird [on-line]. Cornell Lab of Ornithology. (ang.).
- Samica kosa w akcji - wideo, Łódź (Polska)