 |
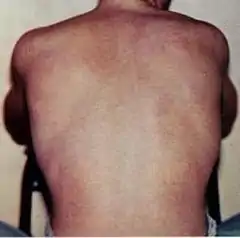
Denga – infekcyjna choroba tropikalna wywoływana przez wirus dengi. Objawy obejmują gorączkę, ból głowy, mięśni i stawów oraz charakterystyczną wysypkę, przypominającą spotykaną w odrze. W odosobnionych przypadkach choroba prowadzi do zagrażającej życiu gorączki krwotocznej z krwotokami, trombocytopenią i hipowolemią, może się także rozwinąć wstrząs.
Dengę przenosi kilka gatunków komarów należących do rodzaju Aedes, zwłaszcza Aedes aegypti. Wirus występuje w czterech typach. Infekcja jednym z nich pozostawia zazwyczaj odporność na niego na całe życie, ale tylko krótkoterminową odporność na inne typy wirusa. Kolejne infekcje różnymi typami podnoszą ryzyko ciężkich powikłań. Brak komercyjnie dostępnej szczepionki, prewencja polega na redukcji siedlisk i ilości komarów oraz zmniejszaniu ekspozycji na ukłucia.
Leczenie ostrej dengi jest objawowe. Stosuje się nawadnianie doustne bądź dożylne w przypadku choroby łagodnej lub umiarkowanej, w najcięższych przypadkach ordynując płyny dożylne i transfuzje krwi. Zapadalność na dengę wzrastała dramatycznie od lat sześćdziesiątych XX wieku, rocznie infekcji ulegało od 50 do 100 milionów ludzi. Wczesne opisy pochodzą z 1779, a wirusową etiologię i transmisję choroby wyjaśniono na początku XX wieku. Denga stała się problemem globalnym od II wojny światowej, jest endemiczna dla ponad 110 krajów. Oprócz eliminacji komarów trwają prace nad szczepionką, jak również lekiem skierowanym bezpośrednio przeciw wirusowi.
Historia
Pierwszy odnotowany przypadek odpowiadający prawdopodobnie dendze opisuje chińska encyklopedia medyczna z czasów dynastii Jin panującej w latach 265–420 n.e. Pisze ona o „zatruciu wodnym” związanym z latającymi owadami[1][2]. Główny wektor A. aegypti rozprzestrzenił się z Afryki od XV do XIX wieku, po części na skutek handlu niewolnikami[3]. Zachowały się opisy epidemii z XVII stulecia, ale najbardziej wiarygodne wczesne doniesienia o epidemii pochodzą z 1779 i 1780, gdy epidemia przetoczyła się przez Azję, Afrykę i Amerykę Północną[2]. Od 1940 epidemie zdarzały się rzadko[2].
W 1906 potwierdzono przenoszenie przez komary Aedes. W 1907 denga została drugą po żółtej febrze chorobą, której udowodniono etiologię wirusową[4]. Dalsze badania autorstwa Clelanda i Silera uzupełniły podstawowe rozumienie transmisji dengi[4].
Podczas II wojny światowej denga zebrała duże żniwo na Nowej Gwinei, podczas bitwy o Buna-Gona. W dużej temperaturze przy wilgotności sięgającej 85% miały tam miejsce endemiczne zachorowania na dengę[5] (zachorowało 2147 amerykańskich żołnierzy), malarię (5358 zachorowań w siłach USA[6]), dur, czerwonkę bakteryjną, wrzód tropikalny, grzybicę woszczynową i inne grzybice skóry[5].
Rozprzestrzenianie się dengi w czasie i po II wojnie światowej przypisano zakłóceniu równowagi ekologicznej. Te same tendencje doprowadziły też do rozprzestrzenienia się różnych serotypów na nowe tereny i do powstania gorączki krwotocznej. Ta ciężka postać dengi odnotowana została po raz pierwszy na Filipinach w 1953. Do lat 70. stała się główną przyczyną umieralności dzieci, w latach 70. choroba reintrodukowana została do Ameryki i na wyspy Pacyfiku, gdzie doprowadziła do epidemii[2]. Gorączkę krwotoczną i zespół wstrząsu odnotowano po raz pierwszy w Ameryce Łacińskiej w 1981 w związku z zarażeniem DENV-2 ludności zainfekowanej kilka lat wcześniej wirusem DENV-1[7].
Etymologia
Pochodzenie hiszpańskiego słowa dengue nie jest pewne. Może ono pochodzić od dinga, słowa w języku suahili z frazy Ka-dinga pepo określającej chorobę wywoływaną przez złego ducha[1]. Niewolnicy w Indiach Zachodnich zarażeni dengą określani byli jako posiadający posturę i chód dandysów. Chorobę znano jako „dandy fever”[8][9].
Termin „breakbone fever” zastosował lekarz i ojciec założyciel Stanów Zjednoczonych Benjamin Rush w doniesieniu z 1789 opisującym epidemię z 1780 w Filadelfii. W swym artykule użył bardziej formalnego terminu „bilious remitting fever” (co znaczy „żółciowa gorączka remitująca”)[10]. Słowo dengue fever („denga”) weszło do powszechnego użycia dopiero po 1828[9]. Inne nazwy historyczne to „breakheart fever” i „la dengue”[9]. Terminy określające ciężką postać choroby to „infectious thrombocytopenic purpura” (co znaczy „infekcyjna plamica małopłytkowa”) i „Philippine”, „Thai” lub „Singapore hemorrhagic fever” (co znaczy „gorączka krwotoczna filipińska, tajska bądź singapurska”)[9].
Objawy

Ludzie zainfekowani wirusem dengi najczęściej (80%) nie wykazują objawów lub prezentują łagodne symptomy, jak niepowikłana gorączka[11][12][13]. U niektórych rozwija się cięższa postać choroby (5%), w niewielkim odsetku zagrażająca ich życiu[11][13]. Okres inkubacji wynosi od 3 do 14 dni, najczęściej od 4 do 7 dni[14]. W związku z tym podróżnicy wracający z obszarów endemicznego występowania choroby cechują się niewielkim prawdopodobieństwem dengi, jeśli rozwinęli gorączkę ponad 2 tygodnie po powrocie do domu[15]. Dzieci często prezentują objawy przypominające typowe dla przeziębienia albo zapalenia żołądkowo-jelitowego (wymioty i biegunka)[16], grozi im też większe ryzyko ciężkich komplikacji[15][3], choć początkowo objawy, jeśli nie brać pod uwagę wysokiej gorączki, są ogólnie łagodne[3].
Przebieg

Charakterystyczne objawy choroby obejmują nagle pojawiającą się gorączkę, ból głowy (zlokalizowany typowo za oczami), mięśni i stawów oraz wysypkę. Odnosi się do nich alternatywna anglojęzyczna nazwa „breakbone fever”[11][18]. Przebieg infekcji podzielono na 3 fazy: gorączki, krytyczną i zdrowienia[17].
Faza gorączkowa przebiega z wysoką gorączką, potencjalnie ponad 40 °C. Wiąże się z uogólnionym bólem i bólem głowy. Trwa zwykle od 2 do 7 dni[17][18]. Mogą się pojawić nudności i wymioty[3]. Wysypkę obserwuje się u 50–80% wykazujących objawy[18][19] w pierwszym bądź drugim dniu występowania symptomów takich jak rumień czy też później, w dniach 4-7, przy wysypce przypominającej odrę[19][20]. W tym momencie pojawić się mogą petechie, niewielkie czerwone punkty na skórze nie zanikające przy ucisku, spowodowane pękaniem naczyń krwionośnych[17] oraz pewne łagodne krwawienia z błon śluzowych jamy ustnej i nosa[15][18]. Gorączka klasycznie wykazuje dwufazowość: słabnie i nawraca na 1 lub 2 dni, choć istnieje wysoka różnorodność w częstości rzeczywistego występowania takiego wzoru[20][7].
U niektórych pacjentów choroba rozwija fazę krytyczną mniej więcej w czasie, gdy gorączka ustępuje[3]. Faza ta typowo trwa 1-2 dni[17]. Może wystąpić wtedy znaczna akumulacja płynu w klatce piersiowej i jamie brzusznej z powodu zwiększonej przepuszczalności naczyń i przechodzenia płynu. Prowadzi to do hipowolemii i hipoperfuzji[17]. Podczas tej fazy może pojawić się dysfunkcja narządów i poważne krwotoki, typowo z przewodu pokarmowego[15][17]. Wstrząs i krwotoki występują rzadziej, niż w 5% wszystkich przypadków dengi[15], jednakże ozdrowieńcy zainfekowani wcześniej innym serotypem dengi („infekcja wtórna”), znajdują się w stanie podwyższonego ryzyka[15][21]. Ta krytyczna faza, choć rzadka, pojawia się względnie częściej u dzieci i młodszych dorosłych[3].
Następnie następuje faza zdrowienia. Nagromadzony płyn ulega resorpcji, powracając do naczyń krwionośnych[17]. Trwa to zazwyczaj 2-3 dni[15]. Poprawa często wydaje się zaskakująca. Mogą jej towarzyszyć ciężki świąd i bradykardia[15][17]. Może pojawić się inna wysypka, o wyglądzie plamisto-grudkowym bądź charakterystycznym dla uszkodzenia naczyń. Poprzedza ona złuszczanie się skóry[3]. Na tym etapie może dojść do hiperwolemii. Jeżeli dotknie ona mózgu prowadząc do obrzęku mózgu, może obniżyć poziom świadomości bądź wywołać drgawki[15]. Uczucie zmęczenia u dorosłych może trwać tygodnie[3].
Nietypowy przebieg
Denga może okazjonalnie zajmować kilka innych układów organizmu[17] w sposób izolowany bądź obok klasycznych objawów choroby[16]. Obniżony poziom świadomości pojawia się u 0,5–6% ciężkich przypadków. Przypisuje się to wirusowemu zapaleniu mózgu lub pośrednio uszkodzeniu ważnych dla życia narządów, między innymi wątroby (encefalopatia wątrobowa)[16][7].
Inne uszkodzenia neurologiczne odnotowane w kontekście dengi to poprzeczne zapalenie rdzenia kręgowego i zespół Guillaina-Barrégo[16]. Zapalenie mięśnia sercowego i ostra niewydolność wątroby należą do rzadszych powikłań[15][17].
Etiologia
Wirus
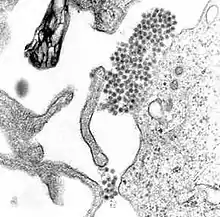
Wirus dengi (DENV) należy do wirusów RNA. Zalicza się go do rodziny Flaviviridae i rodzaju Flavivirus, do którego zaliczają się także wirus żółtej gorączki, wirus zachodniego Nilu, St. Louis encephalitis virus, wirus japońskiego zapalenia mózgu, wirus kleszczowego zapalenia mózgu, wirus gorączki lasu Kyasanur i wirus omskiej gorączki krwotocznej[7]. Większość z nich przenoszą stawonogi (komary i kleszcze), w związku z czym określa się je mianem arbowirusów (arthropod-borne viruses – „wirusy przenoszone przez stawonogi”)[7].
Genom wirusa dengi zawiera około 11 000 zasad azotowych, kodujących 3 różne typy cząsteczek białkowych tworzących cząstkę wirusa nazywaną wirionem: C, prM i E i 7 innych : NS1, NS2a, NS2b, NS3, NS4a, NS4b, NS5, spotykanych jedynie w zainfekowanych komórkach gospodarza i koniecznych dla replikacji wirusa[21][22]. Występują 4 znane wcześniej odmiany wirusa, nazywane serotypami. Określa się jako DENV-1, DENV-2, DENV-3 i DENV-4[12]. W 2013 roku opisano kolejny[23]. Różnice pomiędzy nimi opierają się na antygenowości[24].
Transmisja

Wirusa dengi przenoszą komary z rodzaju Aedes, w szczególności A. aegypti[12]. Komary te żyją zazwyczaj pomiędzy 35° szerokości geograficznej północnej, a 35° szerokości geograficznej południowej poniżej wysokości 1000 m n.p.m.[12] Typowo kłują za dnia, zwłaszcza wczesnym rankiem i wieczorem[25][26], ale zdolne są kłuć i przez to rozprzestrzeniać wirusa w każdej porze doby i roku[27]. Inne gatunki Aedes przenoszące infekcję obejmują A. albopictus, A. polynesiensis i A. scutellaris[12]. Ludzie są żywicielami pierwotnymi wirusa[12][7]. Replikuje się on również wśród innych naczelnych (a nawet w myszach laboratoryjnych), choć rzadko wykazują one typowe dla ludzi objawy[28]. Można nabawić się infekcji na skutek pojedynczego ukłucia[29]. Samica komara pobierająca krew od zainfekowanej osoby podczas początkowego okresu gorączkowego trwającego od 2 do 20 dni sama ulega infekcji wirusem dengi poprzez komórki wyścielające jej jelito[30]. Około 8-10 dni później wirus rozprzestrzenia się na inne tkanki, włączając w to ślinianki komara, ulegając następnie wydzielaniu do śliny. Wirus nie wydaje się wywierać szkodliwego efektu na komara, który pozostaje jego nosicielem przez całe swe życie. Aedes aegypti preferuje składanie jaj w sztucznych zbiornikach na wodę, życie w pobliżu ludzi i karmienie się krwią ich, a nie innych kręgowców[31].
Denga może się także przenosić poprzez preparaty krwi i dawstwo narządów[32][33]. W krajach takich jak Singapur, gdzie denga występuje endemicznie, ryzyko szacuje się na pomiędzy 1,6 i 6 na 10.000 transfuzji[34]. Opisana została także transmisja pionowa (z matki na dziecko) podczas ciąży bądź porodu[35]. Inne sposoby przeniesienia dengi z człowieka na człowieka także zostały odnotowane, ale należą do rzadkości[18]. Zróżnicowanie genetyczne wirusa dengi zależy od regionu, co wskazuje, że obejmowanie nowych terytoriów jest względnie rzadkie pomimo pojawiania się choroby na nowych obszarach w ostatnich dekadach[3].
Predyspozycje
Ciężki przebieg choroby zdarza się częściej u niemowląt i młodszych dzieci. W przeciwieństwie do wielu innych infekcji pojawia się częściej u dzieci względnie dobrze odżywionych[15]. Inne czynniki ryzyka ciężkiego przebiegu obejmują płeć żeńską, wysokie BMI[3] i ilość wirionów[36]. Choć każdy z serotypów może powodować pełne spektrum choroby[21], odmiana również zalicza się do czynników ryzyka[3]. Infekcja jednym serotypem wiąże się z wytworzeniem trwającej całe życie odporności, ale w takim przypadku odporność na pozostałe 3 typy wirusa trwa krótko[12][18]. Ryzyko ciężkiego przebiegu infekcji wtórnej wzrasta, gdy osoba uprzednio kontaktująca się z serotypem DENV-1 otrzymuje serotyp DENV-2 lub DENV-3 lub jeśli ktoś w przeszłości eksponowany na DENV-3 nabywa DENV-2[22]. U osób z chorobami przewlekłymi, jak cukrzyca czy astma, Denga może stanowić zagrożenie życia[22].
Polimorfizm genetyczny wiąże się ze zwiększonym ryzykiem ciężkich powikłań dengi. Podaje się tu przykłady genów kodujących białka znane jako TNF, białko wiążące mannozę[11], CTLA4, TGFβ[21] DC-SIGN, PLCE1 i szczególne allele HLA, antygenu HLA-B[3][22]. Częsta u Afrykanów nieprawidłowość genetyczna znana jako niedobór dehydrogenazy glukozo-6-fosforanowej wydaje się zwiększać to ryzyko[36]. Polimorfizm genów kodujących receptor witaminy D i FcγR wydają się natomiast wiązać z ochroną przed ciężkimi postaciami w przebiegu infekcji wtórnej dengi[22].
Mechanizm
Gdy przenoszący wirusa komar ukłuje człowieka, wirus przechodzi przez skórę razem ze śliną owada. Wiąże się z leukocytami i wnika do nich. Namnaża się w komórkach krążących we krwi. Białe krwinki produkują wiele białek sygnałowych, jak cytokiny, a wśród nich interferony, odpowiadające za wiele objawów choroby, jak gorączka, objawy grypopodobne i ciężkie bóle. W ciężkiej infekcji produkcja wirusa w ciele chorego jest znacznie zwiększona i zajętych może zostać wiele innych narządów, jak wątroba czy szpik kostny. Płyn przecieka z krwiobiegu przez ściany małych naczyń krwionośnych do jam ciała dzięki przepuszczalności naczyń włosowatych. W efekcie mniej krwi krąży w krwiobiegu, a ciśnienie spada do tego stopnia, że nie zapewnia wystarczających ilości krwi najważniejszym dla życia narządom. Wazodylatacja i brak reaktywności na czynniki wazopresyjne nie są uważane za główny mechanizm rozwoju wstrząsu septycznego w dendze[37]. Co więcej, dysfunkcja szpiku kostnego z powodu infekcji komórek zrębu powoduje uszczuplenie ilości trombocytów. Podnosi to ryzyko krwawienia, innego poważnego powikłania dengi[36][38].
Do zmniejszenia liczby trombocytów również dochodzi w wyniku ich obwodowego niszczenia, w którym biorą udział mechanizmy immunologiczne. Prawdopodobnie dochodzi do tego w wyniku odpowiedzi na wirusa związanego z trombocytem i wytwarzaniem swoistych przeciwciał[39][40] lub w efekcie reakcji krzyżowej wirusowego białka NS-1 z antygenami płytek krwi[41].
Replikacja wirusa
Dostawszy się pod skórę, wirus dengi wiąże się z biorącymi udział w identyfikacji patogenu komórkami Langerhansa[36]. Białko wirusa wiąże się z białkiem powierzchniowym komórki Langerhansa, zwłaszcza lektyną typu C zwaną DC-SIGN, receptorem mannozy i CLEC5A[21]. DC-SIGN, niespecyficzny receptor obcych cząstek obecny na komórkach dendrytycznych, wydaje się być głównym punktem zaczepienia umożliwiającym wirusowi wtargnięcie do komórki[22]. Komórka zmierza wtedy do najbliższego węzła limfatycznego. W tym czasie genom wirusa ulega translacji w otoczonych błoną pęcherzykach siateczki śródplazmatycznej, gdzie należący do komórki gospodarza aparat syntezujący białka produkuje nowe białka wirusowe, które biorą udział w replikacji RNA wirusa i tworzeniu nowych wirionów. Niedojrzałe wiriony transportowane są do aparatu Golgiego, gdzie pewne ich cząsteczki białkowe zyskują niezbędne łańcuchy sacharydowe. Teraz już dojrzałe wiriony pączkują na powierzchni zainfekowanej komórki, ulegając wydaleniu poprzez egzocytozę. Są wtedy zdolne do wnikania do kolejnych leukocytów (monocytów, makrofagów)[21].
Początkowa reakcja zainfekowanych komórek polega na produkcji interferonu, cytokiny podnoszącej poziom odpowiedzi wrodzonego układu immunologicznego przeciwko infekcji wirusowej. Zwiększa on produkcję dużej grupy białek, w mediacji uczestniczy szlak JAK-STAT. Niektóre serotypy wirusa dengi wydają się dysponować mechanizmami spowalniającymi te procesy. Interferon aktywuje także swoistą odpowiedź immunologiczną, co prowadzi do generacji przeciwciał swoistych dla antygenów wirusa oraz limfocytów T bezpośrednio atakujących zainfekowane komórki[21]. Tworzą się różne przeciwciała. Niektóre wiążą się ściśle z białkami wirusa, ułatwiając fagocytozę (a więc wchłanianie i niszczenie) przez wyspecjalizowane komórki, jednak inne wiążą wirusa z gorszym skutkiem. Mogą go przez to nawet dostarczać do fagocytów w miejsce, gdzie nie następuje ich niszczenie i wirus może się w dalszym ciągu namnażać[21].
Ciężki przebieg
Nie jest całkiem jasne, dlaczego infekcja wtórna innym szczepem wirusa dengi wiąże się z ryzykiem gorączki krwotocznej i zespołu wstrząsu. Najszerzej akceptowana hipoteza mówi o zjawisku antibody-dependent enhancement (ADE). Dokładny mechanizm tego zjawiska nie został wyjaśniony. Może wynikać ze słabego wiązania nieneutralizujących przeciwciał i internalizacji do niewłaściwego dla destrukcji wirusa kompartmentu leukocytu[21][22]. Podejrzewa się, że ADE nie jest jedynym mechanizmem odpowiadającym za ciężkie powikłania dengi[11]. Różne linie badań wskazują na rolę limfocytów T i czynników rozpuszczonych w płynach ustrojowych, jak cytokiny czy układ dopełniacza[36].
Ciężki przebieg dengi wyznaczają problemy związane z przepuszczalnością naczyń włosowatych, z których wydostają się płyn i białka, a także z nieprawidłowym krzepnięciem krwi[16][3]. Zmiany te wydają się wiązać z uszkodzeniem glikokaliksu śródbłonka, działającego jak filtr molekularny dla składników krwi[3]. Nieszczelność kapilar w fazie krytycznej powodowana jest działaniem odpowiedzi immunologicznej[3]. Inne zaangażowane procesy obejmują obecność nekrotycznych objętych infekcją komórek upośledzających zarówno krzepnięcie, jak i fibrynolizę oraz trombocytopenię[36].
Diagnostyka
| Pogarszający się ból brzucha | ||||
| Wymioty | ||||
| Powiększenie wątroby | ||||
| Krwawienie ze śluzówek | ||||
| Wysoki hematokryt przy niskich trombocytach | ||||
| Ospałość, zmęczenie | ||||
| Wybroczyny surowicze | ||||
Diagnoza dengi typowo jest stawiana klinicznie. Opiera się o zgłaszane objawy i badanie fizykalne. Jednak dotyczy to głównie obszarów endemicznych[11]. Wczesny etap choroby może być trudny do odróżnienia od innych infekcji wirusowych[15]. Diagnoza prawdopodobna bazuje na stwierdzeniu gorączki i dwóch z następujących objawów: nudności i wymioty, wysypka, bóle uogólnione, leukopenia, objaw Rumpla-Leedego lub jakikolwiek objaw alarmujący (wymieniono w tabeli) u osoby żyjącej na obszarze endemicznym[42]. Objawy alarmujące typowo pojawiają się przed rozwinięciem się ciężkiej postaci[17]. Objaw opaskowy Rumpla-Leedego jest szczególnie użyteczny w okolicznościach braku dostępu do badań laboratoryjnych. Wymaga on użycia aparatu do mierzenia ciśnienia. Zakłada się mankiet na pięć minut, ustawiając ciśnienie pomiędzy wartością ciśnień skurczowego i rozkurczowego. Następnie zlicza się powstałe wybroczynki (petechie). Wyższa liczba uprawdopodobnia diagnozę dengi. Punkt odcięcia wynosi ponad 10-20 na cal2 (6,25 cm2)[17][43][44].
Diagnozę dengi należy rozważyć u osoby rozwijającej gorączkę w ciągu dwóch tygodni od pobytu w rejonach zwrotnikowych lub podzwrotnikowych[45]. Trudności może przedstawiać odróżnienie dengi od chikungunya, podobnej infekcji wirusowej. Łączy je wiele podobnych objawów i występują w podobnych rejonach świata[18]. Często wyklucza się też inne przyczyny podobnych objawów, jak malaria, leptospiroza, wirusowe gorączki krwotoczne, dur brzuszny, infekcja meningokokowa, odra i grypa[15][46].
Najwcześniejsza zmiana wykrywalna laboratoryjnie to niski poziom leukocytów, który może poprzedzać trombocytopenię i kwasicę metaboliczną[15]. Umiarkowanie podniesiony poziom wątrobowych aminotransferaz asparaginianowej i alaninowa często wiąże się z trombocytopenią i leukopenią[3]. W ciężkim przebiegu niedobór osocza skutkuje wysokim hematokrytem i hipoalbuminemią[15]. Płyn w jamie opłucnej czy wodobrzusze można wykryć badaniem przedmiotowym, gdy są duże[15], ale wykazanie płynu ultrasonograficznie może pomóc we wczesnej identyfikacji zespołu wstrząsowego[11][15]. Użycie ultradźwięków ogranicza niedostępność w wielu miejscach[11]. Zespół wstrząsu występuje w przypadku obniżenia się ciśnienia tętna do ≤ 20 mm Hg z współwystępowaniem zamknięcia naczyń obwodowych[3], które wyrażają u dzieci opóźniony powrót włośniczkowy, przyśpieszenie akcji serca lub chłodne kończyny[17].
Klasyfikacja
Klasyfikacja World Health Organization z 2009 dzieli dengę na dwie grupy: niepowikłaną i ciężką[11][42]. Podział ten zastępuje poprzednią klasyfikację WHO z 1997, która, uznawana za zbyt restrykcyjną, wymagała uproszczenia, choć jest cały czas w szerokim użyciu[42], włączając World Health Organization's Regional Office dla Azji Południowo-Wschodniej w 2011[47]. Denga o ciężkim przebiegu definiowana jest jako związana z ciężkim krwawieniem, ciężką dysfunkcją narządową lub ciężki niedoborem osocza, wszystkie pozostałe przypadki są niepowikłane[42]. Klasyfikacja z 1997 podzieliła dengę na undifferentiated fever, dengue fever i dengue hemorrhagic fever[15][48]. Tę ostatnią podzielono później na stopnie I–IV. Stopień I wiąże się z obecnością jedynie łatwego siniaczenia się i dodatniego testu opaskowego. W II pojawia się spontaniczne krwawienie, m.in. w obrębie skóry. W III występują kliniczne objawy wstrząsu. W IV wstrząs jest tak poważny, że ciśnienie krwi i puls są nieoznaczalne[48]. Stopnie III i IV określane są po angielsku jako „dengue shock syndrome”[42][48].
Badania laboratoryjne

Diagnozę dengi mogą potwierdzić badania mikrobiologiczne[42][49]. Wykorzystuje się w nich izolację wirusa z hodowli komórkowej, wykrywanie kwasów nukleinowych metodą PCR, wykrywanie antygenów wirusowych, jak NS1, lub swoistych przeciwciał (serologia)[22][46]. Izolacja wirusa i wykrywanie kwasów nukleinowych cechują się większą dokładnością niż szukanie antygenów, ale nie są powszechnie dostępne z uwagi na wyższe koszty[46]. Wykrywalność NS1 podczas fazy gorączkowej infekcji pierwotnej może przekraczać 90%, ale wynosi tylko 60–80% w kolejnych infekcjach[3]. Na wczesnym etapie choroby wszystkie badania mogą wyjść ujemnie[15][22]. PCR i wykrywanie antygenów wirusa są bardziej dokładne w pierwszym tygodniu[3]. W 2012 wprowadzono test PCR wymagający wyposażenia używanego do diagnozowania grypy. Może to poprawić dostęp do diagnostyki na bazie PCR[50].
Te badania laboratoryjne mają wartość diagnostyczną jedynie w ostrej fazie choroby. Wyjątek stanowią testy serologiczne. Metody wykrywające specyficzne dla antygenów wirusa dengi przeciwciała typu G i M mogą służyć do potwierdzenia diagnozy w późniejszych stadiach infekcji. IgG i IgM produkowane są po 5–7 dniach. Najwyższe miana (poziomy) IgM wykrywa się podczas infekcji pierwotnej, choć produkowane są one również podczas infekcji wtórnej. Po 30-90 dniach po pierwotnej infekcji stają się niewykrywalne. W przypadku reinfekcji następuje to szybciej. W odróżnieniu od ich IgG dają się wykryć przez ponad 60 lat i w przypadku braku objawów stanowią użyteczny wskaźnik przebycia infekcji. W chorobie pierwotnej IgG osiągają maksymalne miana we krwi po 14–21 dniach. W kolejnych reinfekcjach szczyt pojawia się wcześniej, a miana stają się zazwyczaj wyższe. Zarówno IgG, jak i IgM zapewniają odporność na infekujący serotyp wirusa[18][22][51]. Badania laboratoryjne wykrywające IgG czy IgM mogą dawać wyniki fałszywie dodatnie na skutek reakcji krzyżowych z innymi flawiwirusami po niedawnych infekcjach bądź szczepionce na żółtą febrę lub japońskie zapalenie mózgu[3]. Wykrycia samego IgG nie uznaje się za diagnostyczne, chyba że próbki krwi pobrano z odstępem czternastodniowym, obserwując ponad czterokrotny wzrost poziomu specyficznych IgG. U osoby objawowej za diagnostyczne uważa się już samo wykrycie IgM[51].
Prewencja

Nie istnieje dopuszczona szczepionka na wirusa dengi[11]. Prewencja opiera się więc na kontroli i ochronie przed ukłuciami komarów przenoszących chorobę[25][52]. Światowa Organizacja Zdrowia rekomenduje program Integrated Vector Control („Zintegrowana Kontrola Wektorów”) składający się z pięciu elementów[25]:
- poparcie, mobilizacja społeczna i legislacyjna w celu zapewnienia wzmocnienia ciał ochrony zdrowia i społeczności
- współpraca pomiędzy zdrowiem i innymi sektorami (publicznymi i prywatnym)
- zintegrowane kroki ku kontroli choroby i maksymalnym wykorzystaniu zasobów
- oparte na faktach decyzje w celu upewnienia się, że wszystkie interwencje są właściwie ukierunkowane
- capacity-building w celu zapewnienia adekwatnej w stosunku do lokalnej sytuacji odpowiedzi
Główna metoda kontroli A. aegypti polega na eliminacji jego siedlisk[25]. Polega ona na opróżnianiu zbiorników wody bądź dodawaniu insektycydów lub biologicznych środków kontroli w tych obszarach[25], choć rozpylanie związków fosforoorganicznych czy pyretroidów nie wydaje się efektywne[13]. Redukcja otwartych zbiorników wodnych poprzez modyfikację środowiska stanowi preferowaną metodę kontroli w związku z zagrożeniem negatywnymi efektami zdrowotnymi wywoływanymi przez insektycydy czy trudnościami logistycznymi w użyciu środków kontrolnych[25]. Ludność może chronić się przed komarami poprzez całkowite zakrywanie skóry odzieżą, użycie moskitier podczas odpoczynku lub stosowanie repelentów (najefektywniejszy jest DEET)[29].
Leczenie
Nie istnieją swoiste leki przeciwwirusowe przeciwko wirusowi dengi. Ważną rolę odgrywa utrzymanie odpowiedniej równowagi wodno-elektrolitowej[3]. Leczenie zależy od objawów. Waha się od nawadniania doustnego w domu chorego do leczenia szpitalnego z dożylną podażą płynów lub transfuzją krwi[53]. Decyzja o hospitalizacji typowo zależy od obecności objawów alarmujących (zgrupowanych w tabelce powyżej) w połączeniu z poprzedzającym chorobę stanem zdrowia[15].
Nawadnianie dożylne zazwyczaj niezbędne jest przez dzień-dwa[53]. Ilość dostarczanych płynów zależy od ilości oddawanego moczu (docelowo 0,5–1 mL/kg/h), stabilnych objawów życiowych i normalizacji hematokrytu[15]. Inwazyjne procedury medyczne, jak wprowadzenie przez nos sondy żołądkowej, wstrzyknięcia domięśniowe czy uzyskiwanie dostępu dotętniczego, są unikane ze względu na ryzyko krwawienia[15]. Paracetamol stosuje się jako lek przeciwgorączkowy i przeciwbólowy, gdyż niesterydowe leki przeciwzapalne jak ibuprofen czy kwas acetylosalicylowy mogą zwiększyć ryzyko krwawień, dlatego też się ich unika[53]. Transfuzje rozpoczyna się wcześniej u pacjentów prezentujących niestabilne objawy życiowe w obliczu spadającego hematokrytu, nie czekając na spadek hemoglobiny do jakiegoś zdefiniowanego poziomu[54]. Rekomenduje się koncentrat krwinek czerwonych bądź krew pełną, w przeciwieństwie do podaży płytek czy świeżo mrożonego osocza[54].
Podczas fazy rekonwalescencji odstawia się płyny dożylne, by nie dopuścić do hiperwolemii[15]. Jeśli jednak do niej dojdzie przy stabilnych objawach życiowych, może wystarczyć odstawianie rzeczonych płynów dożylnych[54]. Jeśli chory znajduje się poza fazą krytyczną, diuretyki pętlowe jak furosemid mogą zostać użyte w celu eliminacji nadmiaru płynu w organizmie[54].
Epidemiologia

Epidemie dengi na obszarze występowania A. aegypti
Obszar występowania A. aegypti bez epidemii dengi
Większość ludzi chorych na dengę powraca do zdrowia bez następstw[42]. Śmiertelność w przypadku braku leczenia wynosi 1–5%[15], a poniżej 1% przy zastosowaniu odpowiedniego postępowania[42]. Jednak ciężka postać choroby cechuje się śmiertelnością 26%[15]. Denga występuje endemicznie w ponad 110 państwach[15]. Rocznie infekuje od 50 do 390 milionów ludzi na świecie, prowadząc do pół miliona hospitalizacji[11][55] i szacunkowo 25 000 zgonów[16]. W pierwszej dekadzie XXI wieku w 12 krajach Azji Południowo-Wschodniej ilość zakażeń szacowano na 3 000 000, a zgonów na 6 000 rocznie[56].
Jako najczęstsza choroba wirusowa przenoszona przez stawonogi[21], denga w krajach występowania endemicznego w Azji i Ameryce zabiera 1300 lat życia skorygowanych niesprawnością na milion osób[22]. Jako choroba tropikalna denga otrzymała w 1998 drugie miejsce wedle ważności po malarii[15], choć WHO wylicza dengę wśród 17 zapomnianych chorób tropikalnych[57].
Zapadalność na dengę wzrosła 30 razy pomiędzy 1960 i 2010[58]. Tłumaczy się to kombinacją urbanizacji, wzrostu liczebności populacji, upowszechnienia podróży międzynarodowych i globalnego ocieplenia[11]. Rozmieszczenie geograficzne obejmuje tereny leżące wokół równika, na których żyje 70% z całkowitej liczby 2,5 miliarda ludzi zamieszkujących rejony endemiczne w Azji i nad Pacyfikiem[58]. W USA ilość infekcji dengi wśród powracających z obszarów endemicznych choroby wynosi 3–8%[29]. Czyni to dengę drugą najpowszechniej diagnozowaną w tej grupie infekcją, po malarii[18].
Jak większość arbowirusów, wirus dengi utrzymuje się w środowisku dzięki cyklom obejmującym żywiące się krwią wektory i gospodarzy-kręgowców[59]. W lasach Azji Południowo-Wschodniej i Afryki transmisja odbywa się z samicy komara z rodzaju Aedes innego, niż A. aegypti, na jej potomstwo i pewne naczelne, określane jako „niższe”[59]. Na terenach miejskich wirus przenosi się głównie dzięki związanemu z człowiekiem A. aegypti. W osadach wiejskich wirusa przenoszą na człowieka A. aegypti i inne gatunki z rodzaju Aedes, jak A. albopictus[59]. Oba te gatunki powiększyły swój zasięg występowania w drugiej połowie XX wieku[3]. W każdym wypadku zainfekowanie człowieka czy innych naczelnych zwiększa liczebność krążącego wirusa, gdyż ulega on amplifikacji[59]. Infekcje zdarzają się najczęściej w środowisku miejskim[60]. W ostatnich dekadach ekspansja wsi i miast na terenach endemicznych i zwiększona mobilność ludzi zwiększyły częstość epidemii i krążącego wirusa. Denga, ograniczona niegdyś do Azji Południowo-Wschodniej, rozprzestrzenia się teraz na południu Chin, w krajach pacyficznych i Ameryce[60], może też stanowić zagrożenie w Europie[13].
Badania

Badania prowadzone w celu prewencji i leczenia dengi obejmują różne środki kontroli wektorów[61], tworzenie szczepionki i leków przeciwwirusowych[62].
Jeśli chodzi o kontrolę wektorów, wprowadzono do użycia wiele nowych metod redukujących ilość komarów. Osiągnięto pewien sukces, do którego zalicza się wprowadzenie ryby Poecilia reticulata lub widłonogów do wód stojących. Organizmy te zjadają larwy komarów[61]. Media donosiły o wysiłkach w celu infekcji komarów bakterią Wolbachia, co czyniłoby komary po części oporne na wirusa dengi[3][63]. Prowadzi się też badania nad zmodyfikowanym genetycznie samcem A. aegypti, który po wypuszczeniu na wolność płodziłby z samicami potomstwo niezdolne do lotu[64].
Trwają programy, których celem jest stworzenie szczepionki chroniącej przed wszystkimi 4 serotypami dengi[52]. Jednym z zagrożeń jest jednak możliwość zwiększania przez taką szczepionkę ryzyka ciężkich postaci dengi poprzez antibody-dependent enhancement (ADE)[65]. Idealna szczepionka byłaby bezpieczna, efektywna po jednej bądź dwu dawkach, obejmowałaby wszystkie serotypy, byłaby łatwa w transporcie i przechowywaniu, a do tego niedroga i opłacalna ekonomicznie[65]. W 2012 testowano liczne szczepionki[26][65]. Kolejne pomyślne testy przeprowadzono w 2014[66]. Najbardziej zaawansowana bazuje na osłabionym połączeniu wirusów żółtej febry i każdego z 4 znanych od dawna serotypów dengi[26][67]. Istnieje szansa, że pierwsze produkty pojawią się na rynku do 2015[52].
Prócz wysiłków w celu kontroli rozprzestrzeniania się komara Aedes i pracy nad stworzeniem szczepionki prowadzi się też działania nad powstaniem leków przeciwwirusowych, które służyłyby do leczenia ataków dengi i zapobiegałyby ciężkim powikłaniom[68][69]. Odkrycie struktury białek wirusa może wspomóc stworzenie efektywnych lekarstw[69]. Istnieje kilka ewentualnych celów molekularnych. Pierwszy sposób polega na hamowaniu wirusowej RNA-polimerazy, kodowanej przez NS5, białka kopiującego materiał genetyczny wirusa, dzięki analogom nukleozydów. Kolejny obejmuje stworzenie specyficznych inhibitorów wirusowej proteazy kodowanej przez NS3, rozcinającej białka wirusowe[70]. W końcu może okazać się możliwe wytworzenie inhibitorów wejścia wirusa do komórek, co zahamowałoby wnikanie wirionów do komórek, a także inhibitorów tworzenia czapeczki na końcu 5', niezbędnej w replikacji wirusa[68].
Klasyfikacja ICD10
| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: A90 | Gorączka denga (denga klasyczna) |
| ICD-10: A91 | Gorączka krwotoczna denga |
Przypisy
- 1 2 Anonymous. Etymologia: dengue. „Emerg. Infec. Dis.”. 12 (6), s. 893, 2006. DOI: 10.3201/eid1206.ET1206.
- 1 2 3 4 Gubler DJ. Dengue and dengue hemorrhagic fever. „Clin. Microbiol. Rev.”. 11 (3), s. 480–96, 07 1998. PMID: 9665979. PMCID: PMC88892.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Simmons CP, Farrar JJ, Nguyen vV, Wills B. Dengue. „N Engl J Med”. 366 (15), s. 1423–32, 04 2012. DOI: 10.1056/NEJMra1110265. PMID: 22494122.
- 1 2 Henchal E.A., Putnak J.R.. The dengue viruses. „Clin. Microbiol. Rev.”. 3 (4), s. 376–96, 10 1990. DOI: 10.1128/CMR.3.4.376. PMID: 2224837. PMCID: PMC358169.
- 1 2 Samuel Milner: Victory in Papua. Washington: Office of the Chief of Military History, Dept. of the Army, 1989, s. 126, seria: United States Army In World War II.
- ↑ Samuel Milner: Victory in Papua. Washington: Office of the Chief of Military History, Dept. of the Army, 1989, s. 372, seria: United States Army In World War II.
- 1 2 3 4 5 6 Gould EA, Solomon T. Pathogenic flaviviruses. „The Lancet”. 371 (9611), s. 500–9, 02 2008. DOI: 10.1016/S0140-6736(08)60238-X. PMID: 18262042.
- ↑ Anonymous: Definition of Dandy fever. MedicineNet.com, 1998-06-15. [dostęp 2010-12-25].
- 1 2 3 4 Halstead SB: Dengue (Tropical Medicine: Science and Practice). River Edge, N.J.: Imperial College Press, 2008, s. 1–10. ISBN 1-84816-228-6.
- ↑ Barrett AD, Stanberry LR: Vaccines for biodefense and emerging and neglected diseases. San Diego: Academic, 2009, s. 287–323. ISBN 0-12-369408-6.
- 1 2 3 4 5 6 7 8 9 10 11 12 Whitehorn J, Farrar J. Dengue. „Br. Med. Bull.”. 95, s. 161–73, 2010. DOI: 10.1093/bmb/ldq019. PMID: 20616106.
- 1 2 3 4 5 6 7 WHO 2009 ↓, s. 14–16
- 1 2 3 4 Reiter P. Yellow fever and dengue: a threat to Europe?. „Euro Surveill”. 15 (10), s. 19509, 2010-03-11. PMID: 20403310.
- ↑ Gubler 2010 ↓, s. 379
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Ranjit S, Kissoon N. Dengue hemorrhagic fever and shock syndromes. „Pediatr. Crit. Care Med.”. 12 (1), s. 90–100, 01 2011. DOI: 10.1097/PCC.0b013e3181e911a7. PMID: 20639791.
- 1 2 3 4 5 6 Varatharaj A.. Encephalitis in the clinical spectrum of dengue infection. „Neurol. India”. 58 (4), s. 585–91, 2010. DOI: 10.4103/0028-3886.68655. PMID: 20739797.
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 WHO 2009 ↓, s. 25–27
- 1 2 3 4 5 6 7 8 9 Chen LH, Wilson ME. Dengue and chikungunya infections in travelers. „Curr. Opin. Infect. Dis.”. 23 (5), s. 438–44, 10 2010. DOI: 10.1097/QCO.0b013e32833c1d16. PMID: 20581669.
- 1 2 Viral infections of skin and mucosa. W: Wolff K, Johnson RA (red.): FitzPatrick’s color atlas and synopsis of clinical dermatology. Wyd. 6. New York: McGraw-Hill Medical, 2009, s. 810–2. ISBN 978-0-07-159975-7.
- 1 2 Tropical medicine. W: Knoop KJ, Stack LB, Storrow A, Thurman RJ (red.): Atlas of emergency medicine. Wyd. 3. New York: McGraw-Hill Professional, 2010, s. 658–9. ISBN 0-07-149618-1.
- 1 2 3 4 5 6 7 8 9 10 Rodenhuis-Zybert IA, Wilschut J, Smit JM. Dengue virus life cycle: viral and host factors modulating infectivity. „Cell. Mol. Life Sci.”. 67 (16), s. 2773–86, 08 2010. DOI: 10.1007/s00018-010-0357-z. PMID: 20372965.
- 1 2 3 4 5 6 7 8 9 10 11 Guzman MG, Halstead SB, Artsob H, et al.. Dengue: a continuing global threat. „Nat. Rev. Microbiol.”. 8 (12 Suppl), s. S7–S16, 12 2010. DOI: 10.1038/nrmicro2460. PMID: 21079655.
- ↑ Normile D. Surprising new dengue virus throws a spanner in disease control efforts. „Science”. 342 (6157), s. 415, 2013. DOI: 10.1126/science.342.6157.415. PMID: 24159024. (ang.).
- ↑ Tony Solomonides: Healthgrid applications and core technologies : proceedings of HealthGrid 2010. Wyd. [Online-Ausg.]. Amsterdam: IOS Press, 2010, s. 235. ISBN 978-1-60750-582-2.
- 1 2 3 4 5 6 WHO 2009 ↓, s. 59–60
- 1 2 3 Global Strategy For Dengue Prevention And Control. World Health Organization, 2012, s. 16–17. ISBN 978-92-4-150403-4.
- ↑ Travelers' Health Outbreak Notice, Centers for Disease Control and Prevention, 2 czerwca 2010 [dostęp 2010-08-27] [zarchiwizowane z adresu 2010-08-26].
- ↑ Kristina B. Clark, Nattawat Onlamoon Hui-Mien Hsiao Guey C. Perng & Francois Villinger. Can non-human primates serve as models for investigating dengue disease pathogenesis?. „Frontiers in Microbiology”. 4, s. 305, 2013. DOI: 10.3389/fmicb.2013.00305. PMCID: PMC3795305. (ang.).
- 1 2 3 Center for Disease Control and Prevention: Chapter 5 – dengue fever (DF) and dengue hemorrhagic fever (DHF). [w:] 2010 Yellow Book [on-line]. [dostęp 2010-12-23].
- ↑ Vassil St. Georgiev ; foreword by Anthony S. Fauci: National Institute of Allergy and Infectious Diseases, NIH.. Wyd. 1. Totowa, N.J.: Humana, 2009, s. 268. ISBN 978-1-60327-297-1.
- ↑ Gubler 2010 ↓, s. 377–78
- ↑ Wilder-Smith A, Chen LH, Massad E, Wilson ME. Threat of dengue to blood safety in dengue-endemic countries. „Emerg. Infect. Dis.”. 15 (1), s. 8–11, 01 2009. DOI: 10.3201/eid1501.071097. PMID: 19116042. PMCID: PMC2660677.
- ↑ Stramer SL, Hollinger FB, Katz LM, et al.. Emerging infectious disease agents and their potential threat to transfusion safety. „Transfusion”. 49 Suppl 2, s. 1S–29S, 8 2009. DOI: 10.1111/j.1537-2995.2009.02279.x. PMID: 19686562.
- ↑ Teo D, Ng LC, Lam S. Is dengue a threat to the blood supply?. „Transfus Med”. 19 (2), s. 66–77, 04 2009. DOI: 10.1111/j.1365-3148.2009.00916.x. PMID: 19392949. PMCID: PMC2713854.
- ↑ Wiwanitkit V. Unusual mode of transmission of dengue. „Journal of Infection in Developing Countries”. 4 (1), s. 51–4, 01 2010. PMID: 20130380.
- 1 2 3 4 5 6 Martina BE, Koraka P, Osterhaus AD. Dengue virus pathogenesis: an integrated view. „Clin. Microbiol. Rev.”. 22 (4), s. 564–81, 10 2009. DOI: 10.1128/CMR.00035-09. PMID: 19822889. PMCID: PMC2772360.
- ↑ S. Rajapakse, C. Rodrigo, S. Maduranga, AC. Rajapakse. Corticosteroids in the treatment of dengue shock syndrome.. „Infect Drug Resist”. 7, s. 137-43, 2014. DOI: 10.2147/IDR.S55380. PMID: 24899817.
- ↑ A. Sridharan, Q. Chen, KF. Tang, EE. Ooi i inni. Inhibition of megakaryocyte development in the bone marrow underlies dengue virus-induced thrombocytopenia in humanized mice.. „J Virol”. 87 (21), s. 11648-58, Nov 2013. DOI: 10.1128/JVI.01156-13. PMID: 23966397.
- ↑ M. Saito, K. Oishi, S. Inoue, EM. Dimaano i inni. Association of increased platelet-associated immunoglobulins with thrombocytopenia and the severity of disease in secondary dengue virus infections.. „Clin Exp Immunol”. 138 (2), s. 299-303, Nov 2004. DOI: 10.1111/j.1365-2249.2004.02626.x. PMID: 15498040.
- ↑ S. Wang, R. He, J. Patarapotikul, BL. Innis i inni. Antibody-enhanced binding of dengue-2 virus to human platelets.. „Virology”. 213 (1), s. 254-7, Oct 1995. DOI: 10.1006/viro.1995.1567. PMID: 7483271.
- ↑ DS. Sun, CC. King, HS. Huang, YL. Shih i inni. Antiplatelet autoantibodies elicited by dengue virus non-structural protein 1 cause thrombocytopenia and mortality in mice.. „J Thromb Haemost”. 5 (11), s. 2291-9, Nov 2007. DOI: 10.1111/j.1538-7836.2007.02754.x. PMID: 17958746.
- 1 2 3 4 5 6 7 8 9 WHO 2009 ↓, s. 10–11
- ↑ Scott Halstead: Volume 5 of Tropical medicine. Imperial College Press, 2008, s. 429. ISBN 978-1-84816-229-7.
- ↑ Scott B. Halstead: Dengue. London: Imperial College Press, 2008, s. 180. ISBN 978-1-84816-228-0.
- ↑ CP Simmons, Farrar, JJ; Nguyen, vV; Wills, B. Dengue. „The New England Journal of Medicine”. 366 (15), s. 1423–32, 2012-04-12. DOI: 10.1056/NEJMra1110265. PMID: 22494122.
- 1 2 3 WHO 2009 ↓, s. 90–95
- ↑ Comprehensive guidelines for prevention and control of dengue and dengue haemorrhagic fever.. Nowe Delhi, India: World Health Organization Regional Office for South-East Asia, 2011, s. 17. ISBN 978-92-9022-387-0.
- 1 2 3 Chapter 2: clinical diagnosis. W: WHO: Dengue haemorrhagic fever: diagnosis, treatment, prevention and control. Wyd. 2. Geneva: World Health Organization, 1997, s. 12–23. ISBN 92-4-154500-3.
- ↑ V Wiwanitkit. Dengue fever: diagnosis and treatment. „Expert review of anti-infective therapy”. 8 (7), s. 841–5, 2010 Jul. DOI: 10.1586/eri.10.53. PMID: 20586568.
- ↑ New CDC test for dengue approved, Centers for Disease Control and Prevention, 20 czerwca 2012.
- 1 2 Gubler 2010 ↓, s. 380
- 1 2 3 WHO 2009 ↓, s. 137
- 1 2 3 WHO 2009 ↓, s. 32–37
- 1 2 3 4 WHO 2009 ↓, s. 40–43
- ↑ Bhatt S, Gething PW, Brady OJ, et al.. The global distribution and burden of dengue. „Nature”. 496 (7446), s. 504–7, 04 2013. DOI: 10.1038/nature12060. PMID: 23563266. PMCID: PMC3651993.
- ↑ Duane J Gubler, Shepard DS, Undurraga EA, Halasa YA. Economic and disease burden of dengue in Southeast Asia. „PLoS Negl Trop Dis”. 7 (2), s. e2055, 2013. DOI: 10.1371/journal.pntd.0002055. PMID: 23437406. PMCID: PMC3578748.
- ↑ Neglected Tropical Diseases, The 17 neglected tropical diseases, World Health Organization [dostęp 2013-04-10].
- 1 2 WHO 2009 ↓, s. 3
- 1 2 3 4 Gubler 2010 ↓, s. 376
- 1 2 Gubler 2010 ↓, s. 377
- 1 2 WHO 2009 ↓, s. 71
- ↑ WHO 2009 ↓, s. 137–146
- ↑ 'Bug' could combat dengue fever. [w:] BBC NEWS [on-line]. British Broadcasting Corporation, 2-01-2009.
- ↑ I Fong: Challenges in Infectious Diseases. Springer, 2013, s. 219. ISBN 978-1-4614-4496-1.
- 1 2 3 Webster DP, Farrar J, Rowland-Jones S. Progress towards a dengue vaccine. „Lancet Infect Dis”. 9 (11), s. 678–87, 11 2009. DOI: 10.1016/S1473-3099(09)70254-3. PMID: 19850226.
- ↑ Maria Rosario Capeding, Huu Tran, Rezeki S Hadinegoro. Clinical efficacy and safety of a novel tetravalent dengue vaccine in healthy children in Asia: a phase 3, randomised, observer-masked, placebo-controlled trial. „The Lancet”, Early Online Publication, 11 July 2014. DOI: 10.1016/S0140-6736(14)61060-6. (ang.).
- ↑ Guy B, Barrere B, Malinowski C, Saville M, Teyssou R, Lang J. From research to phase III: preclinical, industrial and clinical development of the Sanofi Pasteur tetravalent dengue vaccine. „Vaccine”. 29 (42), s. 7229–41, 9 2011. DOI: 10.1016/j.vaccine.2011.06.094. PMID: 21745521.
- 1 2 Sampath A, Padmanabhan R. Molecular targets for flavivirus drug discovery. „Antiviral Res.”. 81 (1), s. 6–15, 01 2009. DOI: 10.1016/j.antiviral.2008.08.004. PMID: 18796313. PMCID: PMC2647018.
- 1 2 Noble CG, Chen YL, Dong H, et al.. Strategies for development of Dengue virus inhibitors. „Antiviral Res.”. 85 (3), s. 450–62, 03 2010. DOI: 10.1016/j.antiviral.2009.12.011. PMID: 20060421.
- ↑ Tomlinson SM, Malmstrom RD, Watowich SJ. New approaches to structure-based discovery of dengue protease inhibitors. „Infectious Disorders Drug Targets”. 9 (3), s. 327–43, 06 2009. DOI: 10.2174/1871526510909030327. PMID: 19519486.
Bibliografia
- Dengue viruses. W: Gubler DJ: Desk Encyclopedia of Human and Medical Virology. Mahy BWJ (editor), Van Regenmortel MHV(editor). Boston: Academic Press, 2010, s. 372–82. ISBN 0-12-375147-0.
- WHO: Dengue Guidelines for Diagnosis, Treatment, Prevention and Control. Geneva: World Health Organization, 2009. ISBN 92-4-154787-1.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.