| Morbilli | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|

Odra (łac. morbilli) – jedna z najbardziej zaraźliwych chorób zakaźnych wieku dziecięcego wywoływana przez należący do rodziny paramyksowirusów wirus odry[1][2][3]. Zidentyfikowano 21 szczepów wirusa[4].
Etiologia i patogeneza
Przyczyną choroby jest jednoniciowy wirus RNA – wirus odry[5][6]. Należy on do rodziny paramyksowirusów i rodzaju Morbilivirus[6].
Do szerzenia się zakażenia dochodzi drogą kropelkową[5]. Okres inkubacji trwa 8–12 (średnio 10) dni[5][7]. Wirus dostaje się do organizmu przez jamę nosowo-gardłową i zakaża komórki nabłonka oddechowego oraz spojówek. Następnie przedostaje się do krwi (wiremia). Za pomocą układu krwionośnego dostaje się do układu siateczkowo-śródbłonkowego oraz innych narządów, gdzie ponownie się replikuje. Po namnożeniu ponownie dochodzi do wiremii i wirus ponownie dostaje się do błon śluzowych górnych dróg oddechowych, spojówek oraz skóry[8]. Zakażenie pozostawia po sobie przemijającą, lecz ciężką immunosupresję[6][9][5][10].
Zakaźność chorego pojawia się około 2 dni przed wystąpieniem objawów i utrzymuje się do 4 dni po wystąpieniu wysypki. Wirus jest obecny w wydzielinie z jamy nosowo-gardłowej, we łzach, moczu i krwi chorego[5]. Przebycie zakażenia wirusem odry daje odporność na tę chorobę na całe życie[11].
Epidemiologia
Zakaźność odry jest bardzo wysoka i przekracza ona 95%[7]. Odpowiada ona corocznie za ponad 40 milionów zakażeń i około 120 000 zgonów na całym świecie (400 dziennie)[6][9][12]. 95% przypadków zgonów ma miejsce w biednych krajach o słabo rozwiniętym systemie opieki zdrowotnej[12]. Do większości zachorowań dochodzi przed 15. rokiem życia, ale podatny na zakażenie jest każdy, kto nie chorował na odrę i nie był szczepiony[13].
Częstość występowania odry znacznie zmalała po wprowadzeniu szczepionek[14]. Choroba w niektórych krajach występuje endemicznie, natomiast w tych krajach, w których uważa się odrę za występującą rzadko, co pewien czas występują epidemie (np. epidemia w Wielkiej Brytanii, spowodowana przez ruchy społeczne i protesty, związane z rzekomym wpływem szczepień przeciw odrze na zwiększone ryzyko wystąpienia autyzmu dziecięcego – co później obalono)[3][15].
W Polsce w roku 2015 na odrę zachorowało 48 osób[16][17]. Wszyscy chorzy przeżyli chorobę[16][17].
W 2017 w Rumunii zachorowało 5562, we Włoszech 5006 i na Ukrainie 4767 osób[18].
Objawy

Choroba przebiega w czterech stadiach: okresie wylęgania, nieżytowym, wysypkowym i zdrowienia[8].
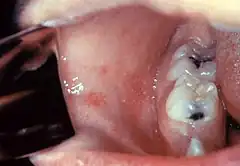
Okres wylęgania (8–12 dni) zwykle przebiega bezobjawowo[8]. W okresie prodromalnym (nieżytowym) choroby trwającym 2–3 dni dominuje wysoka gorączka powyżej 39 °C, nieżyt nosa i spojówek, kaszel oraz światłowstręt, łzawienie, czasami obrzęk powiek[2][19][20][8]. W 2–3 dniu okresu nieżytowego i na 2–3 dni przed wystąpieniem wysypki pojawia się charakterystyczny objaw odry polegający na pojawieniu się białawych przebarwień na błonie śluzowej policzków na wysokości dolnych zębów trzonowych – plamek Koplika[1][21].
W 14 dniu od zakażenia pojawia się okres wysypkowy, który trwa 3–4 dni. Dochodzi do ponownego pojawienia się wysokiej gorączki i pogorszenia stanu chorego, nasilają się objawy zapalenia górnych dróg oddechowych[8]. Może wystąpić duszność, tachykardia, objawy zapalenia płuc, apatia i jadłowstręt[8]. Pojawia się wysypka początkowo o charakterze drobnoplamistym i koloru różowego, następnie o charakterze gruboplamistym o kolorze ciemnoróżowym, zlewająca się. Najpierw umiejscawia się na twarzy za uszami i na czole, w kolejnych dniach zstępując obejmuje już całą powierzchnię ciała[20]. Po 4–5 dniach następuje okres zdrowienia, wysypka zaczyna blednąć i zanikać w kolejności w jakiej się pojawiła pozostawiając brunatne przebarwienia i delikatne łuszczenie się skóry, gorączka cofa się i ustępują również objawy zapalenia górnych dróg oddechowych[20][8].
Powikłania i rokowanie

Powikłania dotyczą głównie dzieci z niedoborami odporności, niedożywionych (szczególnie z niedoborem witaminy A), z wadami serca, niemowląt[22]. Spotyka się[22]:
- powikłania żołądkowo-jelitowe[23]
- zapalenie płuc (1–6% zachorowań, wysoce śmiertelne)[23]
- zapalenie ucha środkowego (7–9% przypadków)
- zapalenie mięśnia sercowego
- zapalenie mózgu (około 1 na 1000 zachorowań, śmiertelne w 15%, u 25% pacjentów pozostają ubytki neurologiczne[22])
- podostre stwardniające zapalenie mózgu (1–4/100 000 zachorowań, ale jeśli pacjent był młodszy niż 2 lata, to 1/8000 zachorowań[22]) – pojawia się kilka lat po przebyciu choroby, związane jest z przetrwałą infekcją mózgu zmutowanym wirusem odry[24][25][26], charakterystyczne dla tego powikłania jest wybitnie wysokie stężenie przeciwciał przeciw wirusowi. Występują postępujące objawy neurologiczne w postaci zaburzeń mowy i zachowania, otępienia, mioklonii oraz niedowładów[27][28][29]. Jeśli nie dojdzie do remisji (co zdarza się w około 5% przypadków) zawsze prowadzi do śmierci[29][30]
- wtrętowe zapalenie mózgu[23]
- poronienie płodu
- zapalenie rogówki i pozagałkowe zapalenie nerwu wzrokowego, a w konsekwencji ślepotę[7][22][23]
Śmiertelność odry sięga od mniej niż 0,01% (w krajach rozwiniętych) do ponad 5% (w krajach rozwijających się, nawet 20–30% u niemowląt[22])[23].
Rozpoznanie
Podejrzenie choroby stawia się na podstawie objawów klinicznych, jednak potwierdzenie rozpoznania wymaga badań serologicznych (ELISA) i izolacji wirusa[22]. IgM skierowane przeciwko wirusowi odnotowuje się od 2–3 dni po wystąpieniu wysypki (największe stężenie ponad tydzień po), zanikają one po około 2–3 tygodniach[31][22]. Jeśli oznaczenie ich stężenia nie było możliwe, chorobę rozpoznaje się na podstawie czterokrotnego zwiększenia miana swoistych IgG po 4 tygodniach[22].
Chorobę należy różnicować z innymi chorobami zakaźnymi (m.in. płonicą, różyczką, zakażeniem enterowirusami, adenowirusami, parwowirusem B19 i wirusem Epsteina-Barr) i nieinfekcyjnymi chorobami osutkowymi[22].
Leczenie
Nie ma leczenia swoistego i leczenie odry jest objawowe[22]. Polega ono na farmakologicznej kontroli gorączki za pomocą leków przeciwgorączkowych, stosowaniu leków przeciwkaszlowych, zaciemnieniu pokoju chorego (ze względu na światłowstręt), utrzymywaniu go w dobrym odżywieniu i nawodnieniu oraz odpoczynku[22]. U dzieci z niedoborem witaminy A jej suplementacja jest korzystna[22][32]. W przypadku nadkażeń bakteryjnych stosuje się antybiotyki[22].
Niektóre badania wykazują potencjalną skuteczność leczenia odry o ciężkim przebiegu rybawiryną[32].
Zapobieganie
Dla zapobiegania zachorowaniom stosuje się szczepienia dzieci atenuowanym wirusem odry w osobnej szczepionce lub w szczepionce MMR[33][34]. Twórcą szczepionki jest Maurice Hilleman. Jej skuteczność jest zmniejszona u osób zakażonych HIV[35]. Szczepienia przeciw odrze prowadzą do znacznego spadku zapadalności i śmiertelności z powodu tej choroby[36][37][38].
Można zastosować ludzką gammaglobulinę w okresie do 6 dni od ekspozycji lub szczepionkę w okresie do 3 dni od ekspozycji w celu zapobieżenia wystąpieniu choroby lub złagodzenia jej przebiegu[22].
Inną metodą zapobiegania rozprzestrzeniania się choroby jest izolacja chorych (przez 4 dni od wystąpienia wysypki) i kontaktujących się z nimi osób[22].
Historia
Liczne przypadki opisów odry w XI i XII w. wskazują, że choroba mogła pojawić się w Europie w tamtym czasie. Jest to także zgodne z badaniami genetycznymi, z których wynika, że w tym okresie doszło do rozdzielenia się wirusa odry od wirusa bydlęcego księgosuszu. Wcześniejsze przypadki zachorowań były prawdopodobnie spowodowane przez przodka tych wirusów, który nie był jeszcze wyłącznie ludzkim wirusem. Jednocześnie badania językowe wskazują, że była znana w okresie między upadkiem cesarstwa rzymskiego i uformowaniem się państw germańskich, a więc między V i VII wiekiem[39].
Autorem jednego z najwcześniejszych opisów odry jest perski lekarz Muhammad ibn Zakariya ar-Razi[40], który ok. 910 r. dokonał rozróżnienia między odrą i ospą prawdziwą[41], jednak nie uważał jej za chorobę zakaźną[42]. Jego praca została przetłumaczona na łacinę dopiero w 1747 roku[43].
W latach 30. XVI w. epidemie odry dotarły do Ameryki za sprawą europejskich osadników i afrykańskich niewolników. Choroba nieznana na tym kontynencie spowodowała znaczną umieralność wśród Indian, np. epidemia na Kubie w 1529 r. zabiła 2/3 indiańskiej populacji[44].
W 1676 r. Sydenham na podstawie swoich doświadczeń i obserwacji z londyńskiej epidemii odry z 1670 r. sporządził prawidłowy i szczegółowy opis symptomów, przebiegu i powikłań odry[41]. Szkocki lekarz Francis Home udowodnił w 1757 r., że odra jest wywoływana przez czynnik zakaźny obecny we krwi pacjentów[40] i miał duży wkład w pierwsze szczepienia przeciw odrze[42]. Natomiast duński lekarz Peter Panum podczas badań na Wyspach Owczych w 1846 r. potwierdził, że okres między kontaktem z wirusem i rozwojem wysypki wynosi dwa tygodnie[42].
Klasyfikacja ICD10
| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: B05 | Odra |
| ICD-10: B05.0 | Odra powikłana przez zapalenie mózgu (G05.1*) |
| ICD-10: B05.1 | Odra powikłana przez zapalenie opon mózgowych (G02.0*) |
| ICD-10: B05.2 | Odra powikłana przez zapalenie płuc (J17.1*) |
| ICD-10: B05.3 | Odra powikłana przez zapalenie ucha środkowego (H67.1*) |
| ICD-10: B05.4 | Odra z powikłaniami jelitowymi |
| ICD-10: B05.8 | Odra z innymi powikłaniami |
| ICD-10: B05.9 | Odra bez powikłań |
Przypisy
- 1 2 Howard Markel, Koplik's Spots: The Harbinger of a Measles Epidemic, „The Milbank Quarterly”, 93 (2), 2015, s. 223–229, DOI: 10.1111/1468-0009.12113, ISSN 0887-378X, PMID: 26044621, PMCID: PMC4462869 [dostęp 2017-11-01].
- 1 2 Ranjan Premaratna i inni, Sporadic cases of adult measles: a research article, „BMC Research Notes”, 10, 2017, DOI: 10.1186/s13104-017-2374-6, ISSN 1756-0500, PMID: 28069071, PMCID: PMC5223409 [dostęp 2017-11-01].
- 1 2 Johan Christiaan Bester, Measles and Measles Vaccination: A Review, „JAMA pediatrics”, 170 (12), 2016, s. 1209–1215, DOI: 10.1001/jamapediatrics.2016.1787, ISSN 2168-6211, PMID: 27695849 [dostęp 2017-11-07].
- ↑ Rima BK., Earle JA., Yeo RP., Herlihy L., Baczko K., ter Meulen V., Carabaña J., Caballero M., Celma ML., Fernandez-Muñoz R. Temporal and geographical distribution of measles virus genotypes. „The Journal of General Virology”. 76 (5), s. 1173–80, maj 1995. DOI: 10.1099/0022-1317-76-5-1173. PMID: 7730801.
- 1 2 3 4 5 Szczeklik i Gajewski 2017 ↓, s. 2370.
- 1 2 3 4 Xiaoli Shang i inni, Molecular epidemiology study of measles viruses in Kunming area of China, „Experimental and Therapeutic Medicine”, 14 (5), 2017, s. 4167–4173, DOI: 10.3892/etm.2017.5033, ISSN 1792-0981, PMID: 29067105, PMCID: PMC5647701 [dostęp 2017-11-06].
- 1 2 3 Mihály Végh i inni, [Ophthalmological symptoms of measles and their treatment], „Orvosi Hetilap”, 158 (39), 2017, s. 1523–1527, DOI: 10.1556/650.2017.30852, ISSN 0030-6002, PMID: 28942662 [dostęp 2017-11-07].
- 1 2 3 4 5 6 7 Cianciara i Juszczyk 2007 ↓, s. 555.
- 1 2 Heidi Palosaari i inni, STAT Protein Interference and Suppression of Cytokine Signal Transduction by Measles Virus V Protein, „Journal of Virology”, 77 (13), 2003, s. 7635–7644, DOI: 10.1128/JVI.77.13.7635-7644.2003, ISSN 0022-538X, PMID: 12805463, PMCID: PMC164804 [dostęp 2017-11-06].
- ↑ Michael J. Mina i inni, Long-term measles-induced immunomodulation increases overall childhood infectious disease mortality, „Science”, 348 (6235), 2015, s. 694–699, DOI: 10.1126/science.aaa3662, ISSN 0036-8075, PMID: 25954009, PMCID: PMC4823017 [dostęp 2017-11-06].
- ↑ Tomomitsu Doi i inni, Measles virus induces persistent infection by autoregulation of viral replication, „Scientific Reports”, 6, 2016, s. 37163, DOI: 10.1038/srep37163, ISSN 2045-2322, PMID: 27883010, PMCID: PMC5121633 [dostęp 2017-11-10].
- 1 2 James L. Goodson, Jane F. Seward, Measles 50 Years After Use of Measles Vaccine, „Infectious Disease Clinics of North America”, 29 (4), 2015, s. 725–743, DOI: 10.1016/j.idc.2015.08.001, ISSN 1557-9824, PMID: 26610423 [dostęp 2017-11-07].
- ↑ Cianciara i Juszczyk 2007 ↓, s. 554.
- ↑ Jie Gao i inni, The measles epidemic trend over the past 30 years in a central district in Shanghai, China, „PLoS ONE”, 12 (6), 2017, DOI: 10.1371/journal.pone.0179470, ISSN 1932-6203, PMID: 28640919, PMCID: PMC5480882 [dostęp 2017-11-06].
- ↑ Alberta Di Pasquale i inni, Vaccine safety evaluation: Practical aspects in assessing benefits and risks, „Vaccine”, 34 (52), 2016, s. 6672–6680, DOI: 10.1016/j.vaccine.2016.10.039, ISSN 1873-2518, PMID: 27836435 [dostęp 2017-11-12].
- 1 2 Małgorzata Sadkowska-Todys, Andrzej Zieliński, Mirosław P. Czarkowski, Choroby zakaźne w Polsce w 2015, „Przegląd Epidemiologiczny”, 71 (3), 2017, s. 295–309, ISSN 0033-2100, PMID: 29181956 [dostęp 2018-09-22].
- 1 2 Monika Roberta Korczyńska, Odra w Polsce w 2015 roku, „Przegląd Epidemiologiczny”, 71 (3), 2017, s. 311–318, ISSN 0033-2100, PMID: 29181957 [dostęp 2018-09-22].
- ↑ WHO/Europe | Europe observes a 4-fold increase in measles cases in 2017 compared to previous year [online], www.euro.who.int [dostęp 2018-08-31] [zarchiwizowane z adresu 2018-02-20] (ang.).
- ↑ Diane E. Griffin, The Immune Response in Measles: Virus Control, Clearance and Protective Immunity, „Viruses”, 8 (10), 2016, DOI: 10.3390/v8100282, ISSN 1999-4915, PMID: 27754341, PMCID: PMC5086614 [dostęp 2017-11-12].
- 1 2 3 Szczeklik i Gajewski 2017 ↓, s. 2371.
- ↑ R. Kh Begaydarova i inni, [The current knowledge of clinical manifestations of measles], „Georgian Medical News” (239), 2015, s. 63–69, ISSN 1512-0112, PMID: 25802452 [dostęp 2017-11-08].
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Szczeklik i Gajewski 2017 ↓, s. 2372.
- 1 2 3 4 5 Paul A. Rota i inni, Measles, „Nature Reviews. Disease Primers”, 2, 2016, s. 16049, DOI: 10.1038/nrdp.2016.49, ISSN 2056-676X, PMID: 27411684 [dostęp 2017-11-01].
- ↑ Pavan S. Upadhyayula i inni, Subacute Sclerosing Panencephalitis of the Brainstem as a Clinical Entity, „Medical Sciences (Basel, Switzerland)”, 5 (4), 2017, DOI: 10.3390/medsci5040026, ISSN 2076-3271, PMID: 29112137 [dostęp 2017-11-08].
- ↑ Uluç Yiş i inni, Expression patterns of micro-RNAs 146a, 181a, and 155 in subacute sclerosing panencephalitis, „Journal of Child Neurology”, 30 (1), 2015, s. 69–74, DOI: 10.1177/0883073814531329, ISSN 1708-8283, PMID: 24789113 [dostęp 2017-11-10].
- ↑ Banu Anlar, Subacute sclerosing panencephalitis and chronic viral encephalitis, „Handbook of Clinical Neurology”, 112, 2013, s. 1183–1189, DOI: 10.1016/B978-0-444-52910-7.00039-8, ISSN 0072-9752, PMID: 23622327 [dostęp 2017-11-10].
- ↑ Ayşe Kartal i inni, Subacute sclerosing panencephalitis presenting as schizophrenia with an alpha coma pattern in a child, „Journal of Child Neurology”, 29 (10), 2014, NP111–113, DOI: 10.1177/0883073813507484, ISSN 1708-8283, PMID: 24141274 [dostęp 2017-11-10].
- ↑ Sadanandavalli Retnaswami Chandra i inni, Syndromes of Rapidly Progressive Cognitive Decline-Our Experience, „Journal of Neurosciences in Rural Practice”, 8 (Suppl 1), 2017, S66–S71, DOI: 10.4103/jnrp.jnrp_100_17, ISSN 0976-3147, PMID: 28936074, PMCID: PMC5602264 [dostęp 2017-11-10].
- 1 2 Arpit Parmar, Rajeev Ranjan, Rajesh Sagar, Subacute Sclerosing Panencephalitis Presenting with Isolated Positive Psychotic and Catatonic Symptoms, „Indian Journal of Psychological Medicine”, 39 (4), 2017, s. 534–536, DOI: 10.4103/0253-7176.211756, ISSN 0253-7176, PMID: 28852257, PMCID: PMC5560011 [dostęp 2017-11-10].
- ↑ Jose Gutierrez, Richard S. Issacson, Barbara S. Koppel, Subacute sclerosing panencephalitis: an update, „Developmental Medicine and Child Neurology”, 52 (10), 2010, s. 901–907, DOI: 10.1111/j.1469-8749.2010.03717.x, ISSN 1469-8749, PMID: 20561004 [dostęp 2017-11-22].
- ↑ Shelly Bolotin i inni, The utility of measles and rubella IgM serology in an elimination setting, Ontario, Canada, 2009–2014, „PLoS ONE”, 12 (8), 2017, DOI: 10.1371/journal.pone.0181172, ISSN 1932-6203, PMID: 28850604, PMCID: PMC5574571 [dostęp 2017-11-08].
- 1 2 Jennifer R. Stalkup, A review of measles virus, „Dermatologic Clinics”, 20 (2), 2002, 209–215, v, ISSN 0733-8635, PMID: 12120435 [dostęp 2017-11-12].
- ↑ Szczeklik i Gajewski 2017 ↓, s. 2474.
- ↑ Andrea Porretta i inni, A nosocomial measles outbreak in Italy, February-April 2017, „Eurosurveillance”, 22 (33), 2017, DOI: 10.2807/1560-7917.ES.2017.22.33.30597, ISSN 1025-496X, PMID: 28840827, PMCID: PMC5572940 [dostęp 2017-11-07].
- ↑ Benjamin M. Stermole i inni, Long-Term Safety and Serologic Response to Measles, Mumps, and Rubella Vaccination in HIV-1 Infected Adults, „Vaccine”, 29 (16), 2011, s. 2874–2880, DOI: 10.1016/j.vaccine.2011.02.013, ISSN 0264-410X, PMID: 21352938, PMCID: PMC3073409 [dostęp 2017-11-01].
- ↑ Pallavi Indwar, Falguni Debnath, Arijit Sinha, Reporting measles case fatality due to complications from a tertiary care hospital of Kolkata, West Bengal 2011-2013, „Journal of Family Medicine and Primary Care”, 5 (4), 2016, s. 777–779, DOI: 10.4103/2249-4863.201161, ISSN 2249-4863, PMID: 28348989, PMCID: PMC5353812 [dostęp 2017-11-12].
- ↑ N.A. Khuri-Bulos, Measles in Jordan: a prototype of the problems with measles in developing countries, „The Pediatric Infectious Disease Journal”, 14 (1), 1995, s. 22–26, ISSN 0891-3668, PMID: 7715984 [dostęp 2017-11-12].
- ↑ Mark E. McGovern, David Canning, Vaccination and All-Cause Child Mortality From 1985 to 2011: Global Evidence From the Demographic and Health Surveys, „American Journal of Epidemiology”, 182 (9), 2015, s. 791–798, DOI: 10.1093/aje/kwv125, ISSN 0002-9262, PMID: 26453618, PMCID: PMC4757942 [dostęp 2017-11-12].
- ↑ Furuse i inni, Origin of measles virus: divergence from rinderpest virus between the 11th and 12th centuries, „Virology Journal”, 7, 2010, s. 52, DOI: 10.1186/1743-422X-7-52, ISSN 1743-422X, PMID: 20202190, PMCID: PMC2838858.
- 1 2 Measles History. [w:] Centers for Disease Control and Prevention [on-line]. U.S. Department of Health & Human Services. [dostęp 2017-11-01]. (ang.).
- 1 2 Sheldon G.Cohen, Measles and immunomodulation, „The Journal of allergy and clinical immunology”, 2, 121, 2008, s. 543–544, DOI: 10.1016/j.jaci.2007.12.1152, PMID: 18269930.
- 1 2 3 Andrew W. Artenstein, Vaccines: A Biography, Springer Science & Business Media, 11 grudnia 2009, s. 224, ISBN 978-1-4419-1108-7 [dostęp 2017-11-09] (ang.).
- ↑ Rhazes: A Treatise on the small-pox and measles. Londyn: The Sydenham Society, 1843. [dostęp 2017-11-01].
- ↑ Noble David Cook: Born to Die: Disease and New World Conquest, 1492-1650. Cambridge University Press, 1998, s. 86-87. ISBN 0-521-62208-5.
Bibliografia
- Andrzej Szczeklik, Piotr Gajewski: Interna Szczeklika 2017. Wydawnictwo Medycyna Praktyczna, 2017, s. 2370-2372. ISBN 978-83-7430-517-4.
- Janusz Cianciara, Jacek Juszczyk: Choroby zakaźne i pasożytnicze. Lublin: CZELEJ, 2007. ISBN 978-83-60608-34-0.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.