| |||||||||||||||||||||||
 Historyczna próbka ciężkiej wody z fabryki Norsk Hydro | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
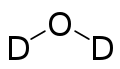
| Wzór sumaryczny |
D2O | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
2H2O | ||||||||||||||||||||||
| Masa molowa |
20,03 g/mol | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
Ciężka woda, HDO lub D
2O – wieloznaczny termin fizyczny i chemiczny:
- zazwyczaj oznacza to związek chemiczny D
2O, czyli tlenek deuteru[2][3][4][5] – wodę, w której atomy wodoru to izotop 2
H[6] znany jako deuter (D)[uwaga 1]; - nazwa ta w sensie szerszym dotyczy także związku, w którym jedynie jeden atom protu zastąpiony jest deuterem (HDO)[6];
- jest to też typ substancji chemicznej – woda, w której znaczącą część atomów wodoru stanowi deuter[6].
W „normalnej” wodzie występuje naturalnie ok. 115 ppm wody ciężkiej. Można ją pozyskiwać na różne sposoby:
- Harold Clayton Urey (USA), opublikował w 1931 technikę umożliwiającą oddzielenie tlenku deuteru od tlenku „zwykłego” wodoru, polegającą na wieloetapowym odwirowywaniu wody.
- Inną metodą oddzielenia „ciężkiej wody” jest powolna elektroliza. Wykorzystuje się tu fakt, że deuter ulega jej wolniej niż „zwykły” wodór (prot). Podczas tego procesu wodór i tlen uchodzą z elektrod, natomiast tlenek deuteru pozostaje w naczyniu. Z elektrolizy 100 000 litrów wody uzyskuje się około 1 litra ciężkiej wody, przez co jest kosztowna.
Właściwości
Cząsteczki ciężkiej wody mają masę cząsteczkową większą o 2 g/mol od „zwykłej wody”, co powoduje nieco większą gęstość ciężkiej wody w stosunku do wody „zwykłej”. Dzięki temu można oddzielać wodę ciężką od „zwykłej” przez wirowanie. Współcześnie ciężką wodę uzyskuje się głównie za pomocą rozdziału tlenku deuteru od tlenku protu na kolumnach sorpcyjnych, wykorzystujących różnice w trwałości wiązań wodorowych tworzonych przez tlenek protu i tlenek deuteru z wypełnieniem tych kolumn.
Właściwości chemiczne wody ciężkiej są niemal takie same jak zwykłej wody, z wyjątkiem jej zdolności do tworzenia wiązań wodorowych (tworzy silniejsze wiązania) i polaryzacji wiązań tlen – wodór (deuter), co skutkuje m.in. nieco wyższym pH. Woda ciężka znacząco różni się natomiast od zwykłej wody pod względem fizycznym. Ma:
- o kilka stopni wyższą temperaturę wszystkich przemian fazowych,
- większą gęstość,
- inny moment dipolowy,
- inne przewodnictwo elektryczne i pojemność cieplną.
| Parametr | D 2O | HDO | H 2O |
|---|---|---|---|
| krzepnięcie (°C) | 3,82 | 2,04 | 0,00 |
| wrzenie (°C) | 101,42 | 100,74 | 100,00 |
| gęstość (w 25 °C, g/cm³) | 1,104 | 1,051 | 0,997 |
| temp. maksymalnej gęstości (°C) | 11,19 | ? | 3,98 |
| lepkość (cp) | 1,095 (25 °C) | 1,1248 (20 °C) | 0,8909 (25 °C) |
| napięcie powierzchniowe (w 25 °C, dyn·cm) | 71,87 | 71,93 | 71,98 |
| ciepło topnienia (kcal/mol) | 1,466 | ? | 1,436 |
| ciepło parowania (kcal/mol, w t. wrz.) | 9,924 | ? | 10,912 |
| pH (w 25 °C) | 7,43 | 7,27 | 7,00 |
| Współczynnik załamania (λ=0,589 μm) | 1,32828 (20 °C) | ? | 1,33286 (25 °C) |
Zastosowanie w technikach jądrowych
Ciężka woda stosowana współcześnie w przemyśle zawiera zwykle od 95 do 99% tlenku deuteru w stosunku do tlenku wodoru. Jest stosowana jako moderator w reaktorach jądrowych, gdyż ma zdolność do spowalniania neutronów prędkich. Zwykła woda też ma taką zdolność, jednak pochłania znacznie więcej neutronów termicznych (optymalnych do wywoływania reakcji rozszczepienia jąder U-235). Oprócz tego woda deuterowana jest stosowana w chemii, jako jeden z rozpuszczalników stosowanych w analitycznej technice NMR oraz tanie źródło deuteru, przy badaniu mechanizmów reakcji, poprzez znakowanie izotopowe i obserwację tzw. efektu izotopowego.
Kanada jest największym na świecie producentem ciężkiej wody, która jest wykorzystywana jako moderator w reaktorach atomowych typu CANDU.
Ze względu na przydatność ciężkiej wody w programach produkcji broni atomowej w niektórych krajach (np. Australii) obrót tym związkiem podlega prawnej kontroli.
Ciężka woda była źródłem niepokoju podczas II wojny światowej. Alianci podejrzewali, że przy jej wykorzystaniu Niemcy prowadzili eksperymenty mające na celu zbudowanie bomby atomowej. Aby temu zapobiec, w 1942 roku Brytyjczycy wysłali jednostki specjalne w celu zniszczenia fabryki izotopu Vemork w Norwegii, w miejscowości Rjukan. Fabryka została poważnie uszkodzona na początku 1943 r. w wyniku akcji norweskich komandosów. Została szybko odbudowana, jednak amerykański nalot spowodował, że Niemcy podjęli decyzję o przeniesieniu zasobu ciężkiej wody do Niemiec. Nie udało się im jednak jej przetransportować – na początku 1944 r. bojownicy norweskiego ruchu oporu zatopili prom przewożący ewakuowane z fabryki zapasy ciężkiej wody[7].
Wpływ wody ciężkiej na żywe organizmy
Z fizykochemicznego punktu widzenia woda ciężka niewiele różni się od wody „zwykłej”. Te niewielkie różnice są jednak istotne dla żywych organizmów. W biopolimerach takich jak białka czy kwasy nukleinowe, deuterowanie (czyli wymiana izotopowa wodoru na deuter) powoduje nieznaczny spadek energii wiązań wodorowych. Jest to znany w przyrodzie efekt Ubbelohdego.
Różnica w aktywności wodoru i deuteru w żywych organizmach ma źródło w efektach dynamicznych oddziaływań kooperatywnych, które prowadzą do występowania efektów samoorganizacji izotopowej w układach wiązań wodorowych. Samoorganizacja H/D prowadzi do tego, że deuter niechętnie „wchodzi” np. do DNA organizmów żywych.
Wpływ na zwierzęta
Eksperymenty na myszach, szczurach i psach[8] pokazały, że zawartość 25% deuteru powoduje (czasem nieodwracalną) bezpłodność, ponieważ gamety i zygoty nie mogą się rozwijać. Wysokie stężenia ciężkiej wody (90%) gwałtownie zabijają ryby, kijanki, płazińce i muszki owocowe. Ssaki (np. szczury) otrzymujące do picia ciężką wodę umierają po tygodniu, kiedy zawartość deuteru osiąga 50%. Przyczyną śmierci, podobnie jak w zatruciu cytotoksycznym (np. podczas chemioterapii) i ostrej chorobie popromiennej, wydaje się być ogólne zahamowanie podziałów komórkowych. Ciężka woda jest bardziej toksyczna dla komórek nowotworowych niż zdrowych, jednak stężenia wymagane dla skutecznego działania są zbyt wysokie dla zastosowań terapeutycznych[8]. Podobnie jak w chemioterapii, ssaki zatrute D
2O umierają w wyniku niewydolności szpiku kostnego (krwotoki i infekcje) i zaburzeń funkcji jelit (biegunka i utrata płynów).
Prokariotyczne organizmy, takie jak bakterie, u których deuter nie powoduje problemów z mitozą, mogą rozwijać się przy całkowitym zastąpieniu wodoru przez deuter, również w białkach i DNA[8]. Pełne zastąpienie zwykłych izotopów cięższymi stabilnymi jest możliwe u organizmów wyższych w przypadku innych pierwiastków (13C, 15N, 18O), ale nie wodoru.
Ciężka woda wykorzystywana jest dla poprawienia skuteczności terapii borowo-neutronowej, gdzie wykorzystuje się zdolność deuteru do moderowania neutronów bez ich wychwytywania[8].
Zobacz też
Uwagi
Przypisy
- 1 2 3 4 5 Martin Chaplin, Water Properties (including isotopologues) [online], www1.lsbu.ac.uk, 24 lipca 2019 [dostęp 2019-08-03] [zarchiwizowane z adresu 2017-05-20].
- ↑ Deuter i tryt, [w:] Adam Bielański, Podstawy chemii nieorganicznej, wyd. 5, Warszawa: PWN, 2002, s. 538–540, ISBN 83-01-13654-5.
- ↑ Ciężka woda. Otrzymywanie i właściwości, [w:] Włodzimierz Trzebiatowski, Chemia nieorganiczna, wyd. VIII, Warszawa: PWN, 1978, s. 110–111.
- ↑ Woda ciężka, [w:] Encyklopedia PWN [dostęp 2021-07-30].
- ↑ Ciężka woda (nr 633178) w katalogu produktów Sigma-Aldrich (Merck).
- 1 2 3 Heavy water, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.H02758, ISBN 0-9678550-9-8 (ang.).
- ↑ The Heroes of Telemark [online], www.hydro.com [zarchiwizowane z adresu 2006-07-20] (ang.).
- 1 2 3 4 D. J. Kushner, Alison Baker, and T. G. Dunstall. Pharmacological uses and perspectives of heavy water and deuterated compounds. „Can. J. Physiol. Pharmacol.”. 2 (77), s. 79–88, 1999. DOI: 10.1139/cjpp-77-2-79. PMID: 10535697. Cytat: used in boron neutron capture therapy ... D2O is more toxic to malignant than normal animal cells ... Protozoa are able to withstand up to 70% D20. Algae and bacteria can adapt to grow in 100% D2O.