| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny |
C19H16 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
(C | ||||||||||||||||||||||||||
| Masa molowa |
244,33 g/mol | ||||||||||||||||||||||||||
| Wygląd |
bezwonny, żółtawy proszek[1] | ||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Pochodne |
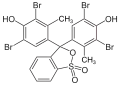
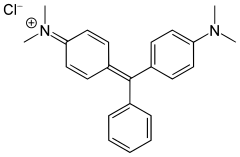
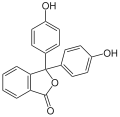
chlorek trytylu, zieleń bromokrezolowa, zieleń malachitowa, fenoloftaleina | ||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
Trifenylometan, trytan, TrH – organiczny związek chemiczny z grupy węglowodorów aromatycznych, pochodna metanu, w której trzy atomy wodoru zastąpione zostały trzema pierścieniami benzenowymi. Jest podstawowym składnikiem wielu barwników syntetycznych (barwniki triarylometanowe – niektóre z nich używane jako wskaźniki pH). Rozpuszczalny w niepolarnych rozpuszczalnikach organicznych i nierozpuszczalny w wodzie. Stosowany jako stabilizator polimerów i paliw. Grupa trifenylometanowa nosi nazwę grupy trytylowej, np. chlorek trifenylometylu to chlorek trytylu.
Otrzymywanie
Trifenylometan można otrzymać w reakcji Friedla-Craftsa z benzenu i chloroformu wobec katalizatora – chlorku glinu:
- 3C
6H
6 + CHCl
3 → Ph
3CH + 3HCl
W reakcji czterochlorku węgla z benzenem wobec tego samego katalizatora powstaje addukt chlorku trytylu z chlorkiem glinu, który jest hydrolizowany przez rozcieńczone kwasy do trytanu[4]:
- 3C
6H
6 + CCl
4 + AlCl
3 → Ph
3CCl·AlCl
3 - Ph
3CCl·AlCl
3 + HCl → Ph
3CH
Wykorzystywana jest również synteza trifenylometanu z chlorku benzalu (PhCHCl
2) i benzenu[5]:
- C
6H
5CHCl
2 + 2C
6H
6 → (C
6H
5)
3CH + 2HCl - w temperaturze 130–140 °C wobec BeCl
2
Kwasowość
pKa wodoru przy centralnym atomie węgla w cząsteczce trifenylometanu wynosi około 31. Jego wysoka kwasowość w stosunku do innych węglowodorów wynika ze stabilizacji płaskiego anionu trytylowego przez rozległą delokalizację elektronów na trzech pierścieniach fenylowych. Jednakże taka stabilizacja nie zachodzi jednocześnie we wszystkich trzech pierścieniach fenylowych wskutek występowania efektów sterycznych.
Anion trytylowy silnie absorbuje światło widzialne, przez co jest czerwony. To zabarwienie może służyć jako wskaźnik w podtrzymywaniu warunków bezwodnych w obecności wodorku wapnia, będącego wystarczająco silną zasadą, żeby utworzyć anion trytylowy. Gdy cały wodorek wapnia przereaguje z wodą, roztwór odbarwia się.
Aniony trytylowe mogą być również tworzone w reakcji chlorku trytylu z metalami alkalicznymi[6]:
- (C
6H
5)
3CCl + 2 Na → (C
6H
5)
3CNa + NaCl
Przed popularyzacją butylolitu produkt powyższej reakcji był stosowany jako silna nienukleofilowa zasada.
Barwniki triarylometanowe
Przykładami barwników triarylometanowych są:
Zobacz też
- trifenylometyl – grupa funkcyjna pochodząca od TrH
Przypisy
- 1 2 Triphenylmethane, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 19960 [dostęp 2023-08-22] (niem. • ang.).
- 1 2 3 4 5 6 CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 3-540, ISBN 978-1-4987-5429-3 (ang.).
- ↑ Triphenylmethane, karta charakterystyki produktu Sigma-Aldrich, Merck, 27 kwietnia 2022, numer katalogowy: 101303 [dostęp 2023-08-22]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ J.F. Norris, Triphenylmethane, „Organic Syntheses”, 5, 1925, s. 81, DOI: 10.15227/orgsyn.004.0081 (ang.).
- ↑ Hellmut Bredereck i inni, Berylliumchlorid in organischen Reaktionen, „Berichte der deutschen chemischen Gesellschaft”, 72 (7), 1939, s. 1414–1429, DOI: 10.1002/cber.19390720717 (niem.).
- ↑ W.B. Renfrow jr., C.R. Hauser, Triphenylmethylsodium, „Organic Syntheses”, 19, 1939, s. 83, DOI: 10.15227/orgsyn.019.0083 (ang.).