
Promień łączący (RS, ang. radial spoke) – duży, wielobiałkowy kompleks zbudowany z około 23 białek, będący jednym ze strukturalnych elementów aksonemy[2], stanowiącej szkielet rzęsek ruchomych oraz wici, występujących u większości komórek eukariotycznych, od pierwotniaków do ssaków. Liczne badania biochemiczne oraz strukturalne wskazują, że promień łączący jest strukturą niezbędną do generowania ruchu rzęski, jednak dotychczasowa wiedza na temat dokładnej budowy oraz funkcji tej struktury pozostaje niepełna.
Położenie i morfologia
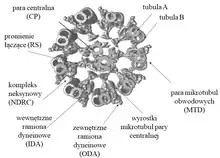
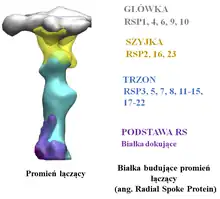
W każdej 96-nm jednostce rzęskowej można wyróżnić trzy różniące się kształtem, składem białkowym i prawdopodobnie pełnioną funkcją promienie łączące: RS1, RS2 i RS3. Jednakże w przypadku Chlamydomonas jednostka rzęskowa wyposażona jest jedynie w dwa promienie łączące RS1 oraz RS2, natomiast trzeci promień łączący (RS3) zredukowany jest do niewielkiego wyrostka[3]. Promienie łączące swoim kształtem przypominają literę T, a ich struktura podzielona jest na trzy segmenty: główkę oddziałującą z wypustkami pary centralnej, trzon mocujący promień łączący na mikrotubuli obwodowej (mikrotubula A) oraz szyjkę, która łączy trzon z główką. Morfologia poszczególnych promieni łączących nie jest identyczna. Promienie łączące RS1 i RS2 mają podobną architekturę i są strukturami symetrycznymi oddalonymi od siebie o 32 nm, natomiast trzeci promień łączący położony jest w odległości 24 nm od RS2 i różni się morfologią oraz sposobem zakotwiczenia na tubuli A od pozostałych RS. Tak istotne różnice w strukturze promieni łączących mogą odzwierciedlać niejednorodność składu białkowego, a w konsekwencji różnorodność funkcjonalną[4][5]. Dotychczasowe badania prowadzone na zielenicy Chlamydomonas reinhardtii pozwoliły na zidentyfikowanie 23 białek, które budują promienie łączące RS1 i RS2. Wśród nich wyróżnić można białka RSP1, 4, 6, 9 i 10 tworzące główkę promieni łączących, białka RSP3, 5, 7, 8, 11-15 oraz 17-22 wchodzące w skład trzonu oraz białka RSP2, 16 i 23 budujące szyjkę. U podstawy promienia trzeciego umiejscowiony jest kompleks CSC (ang. Calmodulin-and Radial Spoke associated Complex), który umożliwia kontakt promieni łączących z kompleksem N-DRC i zakotwicza lub stabilizuje promienie RS2 i RS3. Nie wszystkie białka promieni łączących zidentyfikowane u Chlamydomonas posiadają swoje ortologi u innych organizmów. Przykładowo w genomie człowieka nie znaleziono ortologów białek RSP2, 5, 7, 8, 14 i 17[6].
Funkcje
Promienie łączące są niezbędne do generowania ruchu rzęski, odgrywają istotną rolę w przekazywaniu sygnałów mechano-chemicznych pomiędzy mikrotubulami pary centralnej a ramionami dyneinowymi, regulując tym samym ich aktywność, a co za tym idzie prawidłowy ruch rzęsek oraz homologicznych pod względem budowy wici. Promienie łączące oddziałują z wyrostkami pary centralnej, przejściowo się z nim stykając i pośredniczą w przekazywaniu sygnałów od mikrotubul pary centralnej do ramion dyneinowych, których zakończenia umocowane są w pobliżu promieni łączących. Rzęski lub wici mutantów pozbawione promieni łączących lub tworzące niepełne promienie są nieruchome. U człowieka brak, niedorozwój lub niewłaściwe funkcjonowanie rzęsek prowadzi do powstania zespołów chorobowych zwanych ogólnie ciliopatiami[4].
Przypisy
- ↑ Gerald Karp, Cell and Molecular Biology, Wiley, 2010, s. 341–342, ISBN 978-0-470-48337-4.
- ↑ Gaia Pigino, Takashi Ishikawa, Axonemal radial spokes: 3D structure, function and assembly, „Bioarchitecture”, 2 (2), 2012, s. 50–58, DOI: 10.4161/bioa.20394, ISSN 1949-100X, PMID: 22754630, PMCID: PMC3383722 [dostęp 2019-10-26].
- ↑ Paulina Urbańska i inni, Budowa rzęsek – od ultrastruktury do funkcji, „Kosmos. Problemy Nauk Biologicznych”, 2018.
- 1 2 Xiaoyan Zhu, Yi Liu, Pinfen Yang, Radial Spokes–A Snapshot of the Motility Regulation, Assembly, and Evolution of Cilia and Flagella, „Cold Spring Harbor Perspectives in Biology”, 9 (5), 2017, a028126, DOI: 10.1101/cshperspect.a028126, ISSN 1943-0264, PMID: 27940518, PMCID: PMC5411694 [dostęp 2019-10-26] (ang.).
- ↑ Anna Osinka i inni, Ciliary Proteins: Filling the Gaps. Recent Advances in Deciphering the Protein Composition of Motile Ciliary Complexes, „Cells”, 8 (7), 2019, s. 730, DOI: 10.3390/cells8070730, ISSN 2073-4409, PMID: 31319499, PMCID: PMC6678824 [dostęp 2019-10-26] (ang.).
- ↑ Pinfen Yang i inni, Radial spoke proteins of Chlamydomonas flagella, „Journal of Cell Science”, 119 (Pt 6), 2006, s. 1165–1174, DOI: 10.1242/jcs.02811, ISSN 0021-9533, PMID: 16507594, PMCID: PMC1973137 [dostęp 2019-10-26].