| paralysis cerebralis infantum | |
 | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|
| DiseasesDB | |
| OMIM | |
| MedlinePlus | |
| MeSH | |
Mózgowe porażenie dziecięce (porażenie mózgowe, MPD, łac. paralysis cerebralis infantum, ang. cerebral palsy) – zespół objawów określający różnorodne zaburzenia ruchu i postawy, wynikające z trwałego, niepostępującego uszkodzenia mózgu we wczesnym stadium rozwoju. Najczęstsze problemy dotyczą koordynacji ruchowej, różnego stopnia spastyczności lub wiotkości mięśni, przełykania pokarmów lub mówienia. Jako objawy wyróżnić można jeszcze w niektórych przypadkach obecność drgawek, problemy ze wzrokiem i słuchem. Często dzieci z MPD nabywają zdolności do obracania się, siadania, pełzania i chodzenia w późniejszym wieku niż ich zdrowi rówieśnicy. U około jednej trzeciej dzieci dochodzi do napadów epileptycznych. Symptomy choroby mogą stać się bardziej widoczne w miarę starzenia się organizmu, nie oznacza to jednak, że choroba postępuje[1].
Mózgowe porażenie dziecięce jest spowodowane nieprawidłowościami w rozwoju mózgu lub uszkodzeniem tych jego części, które są odpowiedzialne za koordynację wzrokowo-ruchową, równowagę i postawę[1][2]. Najczęściej pierwsze sygnały występują już w fazie prenatalnej, aczkolwiek mogą mieć miejsce w fazie perinatalnej i postnatalnej. Przyczyna problemów często jest nieznana. Czynniki ryzyka to przedterminowy poród, ciąża wielopłodowa, niektóre infekcje przebyte podczas ciąży, takie jak toksoplazmoza, różyczka, ekspozycja na metylortęć, oraz uraz głowy przebyty w czasie pierwszych kilku lat życia i inne.
Dziecięce porażenie mózgowe dzieli się na cztery postacie, w zależności od objawów chorego. Nadmierne napięcie mięśniowe to rodzaj spastyczny mózgowego porażenia dziecięcego (postać piramidowa), problemy z koordynacją ruchową, niezborność – ataksję (postać móżdżkowa), natomiast jeśli dziecko wykazuje mimowolne, nieskoordynowane ruchy kończyn górnych niezależne od jego woli, wtedy należy mówić o atetozie. Diagnoza medyczna jest stawiana na podstawie poszczególnych etapów rozwoju dziecka. Badania krwi oraz diagnostyka obrazowa mogą być wykorzystywane, by wykluczyć inne przyczyny[1]. Około 2% przypadków z czterokończynowego porażenia mózgowego ma przyczynę w uwarunkowaniach genetycznych[3].
Dziecięcemu porażeniu mózgowemu można częściowo zapobiec poprzez immunizację matki oraz dzięki ostrożności, by zapobiec urazom głowy dziecka. Choroba jest nieuleczalna, aczkolwiek w wielu przypadkach pomóc może korzystanie z rehabilitacji polegającej na fizjoterapii i terapii logopedycznej, a także przyjmowanie leków, takich jak diazepam, baklofen, botulina (znana również jako jad kiełbasiany) – których właściwości mogą obniżyć nadmiernie napięte mięśnie. Pomóc mogą również zabiegi operacyjne, w których wydłuża się mięśnie lub skraca się nerwy nadmiernie wzmożone; stosowane są również ortezy i inne technologie asystujące. Dzieci, które mają zapewnioną odpowiednią rehabilitację mogą w przyszłości prowadzić dorosłe życie podobnie jak zdrowi ludzie. Czasami jest stosowana medycyna naturalna – nie ma jednak naukowych dowodów, że jest ona skuteczna[1].
Mózgowe porażenie dziecięce jest najczęstszym zaburzeniem ruchu u dzieci – występuje w około 2,1 na 1000 żywych urodzeń[4][5]. Po raz pierwszy chorobę opisał Hipokrates, w V wieku przed naszą erą, natomiast obszerne badania rozpoczął w XIX wieku John William Little, stąd inna nazwa choroby – choroba Little’a[6][7]. Obecnie (na początku XXI wieku) badane są potencjalne metody leczenia, w tym leczenie komórkami macierzystymi[1].
Światowy Dzień Mózgowego Porażenia Dziecięcego obchodzony jest corocznie 6 października[8].
Objawy
Mózgowe porażenie dziecięce jest zdefiniowane jako zespół trwałych niepostępujących zaburzeń rozwoju narządu ruchu i postawy, które wystąpiły w rozwijającym się mózgu płodu lub niemowlęcia[9]. Choć głównym elementem MPD są zaburzenia ruchu, trudności w uczeniu się, w komunikacji, odczuwaniu oraz problemy z zachowaniem często występują razem[9]. 28% pacjentów cierpi na epilepsję, 58% przejawia problemy z komunikacją, co najmniej 42% ma problemy ze wzrokiem, natomiast 23–56% ma trudności w uczeniu się[10].
MPD charakteryzuje się nieprawidłowym napięciem mięśni, mimowolnymi odruchami, zaburzeniami w sferze rozwoju motorycznego i koordynacji. Mogą wystąpić deformacje stawów i kości, przykurcze (stale zwarte mięśnie i stawy). Symptomy mogą być różne i mniej lub bardziej rozległe, w zależności od rodzaju schorzenia i stopnia nasilenia – od lekkiego stopnia, gdzie występuje nieznaczna niezdarność, do ciężkich przypadków, gdzie wykonanie skoordynowanych ruchów jest praktycznie niemożliwe. Klasyczne objawy obejmują spastyczność mięśni, skurcze, mimowolne ruchy w obrębie innych obszarów ciała (np. mimowolne ruchy mięśni twarzy), niepewny chód lub chodzenie ze skrzyżowanymi kolanami oraz problemy z równowagą. Dzieci urodzone ze znacznie nasilonymi objawami MPD często mają nieregularną postawę, ich ciała mogą być nienaturalnie wiotkie lub sztywne. Objawy schorzenia nie muszą być widoczne od razu, mogą stać się jednak widoczne w miarę przekraczania kolejnych etapów rozwoju dziecka, gdzie wymagane jest stosowanie kończyn – na przykład gdy próbuje usiąść lub wstać. Wśród objawów mogą wystąpić drgawki, padaczka, apraksja, dyzartria, lub inne zaburzenia komunikacyjne, problemy z jedzeniem, problemy sensoryczne, trudności w uczeniu się i zaburzenia zachowania.
Mowa
Zaburzenia mowy i języka często występują u osób z mózgowym porażeniem dziecięcym. Dyzartria występuje w liczbie od 31% do nawet 88% osób z MPD[11]. Problemy z mową są związane ze słabą kontrolą układu oddechowego, dysfunkcjami krtani i zaburzenia artykulacji, które wynikają z ograniczonych ruchów mięśni twarzy. Istnieją trzy główne rodzaje dyzartrii: spastyczne, dyskinetyczne (atetoza) i ataksyjne.
Ogólne opóźnienie rozwoju języka może być związane z wyuczoną bezradnością i wadą słuchu. Dzieci narażone na wyuczoną bezradność mogą zostać biernymi interlokutorami w komunikacji interpersonalnej, z czasem mogą także inicjować niewielką ilość rozmów i być w nich pasywną stroną. Wczesna interwencja pozwala nauczyć dziecko komunikowania się z innymi, oraz tego, że mogą wpływać na obiekty i ludzi w ich otoczeniu dzięki komunikacji, a także jak dokonywać wyborów i podejmować decyzje[12].
Dolegliwości bólowe i sen
Ból występuje często u osób z MPD, i może wynikać z wrodzonych deficytów związanych ze schorzeniem[13]. Ból jest spowodowany przez nadmiernie naprężone lub skrócone mięśnie, nieprawidłową postawę, sztywność stawów, nieprawidłowo dobrane ortezy itp. Istnieje również ryzyko wystąpienia zaburzeń snu spowodowanych występowaniem mózgowego porażenia dziecięcego[14].
Spożywanie pokarmów
Osoby z mózgowym porażeniem dziecięcym mogą mieć problemy z przygotowywaniem żywności, trzymania w ręku naczyń i sztućców oraz mogą mieć trudności z żuciem pokarmów i przełykaniem z powodu zaburzeń czuciowych i ruchowych. W skrajnych przypadkach niemowlę może nie być w stanie ssać, żuć ani przełykać[15]. Dzieci mogą przejawiać zbyt dużą lub zbyt małą wrażliwość jamy ustnej oraz wokół niej; mogą mieć również niższą sprawność palców u rąk potrzebną do nabierania pokarmu na talerz[16].
Przyczyny
Mózgowe porażenie dziecięce jest wynikiem uszkodzenia mózgu w fazie prenatalnej, podczas porodu, w ciągu pierwszych miesięcy życia, albo w niektórych przypadkach we wczesnym dzieciństwie[17]. Problemy ze strukturą mózgu widoczne są w 80% przypadków, najczęściej w obrębie substancji białej. Naukowcy uważają, że trzy czwarte przypadków choroby może wynikać z problemów powstałych w czasie ciąży[17].
Choć w niektórych przypadkach nie można określić podłoża, typowe przyczyny to problemy w rozwoju wewnątrzmacicznym (np. narażenie na promieniowanie, infekcje), hipoksja mózgu, urazy porodowe lub komplikacje w okresie narodzin lub we wczesnym dzieciństwie[12][18].
Wcześniactwo
Między 40% a 50% wszystkich dzieci, u których pojawiło się mózgowe porażenie dziecięce, zostało urodzonych przedwcześnie[19]. Większość z tych przypadków (75–90%) wynika z problemów występujących w czasie porodu lub bezpośrednio po nim[17].
Dzieci w ciążach mnogich mają większe ryzyko zachorowania niż dzieci w ciążach pojedynczych[20]; ponadto dzieci z MPD urodzone w ciążach mnogich mogą się urodzić z niską wagą urodzeniową. 6% dzieci z MPD miało wagę urodzeniową między 1 i 1,5 kg[5], 11% wśród dzieci urodzonych przed 28 tygodniem ciąży[5]. Uważa się, że czynniki genetyczne, z powodu których wynika schorzenie odgrywają ważną rolę u dzieci przedwcześnie urodzonych[21]. U dzieci urodzonych między 34 a 37 tygodniem ciąży ryzyko mózgowego porażenia dziecięcego wynosi 0.4%[22].
Dzieci urodzone w terminie
U dzieci urodzonych w terminie do czynników ryzyka należą: problemy z łożyskiem, wady wrodzone, niska masa urodzeniowa, zespół aspiracji smółki, poród wymagający dodatkowych instrumentów, Cesarskie cięcie, niedotlenienie podczas porodu, zespół zaburzeń oddychania noworodka, drgawki bezpośrednio po urodzeniu, niski poziom cukru we krwi i infekcje u noworodka[23].
Nie wiadomo dokładnie, jak dużą rolę odgrywa zamartwica okołoporodowa jako przyczyny[24]. Uważa się jednak, że tylko niewielka część przypadków jest spowodowana przez asfiksję (niedobór tlenu) w czasie porodu[25]. Nie jest jasne, czy wielkość łożyska odgrywa jakąkolwiek rolę[26].
Genetyka
Około 2% przypadków MPD – porażenia czterokończynowego (quadriplegii) jest dziedziczonych, jeden z enzymów uczestniczących to prawdopodobnie gen o nazwie glutaminian dekarboksylazy-1 (GAD1)[3]. Większość przypadków są odziedziczone autosomalnie recesywnie, co oznacza że oboje rodziców musi być nosicielami, by przekazać zmutowany allel płodowi[3].
Wczesne dzieciństwo
Przyczyny jakie mogą wystąpić po urodzeniu dziecka, to zatrucie toksynami, przebycie ciężkiej żółtaczki, zatrucie ołowiem, udar mózgu[27], zespół dziecka potrząsanego, incydenty z niedotlenieniem mózgu, zapalenie mózgu i zapalenie opon mózgowo-rdzeniowych.
Inne
Zakażenia u matki lub infekcje, które nie są łatwe do wykrycia, mogą potroić ryzyko rozwinięcia się choroby u dziecka[28]; zapalenie błon płodowych i łożyska również zwiększa ryzyko[29].
Istnieją hipotezy, że niektóre przypadki urodzeń dzieci ze schorzeniem spowodowane są śmiercią płodu bliźniaczego na początku trwania ciąży[30].
Diagnoza
Rozpoznanie mózgowego porażenia dziecięcego opiera się głównie na wglądzie w historię danej osoby i badania fizycznego osoby. Najbardziej dokładne wydają się być badania pod kątem ogólnej oceny ruchowej, oraz ruchów spontanicznych, wśród dzieci do czterech miesięcy życia[31][32]. Jest to zaburzenie rozwojowe[31].
Gdy dana osoba jest zdiagnozowana, można przeprowadzić dalsze badania. Badania za pomocą obrazowania metodą rezonansu magnetycznego lub tomografia komputerowa są uzasadnione, gdy przyczyny mózgowego porażenia dziecięcego nie są znane, przy czym badania za pomocą rezonansu magnetycznego są częściej wybierane ze względów diagnostycznych oraz bezpieczeństwa pacjenta. Obrazowania metodą rezonansu magnetycznego może zasugerować lekarzowi czas powstania uszkodzenia płodu. Za pomocą obu badań można również ustalić potencjalne inne nadające się do leczenia choroby takie jak: porencefalia, wodogłowie, malformacje tętniczo-żylne, krwiaka podtwardówkowego, naczyniaka limfatycznego torbielowatego czy guz robaka[33] (niektóre badania sugerują występowanie 5–22%). Ponadto, nieprawidłowe badania neuroobrazowania wskazują na prawdopodobieństwo wystąpienia towarzyszących zaburzeń, takich jak między innymi padaczka[34].
Wiek, w którym mózgowe porażenie dziecięce jest diagnozowany jest ważny, ale nie istnieje stanowisko, które określałoby który wiek jest najlepszy do postawienia diagnozy[32]. Im wcześniej porażenie mózgowe zostanie zdiagnozowane, tym są lepsze szanse na zapewnienie dziecku rehabilitacji, ale również może być większa szansa, że MPD będzie mylone z innym zaburzeniem, zwłaszcza jeżeli dziecko ma 18 miesięcy lub jest jeszcze młodsze[32]. Niemowlęta mogą mieć przejściowe problemy z napięciem mięśniowym, które mogą być mylone z mózgowym porażeniem dziecięcym jednak w MPD problemy z napięciem mięśniowym są trwałe[32].
Zaburzenia metabolizmu lub guzy w układzie nerwowym mogą także wydawać się przyczynami MPD, w szczególności zaburzenia metabolizmu mogą powodować problemy w mózgu, które wyglądają jak MPD na badaniu rezonansem magnetycznym[25]. Zaburzenia, które degenerują substancję białą w mózgu i pewne problemy, które powodują skurcze i osłabienie mięśni nóg, mogą być takoż mylone z MPD gdy po raz pierwszy pojawią się u dziecka, jednak te zaburzenia pogarszają się w miarę upływu czasu, a mózgowe porażenie mózgowe nie postępuje (chociaż może zmienić charakter)[25][32]. W okresie niemowlęctwa dostrzeżenie różnicy między porażeniem mózgowym a wyżej wymienionymi wadami może nie być możliwe. Musi również być wykluczone występowanie zarówno zespołu łamliwego chromosomu X, jak i niepełnosprawności intelektualnej[32]. John McLaughlin zaleca, by poczekać z diagnozą aż dziecko będzie miało przynajmniej 36 miesięcy[35].
Postacie mózgowego porażenia dziecięcego
Mózgowe porażenie dziecięce jest klasyfikowane przez rodzaje zaburzeń i ograniczeń ruchu kończyn. Zaburzenia dzielą się na postacie spastyczne (piramidowe), pozapiramidowe (atetoza) i móżdżkowe (ataksja). Dodatkowo występuje postać mieszana, która jest kombinacją cech pozostałych rodzajów. Klasyfikacje te odzwierciedlają obszary mózgu, które są uszkodzone[36].
Postać spastyczna
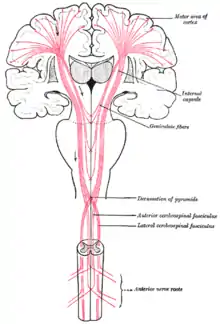
Postać spastyczna jest zdecydowanie najczęściej spotykaną postacią mózgowego porażenia dziecięcego – odpowiada za 70% wszystkich przypadków[37]. Osoby z tym rodzajem mają wzmożone napięcie mięśniowe w kończynach co jest w istocie zaburzeniem płytki nerwowo-mięśniowej wynikającym z uszkodzenia ośrodkowego neuronu ruchowego w mózgu, jak również drogi korowo-rdzeniowej lub kory ruchowej. To uszkodzenie upośledza zdolność niektórych receptorów nerwowych w kręgosłupie do prawidłowego otrzymywania kwasu γ-aminomasłowego (GABA), co prowadzi do wzmożonego napięcia w mięśniach prowadzonych przez te, uszkodzone nerwy.
W porównaniu z innymi rodzajami mózgowego porażenia mózgowego, a zwłaszcza w stosunku do porażenia hipotonicznego, postać spastyczna jest zwykle łatwiejsza do opanowania przez osobę chorą; osoba ta leczona może być za pomocą metod ortopedycznych lub neurologicznych przez cały okres życia. W tej postaci może występować zarówno klonus chorej kończyny, jak i bolesne skurcze mięśni.
Postać spastyczna może prowadzić do wystąpienia bardzo wczesnych objawów występowania zapalenia stawów i zapalenia ścięgien. Terapia zajęciowa i fizjoterapia wspomagająca rozciąganie i wzmocnienie ścięgien, a także codzienne ćwiczenia oraz podejmowanie aktywności fizycznej są zazwyczaj bardzo dobrym rozwiązaniem aby objawy choroby nie postępowały. Jeśli natomiast u osoby występuje bardzo duża spastyczność, wówczas może być brane pod uwagę leczenie środkami przeciwskurczowymi, takimi jak np. toksyną botulinową, baklofenem, a także istnieje możliwość skorzystania z zabiegu neurochirurgicznego w postaci selektywnej rizotomii korzeni grzbietowych.
Postać móżdżkowa (ataksja)
Postać móżdżkowa dziecięcego porażenia mózgowego jest skutkiem uszkodzenia móżdżku, który jest głównym narządem koordynacji ruchowej. Postać ta występuje w około 5–10% wszystkich przypadków porażenia mózgowego[38]. U niektórych osób występuje hipotonia i drgawki. Zdolności motoryczne takie jak pisanie odręczne, pisanie na klawiaturze, używanie nożyczek, jak również równowaga ciała podczas chodzenia może ulec pogorszeniu. Osoby te mogą mieć trudności z analizą i syntezą wzrokowo-słuchową; obecność dyzartrii.
Postać pozapiramidowa (atetoza)
Postać pozapiramidowa (atetotyczna, dyskinetyczna) porażenia mózgowego charakteryzuje się zmiennym napięciem mięśniowym wszystkich kończyn niezależnie od woli osoby, a także występowaniem mimowolnych ruchów. Osoby cierpiące na tę postać mają problemy z utrzymaniem pozycji pionowej, stabilnej podczas chodzenia i siedzenia. Niektórym pacjentom sprawia problem użycie ręki w celu dokonania precyzyjnych czynności jak np. podrapanie się po nosie, sięganie po filiżankę. Ze względu na znacznie zmieniające się napięcie mięśniowe, osoby te mają trudności w utrzymaniu – zwłaszcza małych – przedmiotów do których wymagana jest pewna ilość precyzji, jak np. trzymanie ołówka czy szczoteczki do zębów. Mimo że postać pozapiramidową zdiagnozowano u 10% chorych na mózgowe porażenie dziecięce, to u niektórych pacjentów występują mieszane formy spastyczności i atetozy. Uszkodzenie powstaje w układzie pozapiramidowym mózgu i/lub układzie piramidowym i jądrach podstawnych.
U noworodków, w przypadku braku intensywnego leczenia wysokiego poziomu bilirubiny we krwi, może powstać uszkodzenie mózgu w zwojach podstawnych (zwanymi również jądrami podstawnymi), jak również żółtaczka jąder podkorowych mózgu, które następnie może doprowadzić do pojawienia się dyskinetycznego porażenia mózgowego.
Postać mieszana
W postaci mieszanej mózgowego porażenia dziecięcego wszystkie objawy pozostałych rodzajów MPD współwystępują ze sobą jednocześnie, każdy w różnym stopniu, a także bez żadnych wyraźnych objawów dających się sklasyfikować do konkretnego rodzaju mózgowego porażenia dziecięcego. Postać mieszana jest najtrudniejsza do leczenia ze względu na swoją niejednorodność i nieobliczalny rozwój. Występuje u około 10% pacjentów ze zdiagnozowanym mózgowym porażeniem dziecięcym.
Zapobieganie
W 2014 roku Amerykański Kongres Ginekologów i Położników (ang. American Congress of Obstetricians and Gynecologists), Królewskie Australijskie i Nowozelandzkie Kolegium Ginekologów i Położników (ang. Royal Australian and New Zealand College of Obstetricians and Gynaecologists), Towarzystwo Ginekologów i Położników Kanady (ang. Society of Obstetricians and Gynaecologists of Canada) poinformowało, iż nie ma długotrwałych korzyści z używania elektronicznego monitorowania płodu za pomocą kardiotokografii[18]. Zauważono, iż u płodów zagrożonych przedwczesnym porodem dostarczanie siarczanu magnezu sugeruje zmniejszać ryzyko wystąpienia mózgowego porażenia dziecięcego[39][40].
Nie jest jasne, czy ta metoda jest pomocna dla tych, którzy urodzili się w terminie[41], jednak zasugerowano, że chłodzenie noworodków (zaraz po porodzie) urodzonych w terminie może obniżyć ryzyko wystąpienia choroby[42].
Leczenie
Rehabilitacja próbuje naprawić poszczególne problemy fizyczne, takie jak spastyczność w danej kończynie – do uczynienia takiego leczenia częścią celu w którym osoba niepełnosprawna zmaksymalizuje swoją niezależność od innych osób i nie będzie już wymagane zaangażowanie innych osób w ćwiczeniach pacjenta[43]. Jednakże nie znaleziono wystarczających dowodów na skuteczność programów interwencyjnych odzwierciedlających tę filozofię: skuteczna rehabilitacja struktur ciała i funkcji ma silne podstawy naukowe, ale brakuje dowodów ukierunkowanych na działanie, środowisko lub osobiste warunki[43]. Nie ma także wystarczających dowodów na to, że interwencja, która będzie efektywna na poziomie ciała spowoduje poprawę na poziomie aktywności i vice versa. Mimo że tego typu korzyści mogą się zdarzyć, nie przeprowadzono wystarczająco dużo wysokiej jakości badań aby to udowodnić[43].
Leczenie mózgowego porażenia dziecięcego jest procesem trwającym całe życie osoby nim dotkniętej, koncentruje się na leczeniu objawowym i zachowawczym. Próbuje się przez to umożliwić rozwój na wszystkich poziomach funkcjonowania. Mózg do wieku około 8 lat, ciągle się szybko rozwija, ma zdolność do przekierowania wielu ścieżek sygnałowych, które mogą być uszkodzone przez początkowy uraz. Im wcześniej rozpocznie się rehabilitacja osoby z mózgowym porażeniem dziecięcym tym szybsze będą postępy w rehabilitacji.
Najlepiej potwierdzonymi metodami leczenia jest leczenie farmakologiczne (za pomocą leków przeciwdrgawkowych/przeciwpadaczkowych, toksyny botulinowej, bisfosfonianów, diazepamu), terapii (terapię mających na celu usprawnienie rąk, context-focused therapy (rodzice i terapeuci rozpoznają aktywności, które dziecko lubi, ale ma trudności w wykonaniu ich), trening fitness, terapii ukierunkowana na cel, terapię bioder (ang. hip surveillance), programy domowe, terapia zajęciowa po zastosowaniu toksyny botulinowej) i zabiegi neurochirurgiczne (selektywna rizotomia korzeni grzbietowych)[43].
Różne formy terapii są dostępne dla osób z mózgowym porażeniem dziecięcym oraz dla opiekunów i rodziców. Podejmować leczenie można za pomocą np.: fizjoterapii, terapii zajęciowej, terapii logopedycznej, terapii wody, leki do kontroli napadów padaczkowych, złagodzenia bólu lub relaksacji mięśni (np. za pomocą benzodiazepin), chirurgii w celu skorygowania nieprawidłowości anatomicznych i uwalniających napięte mięśnie, ortezy, balkoniki, i pomoce komunikacyjne takie jak komputery z dołączonymi syntezatorami mowy.
Jednakże jest tylko kilka korzyści z terapii. Leczenie jest zwykle objawowe i skupia się na pomocy osobie, by rozwinęła swoje umiejętności motoryczne tak, jak to możliwe, lub dowiedziała się jak skompensować ich brak lub niedobór. Osoby niemówiące z mózgowym porażeniem dziecięcym często skutecznie kompensują swoją niepełnosprawność poprzez korzystanie z alternatywnych metod komunikacji[43][44].
Terapia

Terapia mowy pomaga kontrolować mięśnie ust i szczęki, a także pomaga poprawić komunikację. MPD, tak jak ma wpływ na sposób, w jaki dana osoba porusza swoimi rękami i nogami, to może mieć wpływ także na sposób poruszania ust, twarzy i głowy. To może sprawić, że osoba niepełnosprawna będzie miała trudności z oddychaniem, wyraźną mową, gryzieniem, żuciem i połykaniem. W przypadku gdy dziecko ma zaburzenia mowy, to logopeda często zaczyna współpracować z dzieckiem zanim zacznie ono uczęszczać do szkoły; współpraca może trwać przez wiele lat szkolnych[45].
Konduktywna pedagogika – Nauczanie Kierowane (w Polsce bardziej znana jako Metoda Peto[46]) została opracowana na Węgrzech w 1945 roku na podstawie prac Andrása Pető. Jest to ujednolicony system rehabilitacji dla osób z zaburzeniami neurologicznymi, w tym z dziecięcym porażeniem mózgowym, chorobą Parkinsona i stwardnieniem rozsianym i podobnych. Jej celem jest podwyższenie poczucia własnej wartości dziecka, za pomocą leczenia kompleksowego, obejmującego również wytrzymałość i niezależność, jak również rozwijanie codziennych umiejętności życiowych i umiejętności społecznych. Terapeuta jest profesjonalistą, który wprowadza metodę Pető we współpracy z rodzicami i dziećmi[47].
Biofeedback jest to terapia w której ludzie uczą się kontroli mięśni dotkniętych porażeniem mózgowym. Okazała się ona pomocna w poprawie chodu u dzieci[48].
Masaż leczniczy jest zaprojektowany po to, by pomóc zrelaksować napięte mięśnie, wzmocnić je i utrzymać prawidłową ruchomość stawów[49].
Terapia zajęciowa pomaga dorosłym i dzieciom zmaksymalizować ich funkcjonowanie, dostosowywać się do własnych ograniczeń i żyć jak najbardziej niezależnie[50][51]. Terapeuta zajęciowy ściśle współpracuje z rodzinami w celu rozwiązania ich problemów i pomaga w nanoszeniu priorytetów dla ich dziecka[52].
Mózgowe porażenie dziecięce często powoduje hemiplegię (porażenie połowicze)[53]. Osoby z hemiplegią mają ograniczone ruchy dwóch kończyn po jednej stronie ciała, natomiast druga strona ciała jest zdrowa[53]. Wykonują one działania zazwyczaj przez kończyny, które są zdrowe, co może prowadzić do wzmożonych problemów w przyszłości z napięciem mięśni, problemami z motoryką i ograniczonym zakresem ruchu[53].
Terapia ręki/terapia wymuszenia ruchu (ang. constraint-induced movement therapy, CIMT) jest pomocna w rozwiązaniu tego problemu poprzez aktywizowanie ruchu chorej kończyny; rehabilitacja za pomocą tej formy polega na czasowym unieruchomieniu kończyn zdrowej strony za pomocą łusek terapeutycznych, dzięki założeniu iż centralny układ nerwowy jest plastyczny i umożliwia w ten sposób tworzenie nowych połączeń nerwowych. Wstępne dowody z 2007 roku wskazały, że terapia ta jest skuteczna, jednak w dalszym ciągu potrzebne są kolejne badania w tej dziedzinie[54].
Farmakoterapia
Iniekcje toksyny botulinowej są podawane do spastycznych lub dystoniczne, co pozwala na zredukowanie napięcia mięśniowego, które w niektórych przypadkach może być bolesne. Zmniejszenie napięcia mięśni może ułatwić usztywnienie i stosowanie ortezy. Najczęściej toksyna ta jest wstrzykiwana do dolnych partii mięśni. Następnie ogniskuje swoje leczenie, co oznacza, że w jednym czasie można leczyć ograniczoną liczbę mięśni. Efekt leczenia jadem kiełbasianym jest odwracalny i potrzebne są powtórne iniekcje w odstępie 4-6 miesięcy[55][56].
Chirurgia
Zabiegi chirurgiczne zazwyczaj wiążą się z:
- poluzowaniem napiętych mięśni i uwalnianiu stawów, najczęściej mowa o biodrach, kolanach, ścięgnach i kostkach. W rzadkich przypadkach zabiegi te mogą być stosowane dla osób, które mają sztywne łokcie, nadgarstki, dłonie i palce. Jednym z przykładów jest zabieg o nazwie Selective percutaneous myofascial lengthening (PERCS)[57].
- u młodych dorosłych umieszczenie pompy z baklofenem, najczęściej w okolicy lewej części brzucha. Jest to pompa, która jest podłączona do rdzenia kręgowego, przez co systematycznie uwalnia dawki baklofenu do złagodzenia ciągłego skurczu mięśni. Baklofen jest środkiem zwiotczającym mięśnie i jest często podawany pacjentom aby pomóc przeciwdziałać skutkom spastyczności[58].
- prostowaniem nieprawidłowych pozycji anatomicznych kości u nóg, np. kości udowej i piszczeli (skręt kości piszczelowej, ang. tibial torsion). Jest to wtórne powikłanie spowodowane przez spastyczne mięśnie, które generują nieprawidłową siłę na kości, która może doprowadzić do pojawienia się do wykrzywiania stóp do środka podczas chodzenia (tzw. gołębi chód, ang. pigeon toe). Można to wyleczyć za pomocą zabiegu osteotomii (ang. derotation osteotomy), która ma na celu skorygowanie zdeformowanych partii kości poprzez ich chirurgiczne przecięcie i przywrócenie ich do stanu zdrowego[59].
- przecięciem nerwów w kończynach najbardziej dotkniętych. Procedura ta, nazywana rizotomią, używana w leczeniu spastyczności, zmniejsza skurcze i pozwala na większą elastyczność i kontrolę przez uszkodzone kończyny i stawy[60][61].
Dostępne są również inne zabiegi chirurgiczne. U ludzi, którzy mają poważne trudności z jedzeniem można przeprowadzić gastrostomię. Nie ma wystarczających dowodów na temat skuteczności i bezpieczeństwa gastrostomii[62].
Ortopedyczne narządy medyczne takie jak ortezy stawu skokowego stóp (ang. ankle-foot orthoses; AFOs) są często przepisywane do osiągnięcia następujących celów: korekcji i/lub zapobiegania deformacji, zapewnienie wsparcia, a także szkoleń w zakresie umiejętności i poprawy chodu[63].
Z dostępnych informacji wynika, iż ortezy mogą mieć pozytywny wpływ na wszystkie czasowe i przestrzenne parametry chodu chorego, czyli prędkości, rytmu, długości kroku i redukcji zmęczenia podczas chodzenia[64][65].
Technologie asystujące
Istnieją technologie asystujące służące do pomocy osobie dotkniętej MPD; np. urządzenia do pomocy podczas przyjmowania posiłków. Istnieją aparaty wspomagające ręczne karmienie, na przykład urządzenie pomagające ludziom z drgawkami uchwycić pożywienie i następnie wprowadzić go do jamy ustnej; urządzenie dla osób które mogą żuć i przełykać, ale nie są w stanie się wyżywić; ręczne aparaty do picia dla ludzi, którzy mają trudności ze względu na drżenie kończyn górnych oraz osłabienie lub ograniczenie mobilności głowy.
Inne
Przeprowadzono badania nad używaniem hiperbarycznej terapii tlenowej (przy wykorzystaniu ciśnienia wyższego niż atmosferyczne), w której tlen pod ciśnieniem jest wdychany przez chorego przebywającego w komorze hiperbarycznej. Jedna z tez mówi, że poprawa dostępności tlenu do uszkodzonych komórek mózgu może zreaktywować niektóre z nich do poprawnego funkcjonowania. Jednak okazało się, że u niektórych dzieci, które poddawane były tlenoterapii wystąpiły działania niepożądane, takie jak drgawki, które następnie skorygowano za pomocą przyrządów wyrównujących ciśnienie w uszach[66].
Metoda Domana (ang. patterning) jest kontrowersyjną metodą leczenia dzieci z mózgowym porażeniem dziecięcym. Według twórcy tej metody, Glenna Domana, metoda ta ma doprowadzić do tego, by nieuszkodzona część mózgu, poprzez usprawnianie za pomocą czterech bloków rozwoju (fizjologicznego, intelektualnego, społecznego, fizycznego), ma przyjąć zadania jego nieuszkodzonej części; sprowadza się ona do wielosensorycznej stymulacji mózgu i ćwiczeń ruchowych (tzw. patterningów). Metoda ta została podważona naukowo przez Amerykańską Akademię Pediatryczną, która stwierdziła, że opracowana i wykorzystywana przez Glenna Domana teoria rekapitulacji filogenezy nie ma podstaw naukowych; nie znaleziono żadnego dziecka wyleczonego tą metodą – natomiast dzieci które rzekomo wyleczono metodą Domana, były w istocie rzeczy błędnie zdiagnozowane[67][68].
Rokowania
Mózgowe porażenie dziecięce jest schorzeniem, które nie postępuje (w znaczeniu: uszkodzenie mózgu jest trwałe i nie postępuje w czasie życia jednostki), ale jego objawy mogą stać się bardziej widoczne w miarę upływu czasu. W dzieciństwie możliwe jest szybsze wyleczenie dziecka jeśli otrzymuje ono szeroką opiekę medyczną, z czasem gdy struktura kości i mięśni będzie już odpowiednio rozwinięta mogą być potrzebne jednak odpowiednie przyrządy medyczne do stosowania rehabilitacji.
Pełny potencjał intelektualny dziecka urodzonego z mózgowym porażeniem dziecięcym często nie będzie znany dopóty, dopóki dziecko nie zacznie uczęszczać do szkoły. Ludzie z MPD są bardziej narażone na trudności w uczeniu się, choć badania nie wykazały związku z IQ ani niepełnosprawnością intelektualną. Poziom intelektualny osób z mózgowym porażeniem dziecięcym jest podobny do przekroju ogółu społeczeństwa. Istnieją badania, które wykazały, że ludzie z diplegią mają wyższy poziom intelektualny od ludzi z quadriplegią[69][70]. Eksperci stwierdzili, że ważne jest, by nie lekceważyć możliwości chorej osoby i zapewnić jej dostęp do nauki[71].
Średnia długość życia osób z mózgowym porażeniem dziecięcym była niższa niż w populacji ogólnej, ale poprawiła się wraz z postępem medycznym[17] i obecnie wynosi tyle ile w populacji ogólnej[72]. Wykazano jednak że długość życia tych osób wiąże się ze zdolnością do poruszania się, zmieniania pozycji ciała (również podczas leżenia), i umiejętności przyrządzania sobie pożywienia[73]. Osoby z mózgowym porażeniem dziecięcym mają w pełni sprawne funkcje rozrodcze i seksualne, więc mogą z powodzeniem urodzić dzieci i wychowywać je[74].
Zdolność do samodzielnego życia u osób z MPD jest bardzo zróżnicowana, zależy częściowo od stopnia niepełnosprawności osoby[75]. W niektórych przypadkach osoby potrzebują opieki osobistej przy niemal wszystkich czynnościach życia codziennego; inni potrzebują pomocy w niektórych działaniach; pozostali nie wymagają żadnej pomocy. Jednak niezależnie od stopnia nasilenia niepełnosprawności, zdolność danej osoby do samodzielnego życia często zależy przede wszystkim od zdolności danej osoby do zarządzania fizycznymi realiami swojego życia w sposób autonomiczny. W niektórych przypadkach osoby z mózgowym porażeniem dziecięcym zatrudniają osobistych asystentów opieki osoby niepełnosprawnej, którzy pomagają im w załatwianiu codziennych potrzeb osobistych[76].
Dbanie o siebie
W życiu wielu dzieci z mózgowym porażeniem dziecięcym, rodzice są silnie zaangażowani w opiece nad nimi oraz wyręczaniu ich w obowiązkach. Aktywności o charakterze pielęgnacyjnym, takie jak kąpiel, ubieranie i dbanie o higienę może być utrudnione ze względu na, poza znikomymi przypadkami, konieczność stosowania kończyn górnych[77]. Upośledzenie funkcji kończyny górnej dotyczy prawie 50% dzieci i jest uważane za główny czynnik przyczyniający się do zmniejszenia aktywności[78]. Jako że ręce są wykorzystywane do wielu czynności, więc upośledzenie ich funkcji skutkuje utrudnieniem wykonywania zadań za pomocą rąk[16]. Zaburzenia motoryki powodują więcej problemów niż zaburzenia sensoryczne; najczęstszy problem dotyczy zręczności palców, czyli zdolności do manipulowania małymi obiektami za pomocą palców[16].
Produktywność
Efekty zaburzeń sensorycznych, motorycznych i poznawczych mają wpływ na wydajność i produktywność w różnych zajęciach[79].
Granie jest uznawane i zalecane za produktywne zajęcie, i często są to czynności podstawowe dla dzieci[80]. Jeśli gra staje się trudna ze względu na niepełnosprawność taką jak mózgowe porażenie dziecięce, może to spowodować problemy w życiu dziecka, np. poprzez obniżenie samooceny[81]. Ponadto sensoryczne i motoryczne problemy doświadczane przez dziecko mają wpływ na to, jak wchodzi ono w interakcje z otoczeniem i z innymi ludźmi[81]. Niektóre dzieci z niepełnosprawnością spędzają więcej czasu grając samemu[82]. W przypadku gdy niepełnosprawność uniemożliwia dziecku aktywne uczestnictwo w grach z rówieśnikami, mogą w późniejszym czasie wystąpić społeczne, emocjonalne i psychologiczne problemy, co może prowadzić do zwiększenia uzależnienia od innych ludzi, mniejszej motywacji i słabszych umiejętności społecznych[83]
W szkole uczniowie wykonują zadania i działania które najczęściej są związane z pisaniem. Większość dzieci z mózgowym porażeniem dziecięcym ma zdolność do uczenia się i pisania w środowisku szkolnym[84], jednak uczniowie ci mogą mieć trudności z szybkością pisania lub ich pismo może być niewyraźne i trudne do odczytania[84]. Czynniki związane z pisaniem obejmują stabilność postawy ciała, zdolności sensoryczne i percepcyjne ręki i odpowiedni nacisk narzędzia do pisania[84].
Zaburzenia mowy mogą być widoczne u dzieci z mózgowym porażeniem dziecięcym w zależności od stopnia uszkodzenia mózgu[85]. Komunikacja w otoczeniu szkolnym jest ważna, ponieważ rozmawianie i interakcja z rówieśnikami i nauczycielami jest częścią doświadczenia szkolnego i poprawia interakcje społeczne. Problemy z językiem lub dysfunkcje motoryczne mogą prowadzić do niedoceniania inteligencji ucznia niepełnosprawnego[86].
Czas wolny
Zajęcia w czasie wolnym to wszelkie działania, które są wykonywane dla przyjemności. Aktywności te zależą od osobowości oraz środowiska i mają pozytywny wpływ na zdrowie fizyczne, psychiczne, satysfakcję z życia i psychiczny rozwój dla osób z niepełnosprawnością fizyczną, taką jak mózgowe porażenie dziecięce[87]. Korzyści między innymi to redukcja stresu, rozwijanie umiejętności radzenia sobie w trudnych sytuacjach, bycie w towarzystwie i relaks, ponadto dla dzieci z MPD wypoczynek może poprawić dostosowanie do życia z niepełnosprawnością[88].
Czas wolny można podzielić na działania strukturalne (formalne) i niestrukturalne (nieformalne)[89]. Badania pokazują, że dzieci z niepełnosprawnością, na przykład z mózgowym porażeniem dziecięcym, uczestniczą głównie w aktywnościach nieformalnych, które są przeprowadzane w środowisku rodzinnym i organizowane przez dorosłych[90]. Zazwyczaj dzieci z niepełnosprawnością wypoczywają same lub z rodzicami, rzadziej z przyjaciółmi. Dlatego dzieci te mogą odczuwać ograniczoną różnorodność działań i uczestnictwa społecznego; ich styl życia może przybierać formy bardziej bierne niż u rówieśników[90]. Mimo że wypoczynek jest ważny dla dzieci z mózgowym porażeniem dziecięcym, mogą one mieć trudności przeprowadzać zajęcia rekreacyjne z powodu barier społecznych i fizycznych[90].
Uczestnictwo i bariery
Uczestnictwo to zaangażowanie w sytuacje życiowe i codzienne aktywności[91]. Obejmuje sfery życia takie jak dbanie o siebie, produktywność i wypoczynek. W rzeczywistości, komunikacja, mobilność, edukacja, życie domowe, wypoczynek i relacje społeczne wymagają udziału i są oznakami rozmiarów, w których dziecko funkcjonuje w swoim środowisku[91]. Bariery, z którymi dziecko z niepełnosprawnością się zmaga dzielą się na trzy poziomy: mikro, mezo i makro[92]; bariery na poziomie mikro obejmują osobę, jego fizyczne ograniczenia (zaburzenia motoryczne, sensoryczne i kognitywne [poznawcze]) lub ich subiektywne odczucia odnośnie do możliwości i zdolności współuczestnictwa – na przykład dziecko może nie brać udziału w działaniu grupowym z powodu braku pewności[93]; bariery na poziomie mezo obejmują rodzinę i społeczność – może to obejmować negatywne postawy ludzi wobec niepełnosprawności i/lub brak wsparcia w rodzinie lub w społeczności[92]. Jednym z głównych powodów ograniczonego wsparcia jest wynikiem braku świadomości i wiedzy na temat zdolności dziecka do angażowania się w różnorodne działania, pomimo swojej niepełnosprawności[94]. Bariery na poziomie makro obejmują systemy i politykę, która utrudnia funkcjonowanie i życie dzieci i ludzi dorosłych z niepełnosprawnością ruchową, taką jaką jest mózgowe porażenie dziecięce; mogą to być bariery środowiskowe, np. architektoniczne, brak odpowiednich technologii wspomagających i przystosowanego transportu dzięki któremu osoby te mogłyby się przemieszczać – np. budynek bez windy utrudnia lub uniemożliwia uzyskanie dostępu do wyższych pięter[94].
Epidemiologia
Mózgowe porażenie dziecięce występuje u mniej niż 1/1000 urodzeń żywych w terminie, natomiast wzrasta do 2,1/1000 urodzeń żywych jeżeli weźmiemy pod uwagę urodzenia przedwczesne[5]. Wskaźniki te są podobne dla krajów rozwiniętych i dla krajów rozwijających się[17]; jednak może częściej występować w biedniejszych rodzinach[95]. MPD częściej dotyczy osób płci męskiej; w Europie przypada 1.3 raza częściej u mężczyzn niż u kobiet[96]. Odchylenia w ilości zgłoszonych przypadków w różnych obszarach geograficznych w państwach uprzemysłowionych są spowodowane przede wszystkim w rozbieżnościach w stosowanych kryteriach diagnostycznych wykrywania mózgowego porażenia dziecięcego u dzieci, jednak są one minimalne.
Postęp w dziedzinie opieki prenatalnej nie spowodował zauważalnego spadku urodzeń dzieci z mózgowym porażeniem dziecięcym. Generalnie jest to przypisywane do postępu medycyny w obszarach związanych z opieką nad wcześniakami, co przekłada się na wyższy wskaźnik przeżycia dzieci urodzonych przedwcześnie. Wprowadzenie wysokiej jakości opieki medycznej w miejscach gdzie opieka ta była gorszej jakości przyczyniło się do wykazania jakichkolwiek niższych wskaźników urodzeń; ryzyko urodzeń dzieci z MPD wzrasta w przypadku urodzeń przedwczesnych lub o bardzo niskiej masie urodzeniowej bez względu na jakość opieki medycznej[97].
Najlepiej jest udokumentowana i obliczona częstotliwość występowania dzieci z mózgowym porażeniem dziecięcym w wieku, gdy rozpoczynają one naukę szkolną (około 6 lat); częstość występowania w Stanach Zjednoczonych szacuje się na 2,4 na 1000 dzieci[98].
Historia
Mózgowe porażenie dziecięce towarzyszy ludziom od starożytności. Zdobiony nagrobek datowany na XV lub XIV wiek przed naszą erą przedstawia postać z jedną małą nogą i używająca kuli, prawdopodobnie ze względu na MPD. Prawdopodobnie najstarszy fizyczny dowód to mumia Siptaha, egipskiego faraona, który panował w latach 1196–1190 przed naszą erą i zmarł około 20. roku życia. Podejrzewa się, że mógł cierpieć na MPD ze względu na to, że posiadał zdeformowaną stopę i ręce[6].
Literatura medyczna starożytnych Greków omawia paraliż i słabość rąk i nóg. Słowo paraliż pochodzi od starogreckich παράλυση lub πάρεση oznaczające odpowiednio: niedowład lub paraliż. W pracach Hipokratesa (około 460–370 p.n.e.) oraz w manuskrypcie On the Sacred Disease jest opisana grupa problemów, która dobrze komponowałaby się w obecne rozumowanie mózgowego porażenia dziecięcego. Klaudiusz, cesarz rzymski (10 p.n.e. – 54 n.e.) prawdopodobnie chorował na MPD, gdyż istnieją zapisy historyczne, które opisują kilka cech fizycznych, zgadzających się z opisem choroby[6].
Za początek współczesnego rozumienia mózgowego porażenia dziecięcego jako wynik uszkodzeń mózgu przyjmuje się pierwsze dekady XIX wieku, gdyż to wówczas pojawiły się publikacje, autorów takich jak Johann Christian Reil, Claude François Lallemand i Philippe Pinel. W późniejszym czasie lekarze użyli badań przedstawionych w tych publikacjach to przypasowywania konkretnych objawów[6].
Angielski lekarz John William Little (1810-1894) był pierwszą osobą, która szeroko opisała mózgowe porażenie dziecięce. W swoich pracach stwierdził, że MPD jest wynikiem problemów okołoporodowych; później do przyczyn zakwalifikował również trudny poród, poród przedwczesny i zamartwicę okołoporodową (asfiksję). Diplegia spastyczna (parapareza) została nazwana Chorobą Little’a[6].
Pracując w Pensylwanii w latach 80. XIX wieku, kanadyjski lekarz sir William Osler wykonał dalsze obserwacje dużej liczby przypadków mózgowego porażenia dziecięcego, ze względu na stronę występowania schorzenia na ciele i stwierdził, że prawdopodobną przyczyną jest krwawienie wewnątrz mózgu. Osler podejrzewał także wirusową infekcję w mózgu powodującą stan zapalny w istocie szarej pnia mózgu jako przyczynę. Do lat 90. XIX wieku badacze powszechnie mylili MPD z polio[6].
Sigmund Freud, zanim zaczął badania w dziedzinie psychiatrii, wykonał dalsze prace nad doprecyzowaniem klasyfikacji zaburzeń, który jest używany do dnia dzisiejszego. Dzieli on przyczyny występujących zaburzeń przed porodem, problemy, które rozwijają się podczas porodu, a także problemy po urodzeniu. Freud zbadał również korelację pomiędzy schorzeniem części mózgu a lokalizacji dotkniętych kończyn w organizmie i udokumentował wiele rodzajów zaburzeń ruchowych[6].
Pierwszym lekarzem, który leczył zaburzenie jest ortopeda Winthrop Phelps (1894-1971). Uważał on że przyczyną MPD jest perspektywa narządu ruchu, a nie neurologiczna. Opracował chirurgiczne techniki operacyjne dla mięśni w celu leczenia ich spastyczności i sztywności. Węgierski lekarz András Pető opracował system nauczania dzieci technik chodzenia i wykonywania podstawowych ruchów. Metoda Peto stał się podstawą terapii objawowej (fizjoterapii; zabiegów ortopedycznych; ćwiczeń) dla dzieci i jest powszechnie stosowany do dnia dzisiejszego[6].
W 1997 roku Robert Palisano wraz ze współpracownikami wprowadził skalę, która określa rodzaj i ciężkość schorzenia o nazwie Gross Motor Function Classification System (GMFCS), która jest bardziej szczegółowa od krótkiej informacji o stopniu niepełnosprawności: lekkim, umiarkowanym i znacznym[36].
Trwające badania naukowe
Jako metoda leczenia, badana jest terapia komórkami macierzystymi[99]. Potencjalną metodą leczenia niektórych form mózgowego porażenia dziecięcego może być głęboka stymulacja mózgu[100].
Leczenie, stosowane terapie
- Uszkodzenie mózgu, które powoduje porażenie mózgowe, najczęściej nie nasila się, ale również nie ustępuje. Nie oznacza to jednak, że dziecku nie można pomóc. Leczenie porażenia mózgowego polega na określeniu stopnia inwalidztwa (psychicznego, fizycznego, słuchowego lub wzrokowego) i w miarę możliwości redukcji tych ograniczeń do minimum. Sami rodzice nie są w stanie zapewnić dziecku wystarczającej opieki i terapii.
- Opieka nad chorym wymaga współdziałania z pediatrami, logopedami i fizjoterapeutami oraz nauczycielami, a także, w niektórych przypadkach, z okulistami, laryngologami, ortopedami, terapeutami zajęciowymi, psychologami, pracownikami socjalnymi i wieloma innymi osobami. Zajęcia z fizjoterapii najczęściej prowadzone są w przychodniach, ośrodkach dla osób niepełnosprawnych oraz na turnusach rehabilitacyjnych.
- Celem ich jest zapobieganie utrwalaniu się zniekształceń poprzez relaksację sztywnych mięśni i ustawianie w najwłaściwszej pozycji chorobowo zmienionych kończyn. Zmniejszenie napięcia mięśni można także osiągnąć stosując odpowiednie leczenia farmakologiczne. Stosuje się także leki neutralizujące drgawki. Dzięki fizjoterapii z użyciem baloników i innych urządzeń ortopedycznych wiele dzieci, które nigdy nie chodziły, może nabyć tę umiejętność.
- Pomoc logopedy może podnieść zdolność komunikowania się dziecka z otoczeniem, a także zmniejszyć uciążliwości związane z połykaniem i karmieniem.
- Dzięki zabiegom operacyjnym wiele dzieci może podjąć próby chodzenia za pomocą urządzeń ortopedycznych i nie być przez całe życie skazane na wózek inwalidzki.
- Dziecko dotknięte porażeniem mózgowym powinien regularnie badać pediatra (lub inny specjalista), niekiedy przy udziale psychologa, aby ocenić jego ogólny rozwój i poziom inteligencji. Lekarze powinni omówić z rodzicami sposób postępowania, który sprzyja rozwojowi i edukacji dziecka. Wiele dzieci, u których porażenie mózgowe ma postać łagodną, a iloraz inteligencji jest prawidłowy lub bliski prawidłowemu, może uczęszczać do zwykłej szkoły.
Ludzie z mózgowym porażeniem dziecięcym
.jpg.webp)
- RJ Mitte – aktor, grał między innymi w Breaking Bad jako syn Waltera White’a[101][102][103][104]
- Evan O'Hanlon – australijski sprinter, uczestnik kilku paraolimpiad[105][106][107]
- Maysoon Zayid – amerykańska aktorka palestyńskiego pochodzenia[108][109][110][111][112][113]
- Geri Jewell – amerykańska aktorka[113][114][115][116][117]
- Abbey Curran – uczestniczka konkursu piękności w Stanach Zjednoczonych, Miss Iowa 2008[113][118][119][120]
- Wade McCrea Washington – kulturysta. Pierwsze miejsce w „Global Bodybuilding Organization Adaptive” oraz uczestnik GBO PRO ATHLETE[121][122][123][124]
- Rubén González Gallego – autor książki pt. „Białe na czarnym” – laureat Rosyjskiej Nagrody Bookera za najlepszą rosyjską powieść 2003 rok[125][126][127]
- Christy Brown – irlandzki pisarz, poeta i malarz; autor autobiograficznej książki pt. „Moja lewa stopa”[113][128][129][130]
- Christopher Nolan – irlandzki pisarz i poeta, laureat literackiej nagrody Whitbread[113][131][132][133]
- Janice Brunstrom-Hernandez – amerykańska lekarka, neurolog i naukowiec[113][134][135][136]
Klasyfikacja ICD10
| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: G80 | Mózgowe porażenie dziecięce |
| ICD-10: G80.0 | Kurczowe porażenie mózgowe (parapareza spastyczna) |
| ICD-10: G80.1 | Kurczowe porażenie obustronne (hemiplegia) |
| ICD-10: G80.2 | Dziecięce porażenie połowicze |
| ICD-10: G80.3 | Dyskinetyczne porażenie mózgowe |
| ICD-10: G80.4 | Ataktyczne porażenie mózgowe |
| ICD-10: G80.8 | Inne dziecięce porażenie mózgowe |
| ICD-10: G80.9 | Dziecięce porażenie mózgowe, nieokreślone |
Zobacz też
Przypisy
- 1 2 3 4 5 Cerebral Palsy: Hope Through Research [online], www.ninds.nih.gov [dostęp 2016-10-02].
- ↑ Cerebral Palsy: Overview [online], 8 kwietnia 2014.
- 1 2 3 OMIM Entry – # 603513 – CEREBRAL PALSY, SPASTIC QUADRIPLEGIC, 1; CPSQ1 [online], omim.org [dostęp 2016-10-02].
- ↑ How many people are affected? [online], 8 kwietnia 2014 [zarchiwizowane z adresu 2014-10-05].
- 1 2 3 4 Maryam Oskoui i inni, An update on the prevalence of cerebral palsy: a systematic review and meta-analysis, „Developmental Medicine & Child Neurology”, 6, 2013, s. 509–519, DOI: 10.1111/dmcn.12080, ISSN 1469-8749 [dostęp 2016-10-02] (ang.).
- 1 2 3 4 5 6 7 8 Christos Panteliadis, Panos Panteliadis, Frank Vassilyadi, Hallmarks in the history of cerebral palsy: from antiquity to mid-20th century, „Brain & Development”, 4, 2013, s. 285–292, DOI: 10.1016/j.braindev.2012.05.003, ISSN 1872-7131, PMID: 22658818 [dostęp 2016-10-02].
- ↑ What is Cerebral Palsy? [online], 5 lutego 2015 [dostęp 2016-10-02] [zarchiwizowane z adresu 2015-02-05].
- ↑ Strona główna [online], 17 milionów [dostęp 2019-04-08] (pol.).
- 1 2 Peter Rosenbaum i inni, A report: the definition and classification of cerebral palsy April 2006, „Developmental Medicine and Child Neurology. Supplement”, 109, 2007, s. 8–14, ISSN 0419-0238, PMID: 17370477 [dostęp 2016-10-02].
- ↑ Chapter 38: Cerebral Palsy, [w:] Ruth Kent, Handbook of Clinical Neurology 3. 110., Elsevier, 2013, s. 443–459, ISBN 978-0444529015.
- ↑ Adam T. Hirsh i inni, Symptom burden in individuals with cerebral palsy, „The Journal of Rehabilitation Research and Development”, 9, DOI: 10.1682/jrrd.2010.03.0024 [zarchiwizowane z adresu 2012-02-14].
- 1 2 David Beukelman, Scholarly writing: managing the competition for time and attention, „Augmentative and Alternative Communication”, 3, 1999, s. 212–214, DOI: 10.1080/07434619912331278735, ISSN 0743-4618 [dostęp 2016-10-02].
- ↑ Kimberly A. McKearnan i inni, Pain in Children with Cerebral Palsy, „Journal of Neuroscience Nursing”, 5, s. 252–259, DOI: 10.1097/01376517-200410000-00004 [dostęp 2016-10-02].
- ↑ Christopher J Newman, Myra O’Regan, Owen Hensey, Sleep disorders in children with cerebral palsy, „Developmental Medicine & Child Neurology”, 07, DOI: 10.1017/s0012162206001198.
- ↑ K. Klingels i inni, Upper limb motor and sensory impairments in children with hemiplegic cerebral palsy. Can they be measured reliably?, „Disability and Rehabilitation”, 5, 2010, s. 409–416, DOI: 10.3109/09638280903171469, ISSN 0963-8288 [dostęp 2016-10-02].
- 1 2 3 Mireille Donkervoort i inni, Determinants of functioning of adolescents and young adults with cerebral palsy, „Disability and Rehabilitation”, 6, 2007, s. 453–463, DOI: 10.1080/09638280600836018, ISSN 0963-8288 [dostęp 2016-10-02].
- 1 2 3 4 5 John Yarnell, Dermot O’Reilly, Epidemiology and Disease Prevention: A Global Approach, OUP Oxford, 23 maja 2013, ISBN 978-0-19-966053-7 [dostęp 2016-10-02] (ang.).
- 1 2 Karin B. Nelson, Eve Blair, Prenatal Factors in Singletons with Cerebral Palsy Born at or near Term, „The New England Journal of Medicine”, 10, 2015, s. 946–953, DOI: 10.1056/NEJMra1505261, ISSN 0028-4793 [dostęp 2016-10-02].
- ↑ William B. Carey, Developmental-behavioral Pediatrics, Elsevier Health Sciences, 2009, ISBN 1-4160-3370-X [dostęp 2016-10-02] (ang.).
- ↑ Natasha Ruth Saunders, Jonathan Hellmann, Dan Farine, Cerebral palsy and assisted conception, „Journal of obstetrics and gynaecology Canada: JOGC = Journal d’obstétrique et gynécologie du Canada: JOGC”, 10, 2011, s. 1038–1043, ISSN 1701-2163, PMID: 22014781 [dostęp 2016-10-02].
- ↑ Mikko Hallman, Premature birth and diseases in premature infants: common genetic background?, „The Journal of Maternal-Fetal & Neonatal Medicine”, sup1, 2012, s. 21–24, DOI: 10.3109/14767058.2012.667600, ISSN 1476-7058 [dostęp 2016-10-02].
- ↑ Christian F. Poets, Diethelm Wallwiener, Klaus Vetter, Risks associated with delivering infants 2 to 6 weeks before term--a review of recent data, „Deutsches Ärzteblatt International”, 43, 2012, s. 721–726, DOI: 10.3238/arztebl.2012.0721, ISSN 1866-0452, PMID: 23181136 [dostęp 2016-10-02].
- ↑ Sarah McIntyre i inni, A systematic review of risk factors for cerebral palsy in children born at term in developed countries, „Developmental Medicine and Child Neurology”, 6, 2013, s. 499–508, DOI: 10.1111/dmcn.12017, ISSN 1469-8749, PMID: 23181910 [dostęp 2016-10-02].
- ↑ Jonas H. Ellenberg, Karin B. Nelson, The association of cerebral palsy with birth asphyxia: a definitional quagmire, „Developmental Medicine and Child Neurology”, 3, 2013, s. 210–216, DOI: 10.1111/dmcn.12016, ISSN 1469-8749, PMID: 23121164 [dostęp 2016-10-02].
- 1 2 3 Cerebral Palsy: Hope Through Research [online], www.ninds.nih.gov [dostęp 2016-10-02] [zarchiwizowane z adresu 2013-08-23].
- ↑ Jennifer Teng i inni, Placental weight and neurologic outcome in the infant: a review, „The Journal of Maternal-Fetal & Neonatal Medicine: The Official Journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstetricians”, 10, 2012, s. 2082–2087, DOI: 10.3109/14767058.2012.671871, ISSN 1476-4954, PMID: 22394270 [dostęp 2016-10-02].
- ↑ Sara Kieffer, Cerebral Palsy | Johns Hopkins Pediatric Neurosurgery [online] [dostęp 2016-10-02].
- ↑ Infection in the Newborn as a Cause of Cerebral Palsy, 12/2004 [online], 2 marca 2008 [dostęp 2016-10-02] [zarchiwizowane z adresu 2008-03-02].
- ↑ Iliana Bersani, Wolfgang Thomas, Christian P. Speer, Chorioamnionitis--the good or the evil for neonatal outcome?, „The Journal of Maternal-Fetal & Neonatal Medicine: The Official Journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstetricians”, 25 Suppl 1, 2012, s. 12–16, DOI: 10.3109/14767058.2012.663161, ISSN 1476-4954, PMID: 22309119 [dostęp 2016-10-02].
- ↑ Peter O.D. Pharoah, Causal hypothesis for some congenital anomalies, „Twin Research and Human Genetics: The Official Journal of the International Society for Twin Studies”, 6, 2005, s. 543–550, DOI: 10.1375/183242705774860141, ISSN 1832-4274, PMID: 16354495 [dostęp 2016-10-02].
- 1 2 Sarah McIntyre i inni, Cerebral palsy--don’t delay, „Developmental Disabilities Research Reviews”, 2, 2011, s. 114–129, DOI: 10.1002/ddrr.1106, ISSN 1940-5529, PMID: 23362031 [dostęp 2016-10-02].
- 1 2 3 4 5 6 Margot Bosanquet i inni, A systematic review of tests to predict cerebral palsy in young children, „Developmental Medicine and Child Neurology”, 5, 2013, s. 418–426, DOI: 10.1111/dmcn.12140, ISSN 1469-8749, PMID: 23574478 [dostęp 2016-10-02].
- ↑ Hugh M. Wilson, Outline of Roentgen Diagnosis, „The Yale Journal of Biology and Medicine”, 1, 2016, s. 91–92, ISSN 0044-0086, PMCID: PMC2602010 [dostęp 2016-10-02].
- ↑ S. Ashwal i inni, Practice parameter: diagnostic assessment of the child with cerebral palsy: report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society, „Neurology”, 6, 2004, s. 851–863, ISSN 1526-632X, PMID: 15037681 [dostęp 2016-10-02].
- ↑ Peter Baxter, The Definition and Classification of Cerebral Palsy, „Developmental Medicine & Child Neurology”, Mac Keith Press, 2007, ISSN 0012-1622.
- 1 2 Susan A. Rethlefsen, Deirdre D. Ryan, Robert M. Kay, Classification systems in cerebral palsy, „The Orthopedic Clinics of North America”, 4, 2010, s. 457–467, DOI: 10.1016/j.ocl.2010.06.005, ISSN 1558-1373, PMID: 20868878 [dostęp 2016-10-02].
- ↑ Stanley F, Blair E, Alberman E, Cerebral Palsies: Epidemiology and Causal Pathways, MacKeith Press, 2000.
- ↑ What Is Cerebral Palsy? Symptoms, Treatment & Life Expectancy [online] [dostęp 2016-10-02].
- ↑ Lex W. Doyle i inni, Magnesium sulphate for women at risk of preterm birth for neuroprotection of the fetus, „The Cochrane Database of Systematic Reviews”, 1, 2009, CD004661, DOI: 10.1002/14651858.CD004661.pub3, ISSN 1469-493X, PMID: 19160238 [dostęp 2016-10-02].
- ↑ H.T. Wolf i inni, Treatment with magnesium sulphate in pre-term birth: a systematic review and meta-analysis of observational studies, „Journal of Obstetrics and Gynaecology: The Journal of the Institute of Obstetrics and Gynaecology”, 2, 2012, s. 135–140, DOI: 10.3109/01443615.2011.638999, ISSN 1364-6893, PMID: 22296422 [dostęp 2016-10-02].
- ↑ Thuy-My N. Nguyen i inni, Magnesium sulphate for women at term for neuroprotection of the fetusv, „The Cochrane Database of Systematic Reviews”, 2, 2013, CD009395, DOI: 10.1002/14651858.CD009395.pub2, ISSN 1469-493X, PMID: 23450601 [dostęp 2016-10-02].
- ↑ Susan E. Jacobs i inni, Cooling for newborns with hypoxic ischaemic encephalopathy, „The Cochrane Database of Systematic Reviews”, 1, 2013, CD003311, DOI: 10.1002/14651858.CD003311.pub3, ISSN 1469-493X, PMID: 23440789 [dostęp 2016-10-02].
- 1 2 3 4 5 Iona Novak i inni, A systematic review of interventions for children with cerebral palsy: state of the evidence, „Developmental Medicine and Child Neurology”, 10, 2013, s. 885–910, DOI: 10.1111/dmcn.12246, ISSN 1469-8749, PMID: 23962350 [dostęp 2016-10-02].
- ↑ Michael Clarke, Katie Price, Augmentative and alternative communication for children with cerebral palsy, „Paediatrics and Child Health”, 9, s. 367–371, DOI: 10.1016/j.paed.2012.03.002.
- ↑ L. Pennington, J. Goldbart, J. Marshall, Speech and language therapy to improve the communication skills of children with cerebral palsy, „The Cochrane Database of Systematic Reviews”, 2, 2004, CD003466, DOI: 10.1002/14651858.CD003466.pub2, ISSN 1469-493X, PMID: 15106204 [dostęp 2016-10-02].
- ↑ Metoda Petö – czym jest i co jest jej celem? – Zaburzenia Rozwoju – logopeda.pl – [online], logopeda.pl [dostęp 2016-10-02] [zarchiwizowane z adresu 2016-10-03].
- ↑ Rehabilitacja – Fizjoterapia – Metoda Pető (system kierowanego nauczania) [online], www.rehabilitacja.pl [dostęp 2016-10-02].
- ↑ Erbil Dursun, Nigar Dursun, Duygu Alican, Effects of biofeedback treatment on gait in children with cerebral palsy, „Disability and Rehabilitation”, 2, 2004, s. 116–120, DOI: 10.1080/09638280310001629679, ISSN 0963-8288, PMID: 14668149 [dostęp 2016-10-02].
- ↑ Russell Macgregor i inni, Effects of massage on the mechanical behaviour of muscles in adolescents with spastic diplegia: a pilot study, „Developmental Medicine and Child Neurology”, 3, 2007, s. 187–191, DOI: 10.1111/j.1469-8749.2007.00187.x, ISSN 0012-1622, PMID: 17355474 [dostęp 2016-10-02].
- ↑ Ruth A. Hansen, Ben Atchison, Conditions in occupational therapy: effect on occupational performance, Lippincott Williams & Wilkins, ISBN 0-683-30417-8.
- ↑ Elizabeth Blesedell Crepeau i inni, Willard and Spackman’s occupational therapyv, Filadelfia: Lippincott-Raven Publishers, 2000, ISBN 0-397-55192-4.
- ↑ Shelley Mulligan, Occupational therapy evaluation for children. A pocket guide, Lippincott Williams & Wilkins, ISBN 978-0-7817-3163-8.
- 1 2 3 B.J. Hoare i inni, Constraint-induced movement therapy in the treatment of the upper limb in children with hemiplegic cerebral palsy, „The Cochrane Database of Systematic Reviews”, 2, 2007, CD004149, DOI: 10.1002/14651858.CD004149.pub2, ISSN 1469-493X, PMID: 17443542 [dostęp 2016-10-02].
- ↑ Terapia wymuszenia ruchu – nadzieja dla pacjentów po udarze? – Polki.pl [online], 3 listopada 2010 [dostęp 2016-10-02].
- ↑ Susan D. Apkon, Danielle Cassidy, Safety considerations in the use of botulinum toxins in children with cerebral palsy, „PM & R: the journal of injury, function, and rehabilitation”, 4, 2010, s. 282–284, DOI: 10.1016/j.pmrj.2010.02.006, ISSN 1934-1482, PMID: 20430330 [dostęp 2016-10-02].
- ↑ Florian Heinen i inni, The updated European Consensus 2009 on the use of Botulinum toxin for children with cerebral palsy, „European journal of paediatric neurology: EJPN: official journal of the European Paediatric Neurology Society”, 1, 2010, s. 45–66, DOI: 10.1016/j.ejpn.2009.09.005, ISSN 1532-2130, PMID: 19914110 [dostęp 2016-10-02].
- ↑ Evanthia A. Mitsiokapa i inni, Selective percutaneous myofascial lengthening of the lower extremities in children with spastic cerebral palsy, „Clinics in Podiatric Medicine and Surgery”, 2, 2010, s. 335–343, DOI: 10.1016/j.cpm.2009.12.005, ISSN 1558-2302, PMID: 20470962 [dostęp 2016-10-02].
- ↑ Medscape Log In [online], www.medscape.com [dostęp 2016-10-02].
- ↑ A. Schejbalová, [Derotational subtrochanteric osteotomy of the femur in celebral palsy patients], „Acta Chirurgiae Orthopaedicae Et Traumatologiae Cechoslovaca”, 5, 2006, s. 334–339, ISSN 0001-5415, PMID: 17140515 [dostęp 2016-10-02].
- ↑ Jean-Pierre Farmer, Abdulrahman J. Sabbagh, Selective dorsal rhizotomies in the treatment of spasticity related to cerebral palsy, „Child’s Nervous System: ChNS: Official Journal of the International Society for Pediatric Neurosurgery”, 9, 2007, s. 991–1002, DOI: 10.1007/s00381-007-0398-2, ISSN 0256-7040, PMID: 17643249 [dostęp 2016-10-02].
- ↑ Elena Carraro i inni, Multidimensional outcome measure of selective dorsal rhizotomy in spastic cerebral palsy, „European Journal of Paediatric Neurology”, 6, s. 704–713, DOI: 10.1016/j.ejpn.2014.06.003.
- ↑ Sapthagiri Gantasala, Peter B. Sullivan, Adrian G. Thomas, Gastrostomy feeding versus oral feeding alone for children with cerebral palsy, „The Cochrane Database of Systematic Reviews”, 7, 2013, CD003943, DOI: 10.1002/14651858.CD003943.pub3, ISSN 1469-493X, PMID: 23900969 [dostęp 2016-10-02].
- ↑ Condie DN, Meadows CB, Report of a Consensus Conference on the Lower Limb Orthotic Management of Cerebral Palsy, Kopenhaga: International Society of Prosthetics & Orthotics, 1995.
- ↑ Alison H. Harrill i inni, Population-Based Discovery of Toxicogenomics Biomarkers for Hepatotoxicity Using a Laboratory Strain Diversity Panel, „Toxicological Sciences”, 1, 2016, s. 235–243, DOI: 10.1093/toxsci/kfp096, ISSN 1096-6080, PMCID: PMC2696330 [dostęp 2016-10-02].
- ↑ Birol Balaban i inni, The effect of hinged ankle-foot orthosis on gait and energy expenditure in spastic hemiplegic cerebral palsy, „Disability and Rehabilitation”, 2, 2007, s. 139–144, ISSN 0963-8288, PMID: 17373095 [dostęp 2016-10-02].
- ↑ Marian S. McDonagh i inni, Systematic review of hyperbaric oxygen therapy for cerebral palsy: the state of the evidence, „Developmental Medicine and Child Neurology”, 12, 2007, s. 942–947, DOI: 10.1111/j.1469-8749.2007.00942.x, ISSN 0012-1622, PMID: 18039243 [dostęp 2016-10-02].
- ↑ Metoda Domana | Edukacja-Klasyczna.PL [online], www.edukacja-klasyczna.pl [dostęp 2016-10-02].
- ↑ P.R. Ziring i inni, American Academy of Pediatrics. Committee on Children with Disabilities. The treatment of neurologically impaired children using patterning, „Pediatrics”, 5 Pt 1, 1999, s. 1149–1151, ISSN 0031-4005, PMID: 10545565 [dostęp 2016-10-02].
- ↑ J. Ito i inni, Intellectual status of children with cerebral palsy after elementary education, „Pediatric Rehabilitation”, 4, 2016, s. 199–206, ISSN 1363-8491, PMID: 9689256 [dostęp 2016-10-02].
- ↑ Chitra Sankar, Nandini Mundkur, Cerebral Palsy–Definition, Classification, Etiology and Early Diagnosis, Indian Journal of Pediatrics, Volume 72, 2005.
- ↑ Kathleen M. Jenks i inni, The effect of cerebral palsy on arithmetic accuracy is mediated by working memory, intelligence, early numeracy, and instruction time, „Developmental Neuropsychology”, 3, 2007, s. 861–879, DOI: 10.1080/87565640701539758, ISSN 8756-5641, PMID: 17956186 [dostęp 2016-10-02].
- ↑ Jane L. Hutton, Cerebral palsy life expectancy, „Clinics in Perinatology”, 2, 2006, s. 545–555, DOI: 10.1016/j.clp.2006.03.016, ISSN 0095-5108, PMID: 16765736 [dostęp 2016-10-02].
- ↑ David Strauss i inni, Life expectancy in cerebral palsy: an update, „Developmental Medicine and Child Neurology”, 7, 2008, s. 487–493, DOI: 10.1111/j.1469-8749.2008.03000.x, ISSN 0012-1622, PMID: 18611196 [dostęp 2016-10-02].
- ↑ Diana Wiegerink i inni, Sexuality of Young Adults with Cerebral Palsy: Experienced Limitations and Needs, „Sexuality and Disability”, 2, 2010, s. 119–128, DOI: 10.1007/s11195-010-9180-6, ISSN 0146-1044 [dostęp 2016-10-02] (ang.).
- ↑ Independence and Self-Sufficiency [online] [dostęp 2016-10-02].
- ↑ CP & Aging [online], www.cerebralpalsyworld.com [dostęp 2016-10-02].
- ↑ B.R. Van Zelst i inni, Activities of daily living in children with hemiplegic cerebral palsy: a cross-sectional evaluation using the Assessment of Motor and Process Skills, „Developmental Medicine and Child Neurology”, 9, 2006, s. 723–727, DOI: 10.1017/S0012162206001551, ISSN 0012-1622, PMID: 16904017 [dostęp 2016-10-02].
- ↑ Channah Nieuwenhuijsen i inni, Experienced problems of young adults with cerebral palsy: targets for rehabilitation care, „Archives of Physical Medicine and Rehabilitation”, 11, 2009, s. 1891–1897, DOI: 10.1016/j.apmr.2009.06.014, ISSN 1532-821X, PMID: 19887214 [dostęp 2016-10-02].
- ↑ Ermellina Fedrizzi i inni, Hand function in children with hemiplegic cerebral palsy: prospective follow-up and functional outcome in adolescence, „Developmental Medicine & Child Neurology”, 02, DOI: 10.1017/s0012162203000173.
- ↑ Blesedell CE, Cohn ES, Schell AB, Willard and Spackman’s occupational therapy, Filadelfia: Lippincot, Williams and Wilkins, 2003, s. 705–709.
- 1 2 Townsend E, Stanton S, Law M., Enabling occupation: An occupational therapy perspective., Ottawa: Canadian Association of Occupational Therapists, 1997, s. 34.
- ↑ Elsevier, Play in Occupational Therapy for Children – 2nd Edition, www.elsevier.com, ISBN 978-0-323-02954-4 [dostęp 2016-10-02].
- ↑ Linda L Hestenes, Deborah E Carroll, The play interactions of young children with and without disabilities: Individual and environmental influences, „Early Childhood Research Quarterly”, 2, 2000, s. 229–246, DOI: 10.1016/S0885-2006(00)00052-1 [dostęp 2016-10-02].
- 1 2 3 G.M. Mead, J.M. Whitehouse, Clinical aspects of Hodgkin’s disease., „BMJ: British Medical Journal”, 6663, 1988, s. 1562–1564, ISSN 0959-8138, PMCID: PMC1835302 [dostęp 2016-10-02].
- ↑ Lynne Howard, A Comparison of Leisure-Time Activities between Able-Bodied Children and Children with Physical Disabilities, „The British Journal of Occupational Therapy”, 12, 1996, s. 570–574, DOI: 10.1177/030802269605901208, ISSN 0308-0226 [dostęp 2016-10-02] (ang.).
- ↑ Patricia Rigby, Heidi Schwellnus, Occupational Therapy Decision Making Guidelines for Problems in Written Productivity, „Physical & Occupational Therapy In Pediatrics”, 1, 1999, s. 5–27, DOI: 10.1080/J006v19n01_02, ISSN 0194-2638 [dostęp 2016-10-02].
- ↑ Martine Smith, Annika Dahlgren Sandberg, Maria Larsson, Reading and spelling in children with severe speech and physical impairments: a comparative study, „International Journal of Language & Communication Disorders”, 6, 2009, s. 864–882, DOI: 10.1080/13682820802389873, ISSN 1460-6984 [dostęp 2016-10-02] (ang.).
- ↑ David W. Pruitt, Tobias Tsai, Common medical comorbidities associated with cerebral palsy, „Physical Medicine and Rehabilitation Clinics of North America”, 3, 2009, s. 453–467, DOI: 10.1016/j.pmr.2009.06.002, ISSN 1558-1381, PMID: 19643347 [dostęp 2016-10-02].
- ↑ Tony Cassidy, All work and no play: A focus on leisure time as a means for promoting health, „Counselling Psychology Quarterly”, 1, 1996, s. 77–90, DOI: 10.1080/09515079608256354, ISSN 0951-5070 [dostęp 2016-10-02].
- 1 2 3 Frances Reynolds, Coping with Chronic Illness and Disability through Creative Needlecraft, „The British Journal of Occupational Therapy”, 8, 1997, s. 352–356, DOI: 10.1177/030802269706000806, ISSN 0308-0226 [dostęp 2016-10-02] (ang.).
- 1 2 Gillian King i inni, A conceptual model of the factors affecting the recreation and leisure participation of children with disabilities, „Physical & Occupational Therapy in Pediatrics”, 1, 2003, s. 63–90, ISSN 0194-2638, PMID: 12703385 [dostęp 2016-10-02].
- 1 2 Cara Aitchison, From leisure and disability to disability leisure: developing data, definitions and discourses, „Disability & Society”, 7, 2003, s. 955–969, DOI: 10.1080/0968759032000127353, ISSN 0968-7599 [dostęp 2016-10-02].
- ↑ Christine Imms, Children with cerebral palsy participate: a review of the literature, „Disability and Rehabilitation”, 24, 2008, s. 1867–1884, DOI: 10.1080/09638280701673542, ISSN 0963-8288, PMID: 19037780 [dostęp 2016-10-02].
- 1 2 J. Specht i inni, The Importance of Leisure in the Lives of Persons With Congenital Physical Disabilities, „American Journal of Occupational Therapy”, 4, 2002, s. 436–445, DOI: 10.5014/ajot.56.4.436, ISSN 0272-9490 [dostęp 2016-10-02].
- ↑ Else Odding, Marij E. Roebroeck, Hendrik J. Stam, The epidemiology of cerebral palsy: incidence, impairments and risk factors, „Disability and Rehabilitation”, 4, 2006, s. 183–191, DOI: 10.1080/09638280500158422, ISSN 0963-8288, PMID: 16467053 [dostęp 2016-10-02].
- ↑ Prevalence and characteristics of children with cerebral palsy in Europe, „Developmental Medicine and Child Neurology”, 9, 2002, s. 633–640, ISSN 0012-1622, PMID: 12227618 [dostęp 2016-10-02].
- ↑ Bax Martin i inni, Developmental Medicine & Child Neurology, Cambridge Journal, 2005, s. 571–576.
- ↑ D. Hirtz i inni, How common are the „common” neurologic disorders?, „Neurology”, 5, 2007, s. 326–337, DOI: 10.1212/01.wnl.0000252807.38124.a3, ISSN 1526-632X, PMID: 17261678 [dostęp 2016-10-02].
- ↑ Laura Bennet i inni, Cell therapy for neonatal hypoxia-ischemia and cerebral palsy, „Annals of Neurology”, 5, 2012, s. 589–600, DOI: 10.1002/ana.22670, ISSN 1531-8249, PMID: 22522476 [dostęp 2016-10-02].
- ↑ Anne Koy i inni, Effects of deep brain stimulation in dyskinetic cerebral palsy: A meta-analysis, „Movement Disorders”, 5, 2013, s. 647–654, DOI: 10.1002/mds.25339, ISSN 1531-8257 [dostęp 2016-10-02] (ang.).
- ↑ RJ Mitte z „Breaking Bad”: Niepełnosprawność to siła [online], www.niepelnosprawni.pl [dostęp 2019-12-15] (pol.).
- ↑ Felicity Kinsella, znany z breaking bad rj mitte zmienia poglądy hollywood na niepełnosprawność [online], i-D, 27 marca 2015 [dostęp 2019-12-15] (pol.).
- ↑ RJ Mitte – aktor z Breaking Bad – rozpoczyna karierę muzyczną? Syn filmowego Waltera White’a zostanie DJ’em [VIDEO] [online], www.eska.pl [dostęp 2019-12-15].
- ↑ Piątkowa ciekawostka o...: „Breaking Bad” [online], Głos Kultury, 17 lutego 2017 [dostęp 2019-12-15] (pol.).
- ↑ Evan O’Hanlon: About my disability [online], International Paralympic Committee [dostęp 2019-12-15] (ang.).
- ↑ Eamonn Tiernan, Evan O’Hanlon admits Paralympic heartbreak spurring him to Commonwealth Games glory [online], The Sydney Morning Herald, 21 lutego 2018 [dostęp 2019-12-15] (ang.).
- ↑ News | Athletics Australia [online], www.athletics.com.au [dostęp 2019-12-15].
- ↑ Cara Buckley, Heard the One About the Disabled Muslim Comic From Jersey?, „The New York Times”, 29 października 2018, ISSN 0362-4331 [dostęp 2019-12-15] (ang.).
- ↑ A.B.C. News, Comic Maysoon Zayid is making disability mainstream [online], ABC News [dostęp 2019-12-15] (ang.).
- ↑ MAYSOON ZAYID [online], Cerebral Palsy Foundation, 9 września 2016 [dostęp 2019-12-15] (ang.).
- ↑ Maysoon Zayid: “We are not making history, we are changing the story” [online], UNESCO, 30 listopada 2017 [dostęp 2019-12-15] (ang.).
- ↑ Comedian Maysoon Zayid cerebral palsy advocate /MI birth injury lawyer [online], Thurswell Law, 26 grudnia 2017 [dostęp 2019-12-15] (ang.).
- 1 2 3 4 5 6 Sławne osoby z MPD [online], Beata Wnuk, 14 lipca 2019 [dostęp 2019-12-15] (pol.).
- ↑ Geri Jewell [online], cerebralpalsy.org [dostęp 2019-12-15] (ang.).
- ↑ Geri Jewell – Actor, Comedian, Activist, Author, Speaker [online] [dostęp 2019-12-15] [zarchiwizowane z adresu 2019-10-22] (ang.).
- ↑ Mitchell Sunderland, How to Survive Life According to Gay Disabled ‘Facts of Life’ Star Geri Jewell [online], Vice, 5 sierpnia 2015 [dostęp 2019-12-15] (ang.).
- ↑ ‘Facts of Life’ star Geri Jewell comes out in new memoir, ‘I’m Walking as Straight as I Can’ [online], EW.com [dostęp 2019-12-15] (ang.).
- ↑ Confidence Through Pageantry [online], cerebralpalsy.org [dostęp 2019-12-15] (ang.).
- ↑ A Beauty Queen with Cerebral Palsy [online], PEOPLE.com [dostęp 2019-12-15] (ang.).
- ↑ 8 Celebrities With Cerebral Palsy [online], mangarhealth.com [dostęp 2019-12-15].
- ↑ #WeSeeYou: Wade McCrae Washington, The Cerebral Palsy BodyBuilder | BlackDoctor [online], blackdoctor.org [dostęp 2019-12-15].
- ↑ Texan of the Year finalist: Professional bodybuilder Wade McCrae Washington [online], Dallas News, 15 grudnia 2016 [dostęp 2019-12-15] (ang.).
- ↑ Wade Washington Hasn’t Let Cerebral Palsy Slow His Bodybuilding [online], www.msn.com [dostęp 2019-12-15].
- ↑ Maya A. Jones, Cerebral palsy isn’t stopping Wade McCrae Washington from living his dream [online], The Undefeated, 29 czerwca 2016 [dostęp 2019-12-15] (ang.).
- ↑ Kate Kellaway, Kate Kellaway meets Ruben Gallego, „The Observer”, 2006, ISSN 0029-7712 [dostęp 2019-12-15] (ang.).
- ↑ Liza Rozovsky, The Incredible Survival Story of Acclaimed Russian Author Ruben Gonzalez Gallego, „Haaretz”, 9 listopada 2018 [dostęp 2019-12-15] (ang.).
- ↑ Русский Букер – Литературная Премия – Russian Booker. [online], www.russianbooker.org [dostęp 2019-12-15] [zarchiwizowane z adresu 2019-11-23].
- ↑ B. Myint, Christy Brown: The Tragic Ending They Left Out of ‘My Left Foot’ [online], Biography [dostęp 2019-12-15] (ang.).
- ↑ Christy Brown: The Novelist and Painter With Cerebral Palsy Depicted in the Movie “My Left Foot” [online], Owlcation [dostęp 2019-12-15] (ang.).
- ↑ Christy Brown, [w:] Encyclopædia Britannica [dostęp 2022-09-30] (ang.).
- ↑ Christopher Nolan: Irish author who overcame cerebral palsy to win the [online], The Independent, 23 lutego 2009 [dostęp 2019-12-15] (ang.).
- ↑ Christopher Hawtree, Obituary: Christopher Nolan, „The Guardian”, 23 lutego 2009, ISSN 0261-3077 [dostęp 2019-12-15] (ang.).
- ↑ Irish author Christopher Nolan dies [online], The Irish Times [dostęp 2019-12-15] (ang.).
- ↑ Jane E. Brody, PERSONAL HEALTH; Living With Cerebral Palsy, in the Gym and With a Kick, „The New York Times”, 11 marca 2003, ISSN 0362-4331 [dostęp 2019-12-15] (ang.).
- ↑ Neurologist Janice E. Brunstrom-Hernandez ’83 to Deliver 2015 Meant to Live Lecture [online], Pacific Lutheran University [dostęp 2019-12-15] (ang.).
- ↑ Washington University in St. Louis Magazine [online], magazine-archives.wustl.edu [dostęp 2019-12-15].
Bibliografia
- Pediatria pod redakcją Krystyny Kubickiej i Wandy Kawalec
- Ewa Gajewska Nowe definicje i skale funkcjonalne stosowane w mózgowym porażeniu dziecięcym Neurologia dziecięca, 2009, 18, 67-72.
Linki zewnętrzne
- Mózgowe porażenie dziecięce – artykuł w Medycynie Praktycznej
- Anglojęzyczna strona internetowa Światowego Dnia Mózgowego Porażenia Dziecięcego
- strona poświęcona mózgowemu porażeniu dziecięcemu
- artykuł o MPD w Neuropsychologii
- artykuł o mózgowym porażeniu dziecięcym w Medonet
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.