
4IO
3
Pochodne tlenowych kwasów jodu – grupa związków chemicznych obejmująca przede wszystkim sole tlenowych kwasów jodu. Estry tych kwasów są rzadsze. Sole są zwykle substancjami krystalicznymi i mają właściwości utleniające, tym silniejsze, im niższy jest stopień utlenienia jodu[1].
Zestawienie soli tlenowych kwasów jodu
Podjodyny
Podjodyny, w systemie Stocka jodany(I), to sole kwasu podjodawego (HIO) o wzorze ogólnym X(IO)
n[uwaga 1]. Zawierają anion podjodynowy IO−
.
Podjodyny są niestabilne zarówno w stanie czystym, jak i w roztworach wodnych. Ulegają dysproporcjonowaniu do jodków i jodanów. Można je otrzymać w reakcji jodu z wodorotlenkami[2]:
- I
2 + 2NaOH → NaIO + NaI + H
2O
Jodyny
Jodyny, in. jodany(III), to sole kwasu jodawego (HIO
2) o wzorze ogólnym X(IO
2)
n[uwaga 1]. Zawierają anion jodynowy IO−
2.
Jodany
Jodany, in. jodany(V), to sole kwasu jodowego (HIO
3) o wzorze ogólnym X(IO
3)
n[uwaga 1]. Zawierają anion jodanowy IO−
3.
Są to substancje rozpuszczalne w wodzie. Powstają w wyniku dysproporcjonowania podjodynów[2]:
- 3NaIO → NaIO
3 + 2NaI
lub w reakcjach jodu i gorących roztworów zasad.
Nadjodany
Wśród nadjonadów, w systemie Stocka jodanów(VII), wyróżnia się metanadjodany i ortonadjodany:
- metanadjodany – sole kwasu metanadjodowego (HIO
4) o wzorze ogólnym X(IO
4)
n[uwaga 1]. Zawierają anion metanadjodanowy IO−
4. - ortonadjodany – sole kwasu ortonadjodowego (H
5IO
6), o wzorze ogólnym X
5(IO
6)
n[uwaga 1]. Zawierają anion ortonadjodanowy IO5−
6.
Nadjodany można otrzymać przez utlenienie jodanów za pomocą podchlorynów[2].
Zastosowanie soli tlenowych kwasów jodu
Związki te stosowane są jako środki utleniające oraz odczynniki w analizie chemicznej (jodometrii)[2]. Z podjodynów można otrzymać wolny jod, gdyż po zakwaszeniu roztworu dysproporcjonują do jodanów i jodków, które z reagują następnie ze sobą zgodnie z równaniem[2]:
- IO−
3 + 5I−
+ 6H+
→ 3I
2 + 3H
2O
Pochodne organiczne tlenowych kwasów jodu
Spośród 4 tlenowych kwasów jodu opisane są organiczne pochodne tworzone przez kwas podjodawy (HIO) i jodowy (HIO
3)[3].
Pochodne kwasu podjodawego
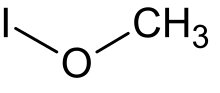
Znanych jest kilkadziesiąt estrów typu R−O−I, np. podjodyn metylu (CH
3IO) lub podjodyn fenylu (PhIO). Podjodyny alkilowe i arylowe pod wpływem światła UV ulegają wolnorodnikowemu rozpadowi z wytworzeniem aldehydów i ketonów[4].
Kwas podjodawy tworzy mieszane bezwodniki z kwasami karboksylowymi, typu R−C(O)−O−I, np. podjodyn acetylu, CH
3COOI (AcOI). Związki tego typu można otrzymać w reakcji jodu z bezwodnikiem kwasowym lub solą srebrową kwasu:
- CH
3COOAg + I
2 → CH
3COOI + AgI↓
Bezwodniki karboksylowo-podjodynowe reagują z alkoholami tworząc estry podjodynowe[4]:
- CH
3COOI + ROH ⇌ ROI + CH
3COOH
Pochodne kwasu jodowego
Opisane zostało jedynie 5 pochodnych organicznych kwasu jodowego:
- jodan metylu, CH
3IO
3 (nierozpuszczalne ciało stałe otrzymane przez kwasową hydrolizę difluorojodanu metylu, O=IF
2OCH
3[5]) - jodan trifenylometylu (jodan trytylu), Ph
3CIO
3 (TrIO
3)[6]:
- TrCl + AgIO
3 → TrIO
3 + AgCl↓
- jodan metylenu, CH
2(IO
3)
2 (służący jako donor grupy metylenowej w elektrofilowej addycji do wiązania podwójnego[7]) - mieszany bezwodnik trifluorooctowo-jodanowy, CF
3COOIO
2 (struktura niepotwierdzona) - dijodan dibenzylotelluru, Bn
2Te(IO
3)
2.
Zobacz też
Uwagi
Przypisy
- ↑ Adam Bielański, Chemia ogólna i nieorganiczna, Warszawa: Państwowe Wydawnictwo Naukowe, 1981, s. 349, ISBN 83-01-02626-X.
- 1 2 3 4 5 Włodzimierz Trzebiatowski, Chemia nieorganiczna, wyd. 8, Warszawa: Państwowe Wydawnictwo Naukowe, 1978, s. 172–173.
- ↑ Beilstein, wersja 2010/2.
- 1 2 Thomas R. Beebe i inni, Oxidation of alcohols with acetyl hypoiodite, „Journal of Organic Chemistry”, 40 (13), 1975, s. 1992–1994, DOI: 10.1021/jo00901a028 (ang.).
- ↑ Herman Josef Frohn, Wolfgang Pahlmann, Beiträge zur chemie des iodpentafluorids. Teil I. Iod(V)-verbindungen mit monofunktionellen alkoholaten, „Journal of Fluorine Chemistry”, 24 (2), 1984, s. 219–232, DOI: 10.1016/S0022-1139(00)85206-9 (niem.).
- ↑ M. Anbar i inni, Esters of inorganic oxyacids. Part I. The mechanism of hydrolysis of alkyl esters, 18O being used as tracer, and its relation to other reactions in alkaline media, „Journal of the Chemical Society”, 1954, s. 3603–3611, DOI: 10.1039/JR9540003603 (ang.).
- ↑ R. Touillaux i inni, Configuration and 13C NMR spectra of alkylcyclopropane derivatives, „Organic Magnetic Resonance”, 16 (1), 1981, s. 71–72, DOI: 10.1002/mrc.1270160120 (ang.).