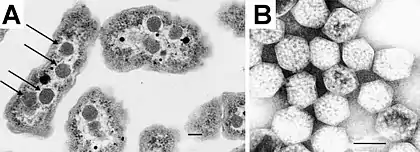
Karboksysomy – organelle występujące u niektórych bakterii wiążących dwutlenek węgla (CO2), przeprowadzających fotosyntezę lub chemosyntezę. Wewnątrz struktur znajdują się enzymy odpowiedzialne za asymilację węgla[2]. Do struktur tych aktywnie transportowane są jony wodorowęglanowe (HCO3−), które następnie ulegają przekształceniu do CO2 przez obecną w karboksysomach anhydrazę węglanową, w efekcie dochodzi do lokalnego wzrostu stężenia CO2 i zwiększenia wydajności reakcji karboksylacji przeprowadzanej przez enzym Rubisco. Reakcja karboksylacji jest reakcją ograniczającą zachodzenie cyklu Calvina. Karboksysomy mają kształt wielościanów o średnicy od 80 do 140 nm i zbudowane są z białka[3][4].
Struktury zostały znalezione u wszystkich sinic i wielu bakterii chemosyntetyzujących, u których dochodzi do asymilacji węgla[5].
Białka tworzące karboksysomy należą do szerszej grupy białek tworzących mikrokompartamenty o różnych funkcjach, lecz zbliżonej strukturze opartej na dwóch rodzinach białek budujących otoczkę[6].
Odkrycie
Karboksysomy zostały po raz pierwszy zaobserwowane w komórkach sinicy Phormidium uncinatum w roku 1956[5][7]. Na początku lat sześćdziesiątych XX wieku podobne struktury zostały dostrzeżone także u innych sinic[8]. Obserwowane obiekty zostały nazwane w roku 1961 "ciałkami wielościennymi", a w kolejnych latach odkryto ich istnienie również u niektórych bakterii chemoautotroficznych, wiążących dwutlenek węgla (np. Halothiobacillus, Acidithiobacillus, Nitrobacter oraz Nitrococcus)[5][9].
Zostały wyizolowane i oczyszczone z Thiobacillus neapolitanus w roku 1973[10]. Wtedy stwierdzono, że zawierają wewnątrz enzym Rubisco. Na podstawie badań ustalono, że organella biorą udział w asymilacji węgla, co stało się podstawa do nadania stosowanej nazwy[11].
Budowa
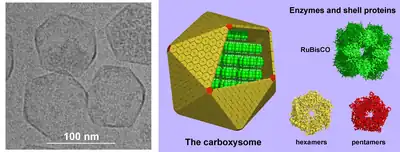
Karboksysomy mają kształt ikosaedru lub zbliżony, zwykle o średnicy 80-120 nm. Zewnętrzna otoczka składa się z kilku tysięcy podjednostek białkowych. Wewnątrz znajdują się enzymy odpowiedzialne za asymilację węgla – anhydraza węglanowa i Rubisco. Struktura otoczki białkowej została poznana dzięki rentgenografii strukturalnej. Główne białko tworzące otoczkę to cykliczny heksamer, tworzący ściany wielościanu. Niewielkie pory obecne w strukturze heksamerów umożliwiają wniknięcie do środka substratów (wodorowęglanu i rybulozo-1,5-bisfosforanu) oraz wyjście produktu (3-fosfoglicerynianu). Budowa porów zapewnia aktywny transport związków wymienianych przez organellum z otoczeniem. Wśród pozostałych komponentów otoczki znajdują się pentameryczne białka, które prawdopodobnie tworzą wierzchołki ikosaedru[12].
Podobnie jak karboksysomy z wielu białek heksamerycznych i pentamerycznych zbudowane są liczne kapsydy wirusów, nie jest jednak jasne, czy istnieje ewolucyjny związek pomiędzy budową karboksysomów i kapsydów wirusów. Badania struktury karboksysomów wykazały, że wewnątrz otoczki znajduje się około 250 cząsteczek Rubisco tworzących trzy lub cztery koncentryczne warstwy[13][14].
Badania na mutantach Halothiobacillus neapolitanus nieposiadających Rubisco wykazały, że puste otoczki zachowują kształt, co sugeruje iż biogeneza otoczki karboksysomu i wbudowanie enzymów są dwoma niezależnymi, ale funkcjonalnie połączonymi procesami. Doświadczenia wskazują, że o możliwości wbudowania Rubisco decyduje duża podjednostka enzymu[15].
Zobacz też
Przypisy
- ↑ Y. Tsai, MR. Sawaya, GC. Cannon, F. Cai i inni. Structural analysis of CsoS1A and the protein shell of the Halothiobacillus neapolitanus carboxysome.. „PLoS Biol”. 5 (6), s. e144, Jun 2007. DOI: 10.1371/journal.pbio.0050144. PMID: 17518518.
- ↑ MR. Badger, GD. Price. CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution.. „J Exp Bot”. 54 (383), s. 609-22, Feb 2003. PMID: 12554704.
- ↑ Władysław J.H. Kunicki- Goldfinger: Życie bakterii. Warszawa: Wydawnictwo Naukowe PWN, 1998. ISBN 978-83-01-14378-7.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 300-301. ISBN 83-01-13753-3.
- 1 2 3 TO. Yeates, CA. Kerfeld, S. Heinhorst, GC. Cannon i inni. Protein-based organelles in bacteria: carboxysomes and related microcompartments.. „Nat Rev Microbiol”. 6 (9), s. 681-91, Sep 2008. DOI: 10.1038/nrmicro1913. PMID: 18679172.
- ↑ GC. Cannon, CE. Bradburne, HC. Aldrich, SH. Baker i inni. Microcompartments in prokaryotes: carboxysomes and related polyhedra.. „Appl Environ Microbiol”. 67 (12), s. 5351-61, Dec 2001. DOI: 10.1128/AEM.67.12.5351-5361.2001. PMID: 11722879.
- ↑ G. DREWS, W. NIKLOWITZ. [Cytology of Cyanophycea. II. Centroplasm and granular inclusions of Phormidium uncinatum.]. „Arch Mikrobiol”. 24 (2), s. 147-62, 1956. PMID: 13327992.
- ↑ E. Gantt, SF. Conti. Ultrastructure of blue-green algae.. „J Bacteriol”. 97 (3), s. 1486-93, Mar 1969. PMID: 5776533.
- ↑ JM. Shively. Inclusion bodies of prokaryotes.. „Annu Rev Microbiol”. 28 (0), s. 167-87, 1974. DOI: 10.1146/annurev.mi.28.100174.001123. PMID: 4372937.
- ↑ JM. Shively, F. Ball, DH. Brown, RE. Saunders. Functional organelles in prokaryotes: polyhedral inclusions (carboxysomes) of Thiobacillus neapolitanus.. „Science”. 182 (112), s. 584-6, Nov 1973. PMID: 4355679.
- ↑ JM. Shively, FL. Ball, BW. Kline. Electron microscopy of the carboxysomes (polyhedral bodies) of Thiobacillus neapolitanus.. „J Bacteriol”. 116 (3), s. 1405-11, Dec 1973. PMID: 4127632.
- ↑ S. Tanaka, CA. Kerfeld, MR. Sawaya, F. Cai i inni. Atomic-level models of the bacterial carboxysome shell.. „Science”. 319 (5866), s. 1083-6, Feb 2008. DOI: 10.1126/science.1151458. PMID: 18292340.
- ↑ MF. Schmid, AM. Paredes, HA. Khant, F. Soyer i inni. Structure of Halothiobacillus neapolitanus carboxysomes by cryo-electron tomography.. „J Mol Biol”. 364 (3), s. 526-35, Dec 2006. DOI: 10.1016/j.jmb.2006.09.024. PMID: 17028023.
- ↑ CV. Iancu, HJ. Ding, DM. Morris, DP. Dias i inni. The structure of isolated Synechococcus strain WH8102 carboxysomes as revealed by electron cryotomography.. „J Mol Biol”. 372 (3), s. 764-73, Sep 2007. DOI: 10.1016/j.jmb.2007.06.059. PMID: 17669419.
- ↑ BB. Menon, Z. Dou, S. Heinhorst, JM. Shively i inni. Halothiobacillus neapolitanus carboxysomes sequester heterologous and chimeric RubisCO species.. „PLoS One”. 3 (10), s. e3570, 2008. DOI: 10.1371/journal.pone.0003570. PMID: 18974784.