| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C9H10ClN5O2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
255,66 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
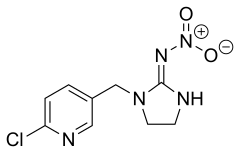
Imidaklopryd, imidakloprid – organiczny związek chemiczny z grupy związków heterocyklicznych; na jego szkielet składa się pierścień pirydynowy i imidazolinowy połączone mostkiem metylenowym, co czyni go podobnym strukturalnie do nikotyny[5]. Jest insektycydem ogólnoustrojowym z grupy neonikotynoidów. Zakłóca działanie transmisji bodźców w układzie nerwowym owadów. Powoduje blokadę receptorów nikotynowych, prowadząc do akumulacji acetylocholiny, ważnego neuroprzekaźnika, co skutkuje paraliżem lub śmiercią owada. Środek działa przez kontakt bezpośredni i drogą pokarmową. Wiąże znacznie silniej receptory nerwowe owadów niż ssaków, jest więc bardziej toksyczny dla owadów niż dla ssaków[6] (w przeciwieństwie do nikotyny[5]). Jest najszerzej używanym środkiem owadobójczym na świecie według danych sprzed 1999 roku[7].
Chociaż związek ten nie jest już chroniony patentem, jego największym producentem jest Bayer CropScience (część Bayer AG). Środek ten jest sprzedawany pod wieloma nazwami jako produkt do różnych zastosowań: może być wtłaczany do gruntu lub w strukturę drzewa, rozprowadzany na rośliny albo rozpylany na liście[8][6].
Imidaklopryd jest szeroko stosowany do zwalczania szkodników w rolnictwie. Używany jest również jako środek zabezpieczający fundamenty przed zniszczeniami spowodowanymi przez termity, zwalczania szkodników w ogrodach i darniny, w środkach owadobójczych dla zwierząt domowych (przeciw pchłom) i w ochronie drzew przed szkodnikami niszczącymi drewno[9].
Aktualne badania sugerują, że szerokie użycie imidakloprydu i innych pestycydów w rolnictwie mogą przyczyniać się do masowego ginięcia pszczół, spadku liczby pszczół obserwowanego w Europie i Ameryce Północnej od 2006[10][11][12].
W styczniu 2013 Europejski Urząd ds. Bezpieczeństwa Żywności oświadczył, że neonikotynoidy stwarzają nadzwyczajnie wysokie ryzyko dla pszczół i również, że badania sponsorowane przez przemysł chemiczny potwierdzające nieszkodliwość tych produktów, na podstawie których organy regulacyjne się opierały mogą być błędne. Europejski Urząd ds. Bezpieczeństwa Żywności wnioskuje „Wysokie i ostre ryzyko dla pszczół zostało zidentyfikowane w przypadku ekspozycji na pyłek przeniesiony z powłok nasion kukurydzy, rzepaku i zbóż. Wysokie i ostre ryzyko dla pszczół zostało również stwierdzone w wypadku wystawienia na działanie pozostałości w nektarze i/lub pyłku”. Autor opracowania dla Science zasugerował, że badania prowadzone przez koncerny mogły być celowo mylące[13][14].
Dozwolone stosowanie
Imidaklopryd jest najbardziej powszechnie stosowanym insektycydem na świecie.
- Rolnictwo – zwalczanie szkodników: mszyce, wciornastki[15], owady tarczówkowate i inne owady uszkadzające rośliny uprawne
- Leśnictwo – zwalczanie szkodników takich jak: Agrilus planipennis i innych owadów niszczących drzewa (m.in. choiny, klony, dęby, brzozy)[9]
- Ochrona domów – zwalczanie termitów, mrówek, karaczanów i owadów wilgociolubnych
- Zwierzęta domowe – zwalczanie pcheł
- Ochrona darniny – zwalczanie larw Popillia japonica
- Ogrodnictwo – zwalczanie mszyc i innych szkodników
W razie użycia na roślinach imidaklopryd, działający ogólnoustrojowo, jest wchłaniany przez korzenie i powoli przemieszcza się w górę rośliny przez ksylem.
Zastosowanie w ochronie drzew
W przypadku zastosowania na drzewach, może minąć od 30 do 60 dni (w zależności od ich rozmiaru i wysokości) do osiągnięcia skutecznego stężenia w liściach. Imidaklopryd dostaje się do pni, gałęzi, liści i nasion. W niewielkich ilościach może być znajdowany w kwiatach. Niektóre gatunki drzew owocowych, lipy, surmie lub robinie, są wiatropylne i dodatkowo zapylane przez pszczoły, co stwarza potencjalne ryzyko dla tych owadów. W przypadku owadów niszczących drewno, stężenia imidakloprydu muszą być większe, dla osiągnięcia efektu ochronnego[9].
Mechanizm działania
Imidaklopryd jest ogólnoustrojowym pestycydem chloronikotynilowym, należącym do kategorii neonikotynoidów. Zakłóca przekazy nerwowe i nieodwracalnie blokuje receptory nikotynowe[16]. Jako pestycyd ogólnoustrojowy, imidaklopryd przemieszcza się łatwo w ksylemie roślin od gruntu do liści, owoców, pyłku i nektaru. Imidaklopryd wyróżnia doskonała zdolność przenikania przez nabłonek liścia do tkanek[17]. Ponieważ imidaklopryd jest skuteczny w bardzo niskich dawkach (nanogram i pikogram), może być stosowany w niższych stężeniach (np. 55–140 g/ha) niż inne pestycydy. Dostępność imidakloprydu i jego niższa toksyczność w porównaniu do innych środków dostępnych w latach 90. w Stanach Zjednoczonych pozwoliła zastąpić nim bardziej toksyczne pestycydy, takie jak inhibitory acetylocholiesterazy, związki fosforoorganiczne i metylokarbaminiany[18][19].
Wpływ na środowisko
Imidaklopryd jest usuwany ze środowiska poprzez fotolizę (okres półrozpadu = 1–4 godz.) i wchłanianie przez rośliny. Końcowym produktem rozkładu przy udziale światła są: kwas chloronikotynowy i dwutlenek węgla. Imidaklopryd ma niskie ciśnienie parowania i nie ulatnia się łatwo do atmosfery. Szybko rozpada się w wodzie przy udziale światła, lecz jest on trwały w wypadku braku dostępu do światła[20]. W ciemności, w środowisku o pH pomiędzy 5 a 7, rozpada się bardzo powoli, a w warunkach pH 9 okres półrozpadu wynosi około roku. W glebie i w warunkach tlenowych jest trwały, z okresem półrozpadu około 1–3 lat[16].
Imidaklopryd jest niestabilny, szybko się rozkłada w wodzie i pod wpływem światła. Bez dostępu do światła rozpada się powoli. Potencjalnie, może pozostawać w wodzie gruntowej przez dłuższy okres. W badaniach wód gruntowych nie był zwykle obecny. Jeśli był on wykrywany to w bardzo niskich ilościach, zwykle w stężeniach niższych niż 1 części ma miliard (ppb). Maksymalna odnotowana wartość to 7 ppb (7 części na miliard), która jest poniżej poziomu zagrożenia dla ludzkiego zdrowia. Wykrycia miały zazwyczaj miejsce w strefach o porowatym bądź piaszczystym gruncie, z małą zawartością cząstek organicznych, gdzie ryzyko wymywania jest wysokie – i/bądź gdzie poziom wód gruntowych jest bliski powierzchni[21].
Zgodnie ze standardami Ministerstwa Ochrony Środowiska Kanady należyte stosowanie produktu (np. respektując dawki, bez używania irygacji i w przypadkach kiedy intensywne opady deszczu nie są prognozowane), imidaklopryd nie przedostaje się do głębszych warstw gruntu pomimo swojej wysokiej rozpuszczalności w wodzie (Rouchaud et al. 1994; Tomlin 2000; Krohn and Hellpointner 2002)[16]. W serii prób na polach przeprowadzonych przez Rouchaud et al. (1994, 1996), w których imidaklopryd był stosowany na poletkach buraka cukrowego, dowiedziono, że nie wystąpiło wymycie do wierzchniej warstwy gruntu. Imidaklopryd był stosowany na polu kukurydzy w Minnesocie i nie odnaleziono żadnych pozostałości w próbkach głębszych niż 15,2 cm (Rice et al. 1991, tak jak w Mulye 1995)[16]. Imidaklopryd ma wysoką zdolność przenikania do wód powierzchniowych i gruntowych. Tym samym, w.w. agencje rządowe ostrzegają przed stosowaniem produktu w strefach o przemakalnym gruncie i w których woda gruntowa znajduje się płytko[16].
Badania wód na obszarach gdzie używany był imidaklopryd wskazały na jego obecność w 89% próbek w stężeniach 0,1–3,2 µg/l. 19% próbek przekroczyło próg toksyczności przewlekłej dla wodnych organizmów bezkręgowych wynoszący 1,05 µg/L. Autorzy wskazują, że kanadyjskie i europejskie wytyczne są znacznie niższe (odpowiednio 0,23 µg/l i 0,067 µg/l) i byłyby przekroczone w odpowiednio 73% i 83% próbek wody z badań. Autorzy wnioskują, że „imidaklopryd często wydostaje się poza obszar stosowania i zanieczyszcza wody powierzchniowe w stężeniach, które mogą zagrażać wodnym organizmom bezkręgowym”[22].
Toksykologia
Na podstawie badań laboratoryjnych imidaklopryd został uznany za „średnio toksyczny” dla ssaków w przypadku wchłonięcia doustnego i nisko toksyczny przez kontakt skórny. Został również uznany za prawdopodobnie nierakotwórczy i słabo mutagenny[23]. Maksymalny próg tolerowany w żywności waha się od 0,02 mg/kg dla jaj do 3,0 mg/kg dla chmielu. Toksyczność dla zwierząt jest słaba w przypadku kontaktu doustnego i niska w przypadku działania przez skórę[16].
Pszczoły i inne owady
Imidaklopryd to jeden z najbardziej toksycznych insektycydów dla pszczół. Toksyczność ostra doustna LD50 waha się od 0,005 µg/pszczołę do 0,007 µg/pszczołę, co czyni imidaklopryd bardziej trującym niż pestycydy fosforoorganiczne lub pyretroidy[24]. Toksyczność tej substancji różni się od innych insektycydów tym, że imidaklopryd jest znacznie bardziej toksyczny doustnie niż przez kontakt[25]. Imidaklopryd został po raz pierwszy użyty na szeroką skalę w Stanach Zjednoczonych w 1996.
W 2006 amerykańscy komercyjni pszczelarze odnotowali gwałtowny spadek ilości pszczół. Takie przypadki zdarzały się już wcześniej, jednakże tym razem, dorosłe osobniki opuszczały swoje roje. Naukowcy nazwali to zjawisko masowym ginięciem pszczół[26]. Badania pokazują, że pszczelarze z większości stanów byli dotknięci tym fenomenem. Chociaż nie ustalono jednej przyczyny powodującej masowe ginięcie pszczół, to Departament Rolnictwa Stanów Zjednoczonych w swoim raporcie stwierdził, że może być to syndrom powodowany przez różne współdziałające ze sobą czynniki[27]. Niektóre badania pokazują, że dawki subletalne imidakloprydu zwiększają podatność pszczół na choroby[28].
David Goulson (2012) z University of Stirling ukazał, że nawet nieznaczne stężenie imidakloprydu w badaniach laboratoryjnych i w szklarniach może się przekładać na znaczące objawy na polach. Roje pszczół spożywających ten pestycyd traciły 85% królowych, podwójnie wzrosła też liczba pszczół niepowracających z żeru[29].
Lu i inni (2012) pokazali, że są w stanie odtworzyć syndrom masowego ginięcia pszczół, podając dawki imidakloprydu mniejsze od śmiertelnych. Ule poddane działaniu tego pestycydu były opustoszałe. Autorzy wykluczają patogeny jako przyczynę[12].
W maju 2012 naukowcy z Uniwersytetu z San Diego opublikowali opracowanie ukazujące, że pszczoły wystawione na działanie małych dawek imidakloprydu wcześniej uznanych za bezpieczne stały się „wybredne” i jadały jedynie najsłodsze nektary, odmawiając tych mniej słodkich. Odkryto również, że pszczoły wystawione na działanie imidakloprydu wykonywały rzadziej taniec pszczół mający zwabić inne pszczoły z roju na żerowisko[30]. Badania Canadian Forest Service wskazały, że imidaklopryd stosowany na drzewach powoduje wolniejsze tempo rozkładu opadłych liści, na skutek oddziaływania na gatunki bezkręgowców, niebędące docelowymi dla tego pestycydu[31].
Badanie z 2012 dostarczyło dowodów, że działanie niższych niż śmiertelne dawek zawartych w syropie glukozo-fruktozowym, używanym do karmienia pszczół, gdy nie mają dostępu do żerowiska, powoduje symptomy masowego ginięcia pszczół 23 tygodnie od ekspozycji na ten pestycyd. Badacze zasugerowali, że „opóźniona śmiertelność pszczół spowodowana przez imidaklopryd zawarty w syropie glukozo-fruktozowym jest nowym i prawdopodobnym mechanizmem masowego ginięcia pszczół i powinna być potwierdzona w przyszłych badaniach”[32].
W styczniu 2013 Europejski Urząd do spraw Bezpieczeństwa Żywności uznał, że pestycydy z grupy neonikotynoidów stanowią wyższe niż akceptowalne ryzyko dla pszczół, a badania prowadzone uprzednio przez producentów środków ochrony roślin są obarczone błędami[13].
Ptaki
Ptaki poddane działaniu tego pestycydu objawiały ataksję, opadanie skrzydeł, nadpobudliwość, zmiany w fizjologii jelit i wątroby. W badaniu dot. toksyczności rozrodczej przepiór wirginijskich zaobserwowano zmniejszenie grubości skorupek jaj i spadek wagi dorosłych osobników w przypadku wartości 240 mg a.i./kg diety[16]. Według Europejskiego Urzędu ds. Bezpieczeństwa Żywności, imidaklopryd stwarza potencjalnie ostre ryzyko dla roślinożernych i owadożernych ptaków, jak i ssaków żywiących się ziarnem. Przewlekłe ryzyko nie zostało pewnie potwierdzone[16][19].
Gatunki wodne
Imidaklopryd wyróżnia wysoka toksyczność ostra dla bezkręgowców wodnych o wartości LD50 = 0,037–0,115 ppm. Jest on również wysoce toksyczny w sposób przewlekły, wpływając na rozwój i ruch. Toksyczność dla ryb jest relatywnie niska[15].
Rośliny
Wykazano, że imidaklopryd wycisza niektóre geny gatunków roślin odpowiadających za produkcję substancji ochronnych. W ten sposób używanie imidakloprydu jako insektycydu w rzeczywistości zwiększa ryzyko ataku szkodników[33].
Wpływ na zdrowie
Neonikotynoidy mogą działać szkodliwie na ludzkie zdrowie, w szczególności na rozwijający się mózg[34].
Zobacz też
Przypisy
- 1 2 Imidacloprid, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2013-03-17] (ang.).
- 1 2 3 4 Imidaklopryd. The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2013-03-17]. (ang.).[niewiarygodne źródło?]
- ↑ Imidachlopryd (nr 37894) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- 1 2 Imidaklopryd, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2015-03-28] (ang.).
- 1 2 Izuru Yamamoto: Nicotine to Nicotinoids: 1962 to 1997. W: Nicotinoid Insecticides and the Nicotinic Acetylcholine Receptor. Izuru Yamamoto, John E. Casida (red.). Tokyo: Springer Japan, 1999, s. 3–27. DOI: 10.1007/978-4-431-67933-2_1. ISBN 978-4-431-68011-6.
- 1 2 Imidacloprid: General Fact Sheet National Pesticide Information Center, data dostępu: 2020-03-15.
- ↑ Izuru Yamamoto, John E. Casida: Preface. W: Nicotinoid Insecticides and the Nicotinic Acetylcholine Receptor. Izuru Yamamoto, John E. Casida (red.). Tokyo: Springer Japan, 1999, s. v–vi. DOI: 10.1007/978-4-431-67933-2. ISBN 978-4-431-68011-6.
- ↑ Michele Anatra-Cordone, Patrick Durkin, Imidacloprid: Human Health and Ecological Risk Assessment. Final Report [online], USDA Forest Service, 28 grudnia 2005 [dostęp 2020-03-15] [zarchiwizowane z adresu 2018-09-20].
- 1 2 3 Herms DA, McCullough DG, Smitley DR, Sadof C, Williamson RC, Nixon PL: Insecticide options for protecting ash trees from emerald ash borer. North Central IPM Center Bulletin, 2009. [dostęp 2020-03-15]. (ang.).
- ↑ Pesticides linked to honeybee decline, „The Guardian”, 29.03.2012. Dostęp 2012-04-07.
- ↑ P.R. Whitehorn, S. O’Connor, F.L. Wackers, D. Goulson. Neonicotinoid Pesticide Reduces Bumble Bee Colony Growth and Queen Production. „Science”. 336 (6079), s. 351–352, 2012. DOI: 10.1126/science.1215025. PMID: 22461500.
- 1 2
 Chensheng Lu, K.M. Warchol, R.A. Callahan. In situ replication of honey bee colony collapse disorder. „Bulletin of Insectology”. 65 (1), s. 99–106, 2012. ISSN 1721-8861. [dostęp 2018-06-03].
Chensheng Lu, K.M. Warchol, R.A. Callahan. In situ replication of honey bee colony collapse disorder. „Bulletin of Insectology”. 65 (1), s. 99–106, 2012. ISSN 1721-8861. [dostęp 2018-06-03]. - 1 2 Conclusion on the peer review of the pesticide risk assessment for bees for the active substance clothianidin, „EFSA Journal”, 11 (1), 2013, DOI: 10.2903/j.efsa.2013.3066, art. ID 3066 (ang.).
- ↑ Damian Carrington „Insecticide ‘unacceptable’ danger to bees, report finds” „The Guardian”, 2013-01-16.
- 1 2 N.E. Federoff, Allen Vaughan, M.R. Barrett: Environmental Fate and Effects Division Problem Formulation for the Registration Review of Imidacloprid. US EPA, 2008-11-13.
- 1 2 3 4 5 6 7 8 Canadian Council of Ministers of the Environment: Canadian water quality guidelines: imidacloprid: scientific supporting document. Winnipeg, Man.: Canadian Council of Ministers of the Environment, 2007. ISBN 978-1-896997-71-1.
- ↑ Environmental Fate of Imidacloprid California Department of Pesticide Regulation 2006.
- ↑ Imidacloprid: Risk Characterization Document – Dietary and Drinking Water Exposure. California Environmental Protection Agency, 9 lutego 2006. [dostęp 2012-04-07].
- 1 2 Conclusion regarding the peer review of the pesticide risk assessment of the active substance imidacloprid, „EFSA Journal”, 6 (7), 2008, DOI: 10.2903/j.efsa.2008.148r (ang.).
- ↑ Francisco Flores-Céspedes i inni, Preparation and Characterization of Imidacloprid Lignin–Polyethylene Glycol Matrices Coated with Ethylcellulose, „Journal of Agricultural and Food Chemistry”, 60 (4), 2012, s. 1042–1051, DOI: 10.1021/jf2037483 (ang.).
- ↑ Hahn, Jeffrey; Herms, Daniel A.; McCullough, Deborah G., Frequently Asked Questions Regarding Potential Side Effects of Systemic Insecticides Used To Control Emerald Ash Borer. University of Michigan Extension, Michigan State University, The Ohio State University Extension 2011.
- ↑ Keith Starner, Kean S. Goh. Detections of Imidacloprid in Surface Waters of Three Agricultural Regions of California, USA, 2010–2011. „Bulletin of Environmental Contamination and Toxicology”. 88, s. 316–321, 2012. DOI: 10.1007/s00128-011-0515-5.
- ↑ Endocrine Disruptor Screening Program: Tier 1 Screening Order Issuing Announcement. Federal Register Notice, Oct 21, 2009. Vol. 74, No. 202, s. 54422–54428.
- ↑ Séverine Suchail, David Guez, Luc P. Belzunces. Discrepancy between acute and chronic toxicity induced by imidacloprid and its metabolites in Apis mellifera. „Environmental Toxicology and Chemistry”. 20 (11), s. 2482–2486, 2001. DOI: 10.1002/etc.5620201113.
- ↑ Séverine Suchail, David Guez, Luc P. Belzunces. Characteristics of imidacloprid toxicity in two Apis mellifera subspecies. „Environmental Toxicology and Chemistry”. 19, s. 1901–1905, 2000. DOI: 10.1002/etc.5620190726.
- ↑ Honey Bee Colony Collapse Disorder Congressional Research Service.
- ↑ USDA Agriculture Research Service: USDA Colony Collapse Disorder Progress Report. 2010. [dostęp 2012-04-07].
- ↑ Cédric i in. Alaux. Interactions between Nosema microspores and a neonicotinoid weaken honeybees (Apis mellifera). „Environmental Microbiology”. 12 (3), s. 774–782, 2010. DOI: 10.1111/j.1462-2920.2009.02123.x.
- ↑ Dave Goulson i in., Neonicotinoid Pesticide Reduces Bumble Bee Colony Growth and Queen Production, „Science” 20 kwietnia 2012, 336, 6079, s. 351, 352, DOI: 10.1126/science.1215025.
- ↑ Kim McDonald: Commonly Used Pesticide Turns Honey Bees Into ‘Picky Eaters’. UC San Diego News Center. [dostęp 2020-03-15]. [zarchiwizowane z tego adresu (2013-05-09)].
- ↑ D.P. Kreutzweiser, D.G. Thompson, T.A. Scarr. Imidacloprid in leaves from systemically treated trees may inhibit litter breakdown by non-target invertebrates. „Ecotoxicol Environ Saf”. 72 (4), s. 1053–1057, 2009. DOI: 10.1016/j.ecoenv.2008.09.017.
- ↑ Pesticide tied to bee colony collapse. news.harvard.edu. [dostęp 2012-05-24].
- ↑ Yao Cheng i inni, Possible connection between imidacloprid-induced changes in rice gene transcription profiles and susceptibility to the brown plant hopper Nilaparvata lugens Stål (Hemiptera: Delphacidae), „Pesticide Biochemistry and Physiology”, 102 (3), 2012, s. 213–219, DOI: 10.1016/j.pestbp.2012.01.003, PMID: 22544984, PMCID: PMC3334832.
- ↑ Junko Kimura-Kuroda i inni, Nicotine-like effects of the neonicotinoid insecticides acetamiprid and imidacloprid on cerebellar neurons from neonatal rats, „PLoS One”, 7 (2), 2012, DOI: 10.1371/journal.pone.0032432, PMID: 22393406, PMCID: PMC3290564, art. ID: e32432.
Linki zewnętrzne
- Pesticide Information Profile [online], Extension Toxicology Network [dostęp 2018-06-03] (ang.).
- Breakdown Chart of Imidacloprid forming toxic 2-chloro pyridine en [online], The Coalition for a Healthy Ottawa [zarchiwizowane z adresu 2017-02-02] (ang.).
- Imidacloprid Fact Sheet [online], Sierra Club of Canada [zarchiwizowane z adresu 2014-10-07] (ang.).
- Bayer’s „Expert Overview” [online], www.beekeeping.com [zarchiwizowane z adresu 2010-12-06] (ang.).