| Gastritis hypertrophica | |
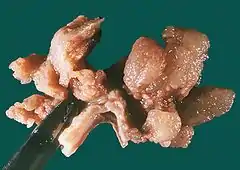 Obraz hiperplazji fałdów błony śluzowe żołądka w przebiegu choroby Ménétriera. Warstwa mięśniowa błony to wygięta struktura widoczna w środku i na dole, obok miejsca uchwytu narzędzia | |
| Klasyfikacje | |
| ICD-10 |
K29.6 |
|---|---|
| DiseasesDB | |
| OMIM | |
| MeSH | |
Zapalenie żołądka przerostowe (choroba Ménétriera; ang. giant hypertrophic gastritis) – nadmierny przerost części komórek błony śluzowej żołądka prowadzący do wykształcenia się olbrzymich fałdów śluzówki zwłaszcza w obrębie dna i trzonu.
Została opisana po raz pierwszy w 1888 roku przez francuskiego patologa Pierre'a Ménétriera.
Epidemiologia
Jest to bardzo rzadka choroba: fakt jej umieszczenia w bazie danych Biura Badań nad Chorobami Rzadkimi (ang. Office of Rare Diseases Research) Narodowych Instytutów Zdrowia USA oznacza, że występuje ona rzadziej niż raz na 200 000 mieszkańców[1]. Średni wiek zachorowania wśród dorosłych to 55 lat. Mężczyźni chorują częściej od kobiet. Choroba Ménétriera ma charakter przewlekły i postępujący. Zwiększa ona prawdopodobnie ryzyko zachorowania na raka żołądka, ale wielkość tego ryzyka nie jest dokładnie określona[2].
Postać choroby Ménétriera spotykana u dzieci wiązana jest z zakażeniem cytomegalowirusem. W tej grupie występuje ona zwykle przed 10 rokiem życia (średnia wieku: 5,5 roku), trzykrotnie częściej u chłopców niż u dziewcząt[3]. Zwykle ustępuje samoistnie.
Przyczyny
U dorosłych rozwój choroby Ménétriera wiąże się z nadmierną ekspresją czynnika wzrostu TGF-α, który poprzez pobudzanie receptorowych kinaz tyrozynowych (ang. Receptor Tyrosine Kinases, RTKs), a konkretnie jednej z nich - receptora nabłonkowego czynnika wzrostu (ang. Epithelial Growth Factor Receptor, EGFR), doprowadza do rozrostu komórek śluzowych oraz spadku liczby komórek okładzinowych żołądka. Towarzyszy temu zwiększone wytwarzanie śluzu oraz utrata białka. W przebiegu choroby Ménétriera nie obserwuje się wzrostu liczby bądź aktywności RTKs[4].
W dziecięcej postaci choroby Ménétriera, objawiającej się zwykle jako obrzęki obwodowe, które ustępują samoistnie w ciągu 2-4 tygodni od jej początku, czynnikiem wywołującym jest prawdopodobnie zakażenie cytomegalowirusem. Według jednej z hipotez niektóre białka powierzchni kapsydu wirusa są ligandem dla EGFR i wywołują pobudzenie receptora, analogicznie jak jego połączenie z TGF-α[5]. Wraz z wygasaniem infekcji zanika czynnik stymulujący EGFR i dlatego dziecięca postać choroby Ménétriera ma mieć charakter przemijający.
Objawy
Choroba przebiega z bólem nadbrzusza pojawiającym się po posiłku, nudnościami i wymiotami oraz biegunką, a przy dłuższym przebiegu powoduje utratę masy ciała i wyniszczenia. Duża utrata białka wraz z wydzielanym przez żołądek śluzem (gastropatia wysiękowa z utratą białka) prowadzi do hipoalbuminemii objawiającej się jako obrzęki i przesięki do jam ciała. Częstym objawem choroby Ménétriera jest też niedokrwistość.
Rozpoznanie
Badania obrazowe i endoskopowe
Niegdyś, przed upowszechnieniem się panendoskopii, na rozpoznanie choroby Ménétriera naprowadzały wyniki badania radiologicznego żołądka z kontrastem wykazujące znaczne pogrubienie (ponad 10 mm szerokości w trzonie żołądka i ponad 5 mm w części odźwiernikowej) fałdów jego błony śluzowej. Fałdy te nie przebiegają, jak to jest typowo, wzdłuż długiej osi żołądka, ale mają przebieg kręty. Zmiany takie obserwuje się głównie w trzonie, a w znacznie mniejszym nasileniu w części odźwiernikowej żołądka. W badaniu tomograficznym widoczne może być znaczne zwiększenie wysokości fałdów błony śluzowej dotyczące przede wszystkim trzonu żołądka oraz pogrubienie ściany żołądka[6].
Wziernikowanie żołądka u pacjenta z chorobą Ménétriera wykazuje znaczne zwiększenie wysokości i szerokości fałdów błony śluzowej żołądka, które nie zanikają pomimo rozdymania żołądka powietrzem (insuflacji). Wygląd tych fałdów kojarzy się z wyglądem zakrętów kory mózgu. Typowa jest obecność w żołądku dużej ilości gęstego śluzu. Wykonanie wziernikowania umożliwia pobranie wycinków błony śluzowej żołądka do badania patologicznego, które stanowi podstawę rozpoznania choroby. Ponieważ do badania mikroskopowego powinien być dostarczony wycinek pełnej grubości błony śluzowej niezbędne bywa zastosowanie specjalnych technik pobierania biopsji (np. z wykorzystaniem pętli drucianej)[7][8].

Badanie histopatologiczne
Typowy obraz mikroskopowy w chorobie Ménétriera obejmuje: 1. Rozrost dołeczkowy (łac. hyperplasia foveolaris; wydłużenie, kręty przebieg i torbielowate rozdęcie dołeczków żołądkowych ze wzrostem liczby komórek śluzowych oraz zmniejszeniem liczby komórek okładzinowych i głównych, pogrubienie blaszki mięśniowej błony śluzowej z wnikaniem pasm komórek mięśniowych gładkich w obręb blaszki właściwej); 2. Skąpy lub bardzo skąpy naciek zapalny. Ponieważ zmieniona śluzówka podatna jest na uszkodzenia, częste jest występowanie jej nadżerek będących przyczyną utraty krwi i, w konsekwencji, niedokrwistości. Zmiany takie stwierdzane są u wszystkich pacjentów w obrębie dna i trzonu żołądka, a u do 46% także w obrębie części odźwiernikowej[9].
Warunkiem wykonania pełnowartościowego badania histopatologicznego jest odpowiednia jakość pobranego wycinka - powinien on obejmować całą grubość błony śluzowej, co jest trudne do osiągnięcia przy użyciu podczas wziernikowania standardowych narzędzi biopsyjnych (kleszczyków).
Różnicowanie
Choć obraz radiologiczny i endoskopowy zapalenia przerostowego żołądka jest bardzo charakterystyczny, nie jest ono jedyną chorobą mogącą wywoływać podobne zmiany. Dlatego konieczne jest różnicowanie z innymi chorobami przebiegającymi z przerostem błony śluzowej żołądka, takimi jak jej zapalenie w przebiegu zakażeń (na przykład Helicobacter pylori, cytomegalowirus), choroby naciekowe (na przykład sarkoidoza, amyloidoza), zespół Zollingera-Ellisona, chłoniaki żołądka oraz - z uwagi na objawy postępującego wyniszczenia - z rakiem żołądka. Oprócz badania histopatologicznego pomocnym narzędziem w różnicowaniu choroby Ménétriera z powyższymi staniami może być ultrasonografia endoskopowa (EUS): dla choroby Ménétriera charakterystyczne jest występowanie pogrubienia jedynie drugiej warstwy ściany żołądka (odpowiadającej błonie śluzowej), podczas gdy w chorobach nowotworowych pogrubiałe mogą być także warstwy trzecia i czwarta[7].
Leczenie
Brak jest sposobu leczenia choroby Ménétriera o jednoznacznie udowodnionej skuteczności. Obiecujące wyniki przynosi stosowanie przeciwciał monoklonalnych wiążących się z EGFR i blokujących ten receptor – cetuksymabu[10]. W sytuacjach, gdy próby leczenia farmakologicznego zawodzą konieczne może się okazać częściowe wycięcie żołądka.
Stosowanie H2-blokerów, inhibitorów pompy protonowej oraz glikokortykoidów jest nieskuteczne.
Przypisy
- ↑ Office of Rare Diseases Research 2015 ↓.
- ↑ Coffey i in. 2007 ↓, s. 70.
- ↑ Friedman i in. 2009 ↓, s. 298.
- ↑ Coffey i in. 2007 ↓, s. 73.
- ↑ Wang i in. 2003 ↓, s. 456-461.
- ↑ Friedman i in. 2009 ↓, s. 297-299.
- 1 2 DiMarino i Benjamin 2002 ↓, s. 446.
- ↑ Friedman i in. 2009 ↓, s. 299.
- ↑ Friedman i in. 2009 ↓, s. 300.
- ↑ Fiske i in. 2009 ↓, s. 1-18.
Bibliografia
- Robert J. Coffey, Mary Kay Washington, Christopher L. Corless, Michael C. Heinrich. Ménétrier disease and gastrointestinal stromal tumors: hyperproliferative disorders of the stomach. „Journal of Clinical Investigation”. 117 (1), 2007. DOI: 10.1172/JCI30491. [dostęp 2015-05-13]. (ang.).
- Anthony J. DiMarino, Stanley B. Benjamin: Gastrointestinal Disease. An Endoscopic Approach. Thorofare, NJ, USA: Slack Inc., 2002. ISBN 1-55642-511-2. (ang.).
- William H. Fiske i inni, Efficacy of Cetuximab in the Treatment of Ménétrier’s Disease, „Science Translational Medicine”, 8, 1, 2009, DOI: 10.1126/scitranslmed.3000320, PMID: 20368185, PMCID: PMC3638759 [dostęp 2015-05-13] (ang.).
- Joseph Friedman i inni, Best Cases from the AFIP: Ménétrier Disease, „RadioGraphy”, 1, 29, 2009, DOI: 10.1148/rg.291075216 [dostęp 2015-05-13] (ang.).
- Disease: Menetrier disease. Office of Rare Diseases Research. [dostęp 2015-05-13]. (ang.).
- X. Wang, S.M. Huong, M.L. Chiu, N. Raab-Traub i inni. Epidermal growth factor receptor is a cellular receptor for human cytomegalovirus. „Nature”. 424 (6947), 2003-07-24. DOI: 10.1038/nature01818. PMID: 12879076. (ang.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.