| |||||||||
| |||||||||
| Ogólne informacje | |||||||||
| Wzór sumaryczny |
SO2−4 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
96,06 g/mol | ||||||||
| Identyfikacja | |||||||||
| Numer CAS | |||||||||
| PubChem | |||||||||
| DrugBank | |||||||||
| |||||||||
| |||||||||
| |||||||||
| Podobne związki | |||||||||
| Podobne związki | |||||||||
Siarczany (nazwa systematyczna: tetraoksydosiarczany(2−); w systemie Stocka: siarczany(VI); daw. witriole[1] lub koperwasy[2]) – sole lub estry kwasu siarkowego.
Właściwości chemiczne
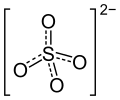
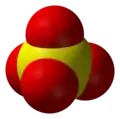
Jon siarczanowy to dwuujemny anion o wzorze empirycznym SO2−4 i masie cząsteczkowej 96,06 u. Składa się z jednego centralnego atomu siarki otoczonego przez cztery atomy tlenu, ma kształt czworościanu foremnego (tetraedru). Jon siarczanowy jest resztą kwasową kwasu siarkowego.
Wiele siarczanów jest dobrze rozpuszczalnych w wodzie. Do wyjątków należą np. siarczan wapnia, strontu, baru, ołowiu(II), srebra(I) i rtęci(I).
Pokrewne związki, wodorosiarczany, zawierają anion HSO4-.
Analiza jakościowa
Jony siarczanowe można wykryć w roztworach za pomocą strącania trudno rozpuszczalnych BaSO4 lub PbSO4. W związkach nierozpuszczalnych jon siarczanowy można wykryć za pomocą reakcji heparowej (daje pozytywny wynik dla wszystkich związków siarki)[3].
Zastosowania
Siarczany mają szerokie zastosowania:
- siarczan wapnia (gips) jest powszechnie stosowanym materiałem budowlanym
- siarczan magnezu ma właściwości higroskopijne i jest wykorzystywany jako przemysłowy środek suszący
- siarczan miedzi stosuje się w galwanotechnice
- siarczan dimetylu – ester kwasu siarkowego i metanolu, silny czynnik metylujący, wykorzystywany w preparatyce organicznej
Siarczany w mineralogii
Minerały tworzące gromadę siarczanów powstają w niskich temperaturach w środowiskach utleniających. Przeważnie są produktami procesów hipergenicznych, zwłaszcza ewaporacji wód morskich i jeziornych. Wiele siarczanów metali ciężkich tworzy się w strefie utleniania kruszców. Niektóre z nich jako produkty działalności hydrotermalnej powstają w niskich temperaturach. Przeważnie są bezbarwne, lecz niektóre z nich, zwłaszcza siarczany metali ciężkich, odznaczają się żywym zabarwieniem. Przeważnie są przezroczyste. Cechuje je niewielka twardość, która w nielicznych tylko przypadkach osiąga 3,5 w skali Mohsa. Wiele z nich cechuje się dobrą rozpuszczalnością w wodzie, dotyczy to szczególnie siarczanów metali jedno- i dwuwartościowych o małych promieniach jonowych np. Na+ i Mg2+. Przy ich rozpoznawaniu najczęściej używa się metod termicznych (DTA, TG, DTG), przydatne są także metody rentgenostrukturalne oraz spektroskopia w podczerwieni.
Klasyfikacja
Ze względu na skład chemiczny wyróżnia się pięć klas siarczanów:
- Klasa 1. Kwaśne siarczany: np. matteucyt NaHSO4·H2O, mercallit KHSO4
- Klasa 2. Siarczany bezwodne: np. anhydryt CaSO4, celestyn SrSO4, baryt BaSO4
- Klasa 3. Siarczany bezwodne zawierające inny anion: np. brochantyt Cu4[(OH)4SO4], jarosyt KFe3[(OH)6(SO4)2]
- Klasa 4. Siarczany uwodnione: np. kizeryt MgSO4·H2O, gips CaSO4·2H2O, chalkantyt CuSO4·5H2O, melanteryt FeSO4·7H2O
- Klasa 5. Siarczany uwodnione zawierające inny anion: np. copiapit (FeII,Mg)FeIII4[OH(SO4)3]2·20H2O
Przypisy
- ↑ Witold Doroszewski (red.): witriol. Słownik języka polskiego PWN, 1958–1969. [dostęp 2013-07-26].
- ↑ Witold Doroszewski (red.): koperwas. Słownik języka polskiego PWN, 1958–1969. [dostęp 2013-07-26].
- ↑ J. Minczewski, Z. Marczenko: Chemia Analityczna. Część 1: Podstawy teoretyczne i analiza jakościowa. Warszawa: Wydawnictwo Naukowe PWN, 2001, s. 325, 341-342. ISBN 83-01-13499-2.