| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C9H12 | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
C6H3(CH3)3 | ||||||||||||||||||||||||||||||
| Masa molowa |
120,19 g/mol | ||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||
Mezytylen (1,3,5-trimetylobenzen), C6H3(CH3)3 – organiczny związek chemiczny z grupy węglowodorów aromatycznych. Jest trujący[1]. Jego izomerami są m.in. kumen (izopropylobenzen, Ph-iPr) i pseudokumen (1,2,4-trimetylobenzen).
Otrzymuje się go ze smoły węglowej lub syntetycznie przez polikondensację acetonu lub polimeryzację propynu[1].
Otrzymywanie
Mezytylen otrzymuje się przemysłowo przez izolację z produktów krakingu i reformingu ropy naftowej, a także ze smoły pogazowej. Można wytwarzać go także przez alkilowanie toluenu i ksylenu metodą Friedela-Craftsa oraz przez dysproporcjonowanie ksylenu w obecności chlorku glinu, AlCl
3[4]:
- 2C
6H
4(CH
3)
2 ⇌ C
6H
3(CH
3)
3 + C
6H
5CH
3
W skali laboratoryjnej można go otrzymać udoskonaloną metodą Kane'a[5] przez dehydratację acetonu[6]:
| 3(CH 3) 2CO → C 6H 3(CH 3) 3 + 3H 2O |
(<10 °C, w obecności stęż. H 2SO 4) |
Zastosowanie
Mezytylen jest stosowany głównie do otrzymywania 2,4,6-trimetyloaniliny (mezydyny; służącej z kolei do produkcji barwników). Powstaje ona w wyniku selektywnego mononitrowania mezytylenu w specjalnych warunkach, np. w niskiej temperaturze i w obecności acetonitrylu oraz kwasu sulfaminowego[7].
Reakcje
molybdenum_tricarbonyl.png.webp)
Utlenianie mezytylenu rozcieńczonym kwasem azotowym daje kwas trimezynowy C
6H
3(COOH)
3[4].
Łatwo ulega bromowaniu, dając bromomezytylen[8]:
- (CH
3)
3C
6H
3 + Br
2 → (CH
3)
3C
6H
2Br + HBr
Mezytylen może być ligandem w związkach metaloorganicznych, jednym z przykładów jest kompleks [(η
6-C
6H
3Me
3)Mo(CO)
3][9], który można otrzymać w reakcji ksylenu z heksakarbonylkiem molibdenu.
Historia
Mezytylen został po raz pierwszy otrzymany w 1837 r. przez irlandzkiego chemika Roberta Kane'a przez ogrzewanie acetonu ze stężonym kwasem siarkowym[10][11][5]. Źródłem nazwy „mezytylen” były prace niemieckiego chemika Carla Reichenbacha, który nazywał aceton „mesit” (od greckiego μεσίτης, mediator), ze względu na jego właściwości, które oceniał jako lokujące się pomiędzy etanolem a eterem dietylowym. Kane z kolei uważał, że aceton jest alkoholem i określał go jako mesitic alcohol („alkohol mezytowy”). Sądził przy tym, że w reakcji z kwasem siarkowym nastąpiło odwodnienie alkoholu mezytowego i powstanie alkenu, „mezytylenu”[11][uwaga 1]. Wzór empiryczny mezytylenu określony przez Kane'a jako C
6H
4[5] był błędny, podobnie jak C
18H
12, podany przez Augusta von Hofmanna w lutym 1849 r.[13]. Prawidłowy wzór sumaryczny C
9H
12 ustalił w 1866 r. Adolf von Baeyer, jednak zaproponował dla niego błędną strukturę tetracyklo[3.1.1.11,3.13,5]nonanu[14]. Strukturę mezytylenu jako trimetylobenzenu przedstawił Albert Ladenburg w 1874 r., jednak przyjmując zaproponowaną przez siebie błędną budowę benzenu jako pryzmanu[15].
- Historyczne struktury mezytylenu
![Budowa mezytylenu wg Bayera (tetracyklo[3.1.1.11,3.13,5]nonan)](../I/Mesitylen_by_Adolf_von_Baeyer.png.webp) Budowa mezytylenu wg Bayera (tetracyklo[3.1.1.11,3.13,5]nonan)
Budowa mezytylenu wg Bayera (tetracyklo[3.1.1.11,3.13,5]nonan)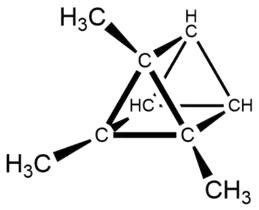 Budowa mezytylenu wg Ladenburga (1,2,6-trimetylopryzman)
Budowa mezytylenu wg Ladenburga (1,2,6-trimetylopryzman)
Bezpieczeństwo i środowisko
Mezytylen jest również głównym miejskim lotnym związkiem organicznym (LZO), który powstaje w wyniku spalania. Odgrywa znaczącą rolę w tworzeniu aerozolu i ozonu troposferycznego oraz innych reakcjach w chemii atmosfery.
Identyfikacja
Uwagi
- ↑ Analogicznie np. przez odwodnienie alkoholu etylowego stężonym kwasem siarkowym powstaje etylen, związek z grupy alkenów[12].
Przypisy
- 1 2 3 Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 418, ISBN 83-7183-240-0.
- 1 2 3 4 5 6 7 8 Mesitylene, [w:] PubChem, United States National Library of Medicine, CID: 7947 [dostęp 2022-08-12] (ang.).
- 1 2 3 David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 3-504, ISBN 978-1-4200-9084-0 (ang.).
- 1 2 Karl Griesbaum i inni, Hydrocarbons, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 29–30, DOI: 10.1002/14356007.a13_227 (ang.).
- 1 2 3 Robert Kane, On a Series of Combinations Derived from Pyroacetic Spirit, „The Transactions of the Royal Irish Academy”, 18, 1839, s. 99–125, JSTOR: 30078978 [dostęp 2022-08-12] (ang.).
- ↑ Roger Adams, R.W. Hufferd, Mesitylene, „Organic Syntheses”, 2, 1922, s. 41, DOI: 10.15227/orgsyn.002.0041 (ang.).
- ↑ Gerald Booth, Nitro Compounds, Aromatic, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 16, DOI: 10.1002/14356007.a17_411 (ang.).
- ↑ Bromomesitylene, „Organic Syntheses”, 11, 1931, s. 24, DOI: 10.15227/orgsyn.011.0024.
- ↑ Gregory S. Girolami i inni, Synthesis and technique in inorganic chemistry. A laboratory manual, wyd. 3, Sausalito, Calif.: University Science Books, 1999, s. 165–166, ISBN 0-935702-48-2, OCLC 38495269 [dostęp 2022-08-11].
- ↑ Brian B. Kelham, Kane, Robert John [online], www.encyclopedia.com [dostęp 2022-08-12].
- 1 2 Mel Gorman, The History of Acetone, 1600-1850, „Chymia”, 8, 1962, s. 97–104, DOI: 10.2307/27757220, JSTOR: 27757220 (ang.).
- ↑ Robert T. Morrison, Robert N. Boyd, Chemia organiczna, t. 1, Warszawa: PWN, 1985, s. 211, ISBN 83-01-04166-8.
- ↑ A.W. Hofmann, On the composition of mesitilole, and some of its derivatives, „Quarterly Journal of the Chemical Society of London”, 2 (2), 1850, s. 104–115, DOI: 10.1039/QJ8500200104 [dostęp 2022-08-12] (ang.). Uwaga: Hofmann przyjął masę atomową węgla 6, w efekcie czego podwoił w swoim wzorze liczbę jego atomów. Po podstawieniu prawwidłowej masy atomowej = 12, otrzymuje się poprawny wzór C
9H
12. - ↑ Adolf Baeyer, Ueber die Condensationsproducte des Acetons, „Annalen der Chemie und Pharmacie”, 140 (3), 1866, s. 297–306, DOI: 10.1002/jlac.18661400307 [dostęp 2022-08-12] (niem.).
- ↑ A. Ladenburg, Ueber das Mesitylen, „Berichte der deutschen chemischen Gesellschaft”, 7 (2), 1874, s. 1133–1137, DOI: 10.1002/cber.18740070261 (ang.).
