| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny |
CF3SO3H | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
TfOH | ||||||||||||||||||||||||
| Masa molowa |
150,08 g/mol | ||||||||||||||||||||||||
| Wygląd |
bezbarwna ciecz | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
Kwas trifluorometanosulfonowy, kwas triflowy, CF
3SO
3H, TfOH – organiczny związek chemiczny, kwas o bardzo dużej mocy, zaliczany do superkwasów. Jego moc (H0 = −14,1) jest ok. 100 razy większa od mocy 100% kwasu siarkowego (H0 = −11,9)[3].
Po raz pierwszy został uzyskany w 1954 roku przez Haszeldine’a i Kidda w wyniku utleniania perhydrolem bis(trifluorometylotio)rtęci (CF
3S)
2Hg. Otrzymany surowy produkt wytrącono w postaci soli barowej, z której odzyskano wolny kwas triflowy działaniem stężonego kwasu siarkowego i stosując destylację pod zmniejszonym ciśnieniem. Wyjściowy związek rtęcioorganiczny uzyskano naświetlając ultrafioletem mieszaninę disiarczku bis(trifluorometylu) i rtęci[4][5]:
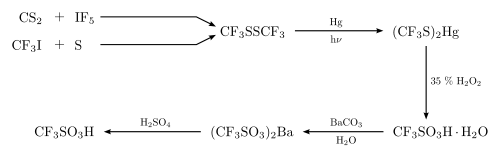 Syntesa TfOH
Syntesa TfOH
Grupa triflowa (CF
3SO
3–, TfO–) jest bardzo dobrą grupą odchodzącą[6], np. podczas substytucji nukleofilowej, co wykorzystywane jest m.in. w reakcji Suzukiego, reakcji Hecka lub polimeryzacji kationowej.
Grupa triflylowa (triflyl, CF
3SO
2−) jest standardowo oznaczana skrótem „Tf”[7], a grupa triflowa „TfO”. Kwasu triflowego (CF
3SO
3H, TfOH) nie należy mylić z kwasem trifluorooctowym (CF
3COOH; TFA), który również zawiera grupę trifluorometanową −CF
3.
Przypisy
- 1 2 3 4 5 Kwas trifluorometanosulfonowy, karta charakterystyki produktu Sigma-Aldrich, Merck, numer katalogowy: 347817 [dostęp 2014-03-05]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Elin Raamat i inni, Acidities of strong neutral Brønsted acids in different media, „Journal of Physical Organic Chemistry”, 26 (2), 2013, s. 162–170, DOI: 10.1002/poc.2946 (ang.).
- ↑ Witold Mizerski, Najmocniejsze kwasy [online], ChemFan (za Kurierem Chemicznym 3/92), 1992 [dostęp 2014-03-05].
- ↑ R.N. Haszeldine, J.M. Kidd, Perfluoroalkyl derivatives of sulphur. Part I. Trifluoromethanesulphonic acid, „Journal of the Chemical Society”, 1954, s. 4228–4232, DOI: 10.1039/JR9540004228 (ang.).
- ↑ R.D. Howells, J.D. Mc Cown, Trifluoromethanesulfonic acid and derivatives, „Chemical Reviews”, 77 (1), 1977, s. 69–92, DOI: 10.1021/cr60305a005 (ang.).
- ↑ Tah Mun Su, Wallace F. Sliwinski, Paul Von R. Schleyer, Solvolysis of highly unreactive substrates using the trifluoromethanesulfonate (triflate) leaving group, „Journal of the American Chemical Society”, 91 (19), 1969, s. 5386–5388, DOI: 10.1021/ja01047a035 (ang.).
- ↑ Standard Abbreviations and Acronyms [online], American Chemical Society [dostęp 2015-01-01] (ang.).
