| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
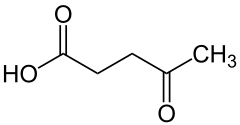
| Wzór sumaryczny |
C5H8O3 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
CH3-CO-CH2-CH2-COOH | ||||||||||||||||||||||||||||
| Masa molowa |
116,12 g/mol | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Pochodne aminowe | |||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
Kwas lewulinowy, kwas 4-oksowalerianowy – organiczny związek chemiczny, najprostszy γ-ketokwas karboksylowy. Jego sole i estry to lewuliniany.
Na skalę przemysłową może być otrzymywany z polisacharydów. Wykorzystywany jest jako substrat w syntezie organicznej dzięki zdolności do tworzenia pięcioczłonowych laktonów, laktamów i innych związków heterocyklicznych[4]. Stosowany jest też jako grupa ochronna dla grup hydroksylowych, która może być usuwana w praktycznie neutralnych warunkach za pomocą układu hydrazyna-kwas octowy[5][6]. Ester lewulinianowy tworzy z hydrazyną 4,5-dihydro-6-metylopirydazon, odtwarzając wolną grupę hydroksylową[7]:
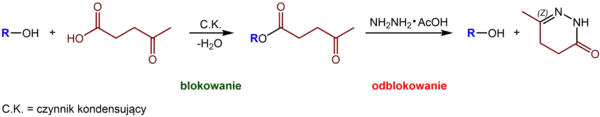
Podejście to opracowali w 1976 roku Jacques H. van Boom i Peter Burgers[8].
Przypisy
- 1 2 3 Kwas lewulinowy (nr L2009) w katalogu produktów Sigma-Aldrich (Merck). [dostęp 2018-12-31].
- 1 2 3 4 Lävulinsäure zur Synthese. Sicherheitsdatenblatt [online], Merck, 2018 [dostęp 2018-12-31] (niem.).
- 1 2 3 Laevulinic Acid, [w:] DrugBank, University of Alberta, DB02239 (ang.).
- ↑ Gene R. Petersen, Joseph J. Bozell, Technology development for the production of biobased products from biorefinery carbohydrates—the US Department of Energy’s “Top 10” revisited, „Green Chemistry”, 12 (4), 2010, s. 539–554, DOI: 10.1039/B922014C (ang.).
- ↑ J.H. van Boom, P.M.J. Burgers, Use of levulinic acid in the protection of oligonucleotides via the modified phosphotriester method: synthesis of decaribonucleotide U-A-U-A-U-A-U-A-U-A, „Tetrahedron Letters”, 17 (52), 1976, s. 4875–4878, DOI: 10.1016/S0040-4039(00)78935-0 (ang.).
- ↑ Tong Zhu, Geert-Jan Boons, A new set of orthogonal-protecting groups for oligosaccharide synthesis on a polymeric support, „Tetrahedron: Asymmetry”, 11 (1), 2000, s. 199–205, DOI: 10.1016/S0957-4166(99)00569-8 (ang.).
- ↑ R.L. Letsinger i inni, Oligonucleotide syntheses utilizing β-benzoylpropionyl, a blocking group with a trigger for selective cleavage, „Journal of the American Chemical Society”, 89 (26), 1967, s. 7146–7147, DOI: 10.1021/ja01002a074 (ang.).
- ↑ Philip Kocienski, Krzysztof Jarowicki, Protecting groups, „Contemporary Organic Synthesis”, 3 (5), 1996, s. 397–431, DOI: 10.1039/CO9960300397 (ang.).