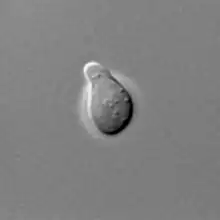
Koniugacja (ang. mating) drożdży to spotkanie się, a następnie fuzja dwóch haploidalnych komórek drożdżowych, na drodze której powstaje nowa komórka z podwojonym garniturem chromosomowym (diploid).
Saccharomyces cerevisiae to organizm jednokomórkowy występujący w swoim cyklu życiowym w postaci zarówno haploida, jak i diploida. Koniugacja zachodzi tylko pomiędzy haploidami przeciwnych typów koniugacyjnych i prowadzi do powstania diploida. Haploidy mogą występować jako dwa typy koniugacyjne (zwane także typami płciowymi, są to odpowiedniki płci): a lub α (alfa). Jest to jeden z najprostszych typów rozdzielności płciowej. Koniugacja, której następstwem jest rekombinacja genetyczna towarzysząca podziałom diploida, ma zapewnić zmienność genetyczną w obrębie populacji.
Typ koniugacyjny i cykl życiowy S. cerevisiae
Saccharomyces cerevisiae mogą występować zarówno jako stabilny haploid, jak i diploid. Obydwie formy mogą się rozmnażać bezpłciowo na drodze pączkowania po poprzedzającej je mitozie[1]. Typ koniugacyjny jest determinowany przez pojedynczy locus – MAT, który steruje zachowaniem płciowym zarówno haploidów, jak i diploidów. Haploidy są w stanie koniugować z innymi haploidami przeciwnego typu koniugacyjnego (płci). Komórka MAT a może koniugować tylko z MAT α i na odwrót. Wynikiem tego procesu jest powstanie diploida. Diploidy, zazwyczaj pod wpływem warunków stresowych, jak niedobór pożywienia[2], mogą przejść podział mejotyczny, której wynikiem będą cztery haploidalne spory: dwie typu a i dwie α. Typ płciowy drożdży nie jest stały; komórki mogą go zmieniać na drodze rekombinacji genetycznej[3].
Różnice pomiędzy typami, a i α
Komórki typu a produkują i wydzielają czynnik-a, feromon będący sygnałem płciowym dla komórek α[4]. Z kolei same komórki a są wrażliwe na analogiczny feromon α, wydzielany przez komórki typu MAT α[5], na który reagują wytworzeniem wypustki (ang. shmoo) w kierunku rosnącego gradientu stężenia feromonu. Tak samo na feromon a reagują komórki α[6]. Odpowiedź na feromon przeciwnego typu jest gwarancją koniugacji pomiędzy różnymi typami komórek.
Te różnice fenotypowe pomiędzy dwoma typami koniugacyjnymi drożdży są wynikiem aktywacji i represji różnego zestawu genów u każdego z nich. Typ a ma aktywne geny czynnika a oraz geny receptora powierzchniowego Ste2, który rozpoznaje i wiąże czynnik α[7], rozpoczynając kaskadę odpowiedzi komórkowej[8]. Typ a ma represorowane geny odpowiadające za bycie typem α. Analogicznie zachowuje się typ płciowy α, mając aktywne geny swojego czynnika i receptora czynnika a – Ste3[9], a zablokowane geny odpowiadające za typ a[10].
Różnice w zestawie aktywowanych i represorowanych genów, które charakteryzują typy a i α są wynikiem obecności jednego z dwóch alleli występującego na locus zwanym MAT. Allele mają nazwy odpowiednio MATa i MATα. MATa koduje parę genów: a1 i a2, które w haploidach kierują uruchomieniem programu dla typu a, a zablokowaniem drugiego typu. Analogicznie u α allel MATα koduje geny α1 i α2, które definiują ten typ.
Różnice pomiędzy haploidami i diploidami
Podobnie jak w przypadku różnic między haploidalnymi a i α, tak samo różne schematy aktywowania i represorowania genów decydują o fenotypowych różnicach pomiędzy diploidami a haploidami. Haploidy obu płci, prócz opisanych wcześniej mechanizmów różnicowania płciowego, mają aktywny także pewien zespół genów, charakterystycznych właśnie dla haploidów (jak gen HO), a represorowany zespół genów charakterystycznych dla diploidów (jak na przykład gen IME1). Analogiczne mechanizmy działają u diploidów, które z kolei mają zablokowane geny charakterystyczne dla haploidów, a aktywne dla diploidów.
Te różne tryby ekspresji genów u haploidów i diploidów ponownie są wynikiem działania locus MAT. Haploidy, z definicji posiadają tylko po jednym z pary chromosomów, a co za tym idzie po jednej odmianie allelicznej MAT (MATa lub MATα), co determinuje ich odmianę płciową, ale także odpowiada za aktywowanie transkrypcji genów charakterystycznych dla haploidów. Diploidy, będące efektem koniugacji haploidów, posiadają obydwie odmiany alleliczne MAT. Kombinacja informacji zakodowanej przez allele MATa (geny a1 i a2) oraz MATα (geny α1 i α2) aktywuje program transkrypcyjny charakterystyczny dla diploidów.
Allele obecne na locus MAT niosą wystarczającą informację, by zaprogramować odpowiednie zachowanie komórki. Przykładowo, technikami inżynierii genetycznej można wprowadzić allel MATa do haploidalnych komórek α. I pomimo faktu, że komórka ta będzie wciąż będzie miała haploidalny garnitur chromosomów, zachowywać się będzie jak diploid: nie będzie produkować, ani odpowiadać na feromony płciowe, a pod wpływem warunków stresowych będzie się starała wejść w mejozę, z negatywnym i śmiertelnym skutkiem. Analogicznie, delecja jednego z locus MAT u diploida, z pozostawieniem drugiego sprawnego, spowoduje, że taka komórka będzie się zachowywać jak haploid, tego typu, jakiego allel MAT pozostawiono nietknięty.
Koniugacja
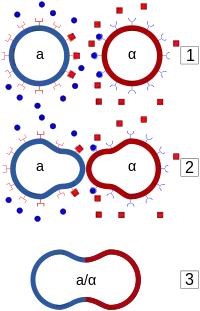
Proces koniugacji pomiędzy haploidami przeciwnych typów płciowych rozpoczyna się od wymiany sygnałów feromonowych. Feromony wiążą się z odpowiednimi receptorami na powierzchni błony komórkowej, które aktywują heterotrimeryczne białko G. Aktywne białko G rekrutuje do powierzchni błony, na szczyt shmoo stykających się komórek, kompleksy białkowe odpowiedzialne za postępujące procesy koniugacji. Wśród tych białek są m.in. białko Ste5 służące jako rusztowanie dla kompleksu i białka z rodziny kinaz MAP: Ste20 rozpoczynające kaskadę sygnałową oraz Ste11, Ste7 i Fus3. Ste20 rozpoczyna kaskadę fosforylacji, która postępuje przez Ste11, Ste7 do Fus3. Z kolei wśród substratów zaktywowanej w kaskadzie kinazy Fus3 znajdują się m.in. Far1, odpowiedzialne za zatrzymanie komórki w fazie G1 cyklu mitotycznego (koniugujące komórki nie mogą się dzielić w trakcie) oraz Ste12 – czynnik transkrypcyjny uruchamiający pozostałe geny związane z koniugacją. Po około 30 minutach koniugujące komórki wiążą się ze sobą, zaczynając od szczytów shmoo. Na tym etapie nazywa się je czasami prezygotą. Do fuzji komórek musi zostać zniesiona tymczasowo bariera ściany komórkowej. Jest ona remodelowana poprzez szereg zaktywowanych enzymów (m.in. tych, których ekspresja została uruchomiona przez Far1). Remodelowanie zaczyna się od połączenia ścian komórkowych koniugujących komórek, a następnie zostaje zdegradowany fragment ściany bezpośrednio oddzielający stykające się komórki. Na tym etapie, komórki drożdżowe z połączoną ścianą, która nie oddziela ich już od siebie i jest dla nich wspólna, i z błonami komórkowymi w bezpośrednim kontakcie, nazywa się późną prezygotą. Stykające się błony komórkowe, z pomocą czynników białkowych zaczynają się zlewać. Fuzja rozpoczyna się od powstania pora fuzyjnego, który następnie się rozszerza i utrzymywany w ścisłej kontroli doprowadza do połączenia się błon, i w rezultacie zlania się koniugujących komórek. Koniugacja kończy się fuzją haploidalnych jąder komórkowych i utworzeniem funkcjonalnego diploida[11].
Zmiana typu płciowego
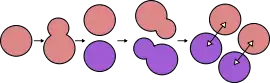
Dzikie szczepy haploidów mogą zmieniać swój typ płciowy[3]. W przypadku gdy jedna komórka drożdżowa jest protoplastką całej ich kolonii (jednej linii komórkowej), zmiana typu płciowego pozwala, by w takiej populacji obecne były oba typy płciowe (a nie jeden, odpowiadający typowi protoplasty). W połączeniu z silną predyspozycją haploidów do koniugacji i tworzeniu diploidów, oznacza to, że większość komórek takiej dzikiej kolonii będzie diploidami, niezależnie od tego czy komórka założycielska była diploidem czy haploidem. Z tego powodu, większość szczepów S. cerevisiae używanych do badań naukowych ma zablokowany mechanizm zmiany typu płciowego (przez delecję genu HO). Zapewnia to utrzymanie stabilnych genetycznie linii, które pozostaną haploidalne i określonej płci przez cały czas.
Wyciszone kasety koniugacyjne: HML i HMR

Zmiana typu płciowego drożdży poprzez polega na zamianie informacji genetycznej na locus MAT. Przykładowo, komórka typu a zmienia typ na α poprzez zamianę allelu MATa na MATα. Pomimo posiadania tylko jednego chromosomu, z jednym aktywnym miejscem MAT, jest to możliwe dzięki obecności dodatkowych, wyciszonych (transkrypcyjnie nieaktywnych) kopii zarówno MATa, jak i MATα: są to kasety HML (z ang. Hidden MAT Left – ukryty MAT lewy), zawierająca zwykle wyciszoną kopię allelu MATα oraz HMR (Hidden MAT right – ukryty MAT prawy), zawierająca wyciszony allel MATa. Obydwa te regiony HML i HMR określa się mianem wyciszonych kaset koniugacyjnych (silent mating cassettes)[13].
Te dodatkowe kopie informacji o typie płciowym w żaden sposób nie zakłócają żadnych funkcji życiowych, niezależnie jaki allel jest obecny na locus MAT. Wynika to z tego, że są one wyciszone i nie podlegają transkrypcji. Haploid typu a posiadający allel MATa na aktywnym transkrypcyjnie locus MAT, będzie się więc zachowywał jak a, mimo posiadania dodatkowych kopii (wyciszonych) alleli MAT w tym MATα w regionie HML. Tylko allel obecny w aktywnym miejscu MAT jest transkrybowany i tylko taki ma wpływ na zachowanie komórki.
Mechanizmy zmiany typu płciowego
Proces zmiany typu płciowego polega na podmianie genu inicjowanej przez inny gen: HO. Gen HO jest ściśle regulowanym genem charakterystycznym tylko dla haploidów, podlegającym aktywacji w fazie G1 cyklu komórkowego. Białko kodowane przez gen HO to endonukleaza DNA, która tnie nić DNA, ale specyficznie (patrz: enzym restrykcyjny), wycinając locus MAT[14]. Po wycięciu locus aktywują się egzonukleazy DNA, degradując wycięty kawałek od jego końców. W rezultacie w genomie powstaje przerwa po wyciętym locus MAT. Zostaje ona naprawiona poprzez wkopiowanie tam odpowiedniej sekwencji z kasety HML lub HMR, co skutkuje odtworzeniem allelu MAT odpowiedniej odmiany (zależnie od tego czy użyta została HML czy HMR). Wyciszone allele MATa i MAtα z regionów HML i HMR służą jako matryce do naprawy DNA, wyciętego przez endonukleazę kodowaną przez HO. Skopiowaniu i odtworzeniu podlega tylko jeden z alleli, który po wstawieniu w aktywne miejsce podlega normalnej transkrypcji, co owocuje zmianą typu płciowego komórki[15].
Kierunek zmiany typu płciowego
Z pewnej, wciąż nie do końca poznanej przyczyny, naprawa locus MAT po wycięciu przez endonukleazę HO prawie zawsze skutkuje zmianą typu płciowego. Kiedy komórka wycina allel MATa, wkopiowany w to miejsce zostaje prawie zawsze wyciszony allel z regionu HML, co pociąga za sobą zmianę typu na α. Analogiczna, ale odwrotna sytuacja ma miejsce w komórkach typu α[16]. Wiadomo, że tą zamianą steruje w jakiś sposób sekwencja zwana wzmacniaczem rekombinacji (Recombination Enhancer RE), położona około 17kpz od centromeru przy HML.
Przypisy
- ↑ von Meyenburg HK. [The budding cycle of Saccharomyces cerevisiae]. „Pathol Microbiol (Basel)”. 31. 2, s. 117–127, 1968. PMID: 5650638.
- ↑ Miller JJ, Calvin J, Tremaine JH. A study of certain factors influencing sporulation of Saccharomyces cerevisiae. „Can J Microbiol”. 1. 7, s. 560–573, 1955. PMID: 13250449.
- 1 2 Haber JE. Mating-type gene switching in Saccharomyces cerevisiae. „Annu Rev Genet”. 32, s. 561–599, 1998. PMID: 9928492.
- ↑ Betz R, Duntze W. Purification and partial characterization of a factor, a mating hormone produced by mating-type-a cells from Saccharomyces cerevisiae. „Eur J Biochem”. 95. 3, s. 469–475, 1979. PMID: 376312.
- ↑ Duntze W, Stotzler D, Bucking-Throm E, Kalbitzer S. Purification and partial characterization of -factor, a mating-type specific inhibitor of cell reproduction from Saccharomyces cerevisiae. „Eur J Biochem”. 35. 2, s. 357–365, 1973. PMID: 4577857.
- ↑ Tkacz JS, MacKay VL. Sexual conjugation in yeast. Cell surface changes in response to the action of mating hormones. „J Cell Biol”. 80. 2, s. 326–333, 1979. PMID: 379012.
- ↑ Burkholder AC, Hartwell LH. The yeast alpha-factor receptor: structural properties deduced from the sequence of the STE2 gene. „Nucleic Acids Res”. 13. 23, s. 8463–8475, 1985. PMID: 3001640.
- ↑ Konopka JB, Fields S. The pheromone signal pathway in Saccharomyces cerevisiae. „Antonie Van Leeuwenhoek”. 62. 1–2, s. 95–108, 1992. PMID: 1444339.
- ↑ Hagen DC, McCaffrey G, Sprague GF Jr. Evidence the yeast STE3 gene encodes a receptor for the peptide pheromone a factor: gene sequence and implications for the structure of the presumed receptor. „Proc Natl Acad Sci U S A”. 83. 5, s. 1418–1422, 1986. PMID: 3006051.
- ↑ Chenevert J, Valtz N, Herskowitz I. Identification of genes required for normal pheromone-induced cell polarization in Saccharomyces cerevisiae. „Genetics”. 136. 4, s. 1287–1296, 1994. PMID: 8013906.
- ↑ Jin H, McCaffery JM, Grote E. Ergosterol promotes pheromone signaling and plasma membrane fusion in mating yeast. „J Cell Biol”. Feb 25;180. 4, s. 813–826, 2008. PMID: 18299351.
- ↑ Klar AJ, McIndoo J, Hicks JB, Strathern JN. Precise mapping of the homothallism genes HML and HMR in Saccharomyces cerevisiae. „Genetics”. 96. 2, s. 315–320, 1980. PMID: 6790330.
- ↑ Hicks J, Strathern JN, Klar AJ. Transposable mating type genes in Saccharomyces cerevisiae. „Nature”. 282. 5738, s. 478–473, 1979. PMID: 388235.
- ↑ Strathern JN, Klar AJ, Hicks JB, Abraham JA, Ivy JM, Nasmyth KA, McGill C. Homothallic switching of yeast mating type cassettes is initiated by a double-stranded cut in the MAT locus. „Cell”. 31. 1, s. 183–192, 1982. PMID: 6297747.
- ↑ Wu X, Moore JK, Haber JE. Mechanism of MAT alpha donor preference during mating-type switching of Saccharomyces cerevisiae. „Mol Cell Biol”. 16. 2, s. 657–668, 1996. PMID: 8552094.
- ↑ Klar AJ, Hicks JB, Strathern JN. Directionality of yeast mating-type interconversion. „Cell”. 28. 3, s. 551–561, 1982. PMID: 7042099.
Linki zewnętrzne
- Locus MAT w Yeast Genome Database wraz z odnośnikami literaturowymi. db.yeastgenome.org. [zarchiwizowane z tego adresu (2007-10-23)].