Izocyjaniany – związki chemiczne zawierające ugrupowanie −N=C=O, w którym atomem wiążącym jest atom azotu. Mogą to być sole typu M−N=C=O (gdzie M to atom metalu) lub związki organiczne typu R−N=C=O (gdzie R to dowolna grupa organiczna, a ugrupowanie −N=C=O określa się jako grupę izocyjanianową).
Izocyjaniany są izomerami cyjanianów, zawierających ugrupowanie −O−C≡N oraz piorunianów, zawierających ugrupowanie −C≡N−O.
Izocyjaniany nieorganiczne
Izocyjaniany nieorganiczne otrzymywane są przez utlenianie cyjanków w wysokiej temperaturze. Są trwałe do temperatury czerwonego żaru. Powstają także obok cyjanków w reakcji cyjanu z mocnymi zasadami. W wodzie hydrolizują do amoniaku i dwutlenku węgla[1].
Termiczna przemiana izocyjanianu amonu (NH4OCN) w izomeryczny mocznik, której po raz pierwszy dokonał Friedrich Wöhler w 1828 roku, była pierwszą laboratoryjną syntezą związku organicznego i obaliła teorię siły życiowej (tzw. vis vitalis), obowiązującej do tego czasu w chemii organicznej[2][3].
Izocyjaniany organiczne
Niektóre izocyjaniany organiczne są bardzo reaktywnymi związkami chemicznymi, zdolnymi np. do wybuchowej reakcji z wodą, w której wydziela się dwutlenek węgla. Część izocyjanianów jest silnie toksyczna.
Synteza
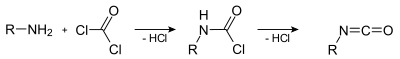
1) Podstawową metodą syntezy izocyjanianów jest reakcja aminy pierwszorzędowej z fosgenem:[4]
2) Ze względu na toksyczność fosgenu poszukiwano innych, bardziej bezpiecznych, metod syntezy izocyjanianów. Przykładem może być reakcja dwuetapowa z mocznikiem i następczą termolizą:
- R-NH2 + CO(NH2)2 → R-NH-CO-NH2 + NH3
- R-NH-CO-NH2→ R-NCO + NH3
3) Izocyjaniany są produktami pośrednimi w przegrupowaniu Hoffmanna, w którym pierwszorzędowe amidy reagują z podchlorynami lub podbrominami tworząc odpowiedni izocyjanian, który następnie hydrolizuje do odpowiedniej pierwszorzędowej aminy.
4) Ponadto izocyjaniany mogą powstawać w reakcji przegrupowania Curtiusa. Azydki acylowe R-(CO)-N3 rozpadają się z wydzieleniem gazowego azotu N2 tworząc nitreny, które podobnie jak karbeny są nietrwałe i ulegają przegrupowaniu do izocyjanianów[5].
Reakcje
1) W środowisku alkalicznym izocyjaniany ulegają hydrolizie, dając w wyniku aminę pierwszorzędową, oraz anion węglanowy. Reakcja przebiega zgodnie ze schematem:
- R-NCO + 2OH- → R-NH2 + CO2−3
2) Izocyjaniany aromatyczne w obecności wody ulegają hydrolizie z wydzieleniem dwutlenku węgla (reakcja jest zwykle silnie egzotermiczna):
- R-NCO + H2O → R-NH2 + CO2
Reakcja ta jest wykorzystywana przy spienianiu poliuretanów[6].
3) Izocyjaniany reagują z alkoholami i aminami, dając jako wynik odpowiednio uretany lub pochodne mocznika:
- R-NCO + 2 R'-OH → R-NH-CO-OR'
- R-NCO + 2 R'-NH2 → R-NH-CO-NHR'
Reakcja alkoholi i amin z izocyjanianami jest podstawową metodą otrzymywania poliuretanów. Substratami przy produkcji tych polimerów są di- i tri-izocyjaniany oraz diole lub rozbudowane oligomery z wieloma grupami hydroksylowymi, nazywanymi nie do końca poprawnie poliolami.
Znaczenie przemysłowe
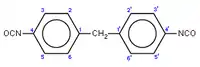
Kolorem niebieskim podana jest numeracja atomów węgla
Izocyjanian metylu (MIC, CH3−NCO) stosowany jest w produkcji pestycydów, jednak przeważająca część tych związków w przemyśle organicznym jest używana do produkcji tworzyw poliuretanowych. Globalny popyt na diizocyjaniany w 2000 roku wynosił 4,4 miliony ton w tym[7]:
- 61,3% diizocyjanian difenylometanu (MDI)
- 34,1% 2,4-diizocyjanianotoluen (TDI)
- 3,4% diizocyjanian heksametylenu (HDI) oraz diizocyjanian izoforonu (IPDI)
- 1,2% inne
Wszyscy główni producenci MDI oraz TDI są członkami Międzynarodowego Instytutu Izocyjanianów (International Isocyanate Institute), którego celem jest promowanie bezpiecznego stosowania MDI i TDI w zakładach pracy, jak również w środowisku naturalnym.
Zagrożenia
Reaktywność izocyjanianów czyni je szkodliwymi dla żywych tkanek. Są one trujące i wywołują alergiczne zapalenie pęcherzyków płucnych oraz tzw. astmę zawodową[8]. Obie te choroby powstają w wyniku inhalacji oraz kontaktu skórnego, dlatego powinno się unikać zarówno wdychania oparów jak i bezpośredniego kontaktu ze skórą[9].
ISOPA, Europejskie Stowarzyszenie Producentów Izocyjanianów i Polioli (European Diisocyanate and Polyol Producers Association) udostępnia informacje dla bezpiecznego stosowania izocyjanianów[10][11].
Informacje na temat stosowania, wyposażenia ochrony osobistej, transportu, przechowywania, pobierania próbek i analizy dla MDI i TDI, postępowanie w przypadku wypadku, informacje o środowisku i zdrowiu zostały szczegółowo podane[12].
Zobacz też
Przypisy
- ↑ Philip John Durrant, Bryl Durrant: Zarys współczesnej chemii nieorganicznej. Warszawa: PWN, 1965, s. 660, 662.
- ↑ A. E. Cziczibabin: Podstawy chemii organicznej. T. 1. Warszawa: PWN, 1957, s. 17.
- ↑ "Vis vitalis"Chemia organiczna. [dostęp 2010-03-30]. [zarchiwizowane z tego adresu (2006-05-28)].
- ↑ J. H. Saunders, R. J. Slocombe. The Chemistry of the Organic Isocyanates.. „Chem. Rev.”. 43, s. 203–218, 1948. DOI: 10.1021/cr60135a00103. (ang.).
- ↑ Jonathan Clayden, Nick Greeves, Stauart Warren, Peter Wothers: Organic Chemistry. New York: OXFORD University Press Inc., 2007, s. 1073. ISBN 978-0-19-850346-0.
- ↑ Paul Painter and Michael Coleman: Fundamentals of Polymer Science: An Introductory Text, Second Edition. Taylor & Francis, Inc., 1998, s. 39, seria: REV. ISBN 1-56676-559-5.
- ↑ Randall, D.: The Polyurethanes Book. Wiley, 2002. ISBN 0-470-85041-8.
- ↑ Lek. med. Krzysztof Karwat: Astma zawodowa. [dostęp 2010-03-29]. (pol.).
- ↑ Diller, W.F.. Medical phosgene problems and their possible solution. „Journal of Occupational Medicine”. 20, s. 189-193, 1978. ISSN 0096-1736. (ang.).
- ↑ ISOPA. [dostęp 2010-03-29]. [zarchiwizowane z tego adresu (2011-07-21)].
- ↑ Guidelines Handbook. [dostęp 2010-03-29]. [zarchiwizowane z tego adresu (2012-09-16)].
- ↑ D. C. Allport, D. S. Gilbert, S. M. Outterside: MDI and TDI: Safety, Health and the Environment: A Source Book and Practical Guide. Wiley, 2003. ISBN 978-0-471-95812-3.
Bibliografia
- "Izocyjaniany w syntezie polimerów" R.T. Morrison, R.N. Boyd: Chemia Organiczna. Warszawa: Wydawnictwo Naukowe PWN, 1997, s. 260. ISBN 83-01-04166-8.