| |||||||||
| |||||||||
| Ogólne informacje | |||||||||
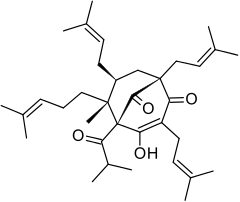
| Wzór sumaryczny |
C35H52O4 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
536,80 g/mol | ||||||||
| Identyfikacja | |||||||||
| Numer CAS | |||||||||
| PubChem | |||||||||
| DrugBank | |||||||||
| |||||||||
| |||||||||
| |||||||||
| |||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||
| |||||||||
Hiperforyna – organiczny związek chemiczny z grupy pierścieniowych ketonów terpenowych[1], należący do rodziny związków pochodzenia roślinnego określanych jako policykliczne poliprenylowane acylofloroglucynole (PPAP)[4]. Jest wytwarzana przez rośliny z rodzaju dziurawiec Hypericum, z których najważniejszym jest dziurawiec zwyczajny H. perforatum[5]. Stanowi jego najważniejszą substancję czynną[6], odpowiedzialną m.in. za właściwości przeciwdepresyjne[6][4][7].
Występowanie
Jedynym gatunkiem, w którym hiperforyna występuje w znaczących ilościach, jest dziurawiec zwyczajny[8], stanowiący główne źródło tego związku[4]. Uzyskuje się ją z dziurawca przez ekstrakcję ciekłym dwutlenkiem węgla w stanie podkrytycznym (70 atm/37,6 °C, wydajność ok. 29 mg/g suchej masy) lub nadkrytycznym (300 atm/40 °C, wydajność ok. 23 mg/g sm). Wcześniej stosowane techniki ekstrakcji były mało wydajne i ze względu na podatność hiperforyny na utlenianie i degradację pod wpływem światła jej ilości w uzyskiwanych ekstraktach nie miały znaczenia farmakologicznego[6][8]. Produkt uzyskiwany przez ekstrakcję ciekłym CO
2 zawiera także adhiperforynę[uwaga 1] (do 15% w stosunku do hiperforyny), brak w nim natomiast hiperycyny, karmazynowego pigmentu o działaniu fotouczulacjącym[6], którego obecność podwyższa skuteczność działania przeciwnowotworowego hiperforyny[4]. Hiperycyna ma także działanie antydepresyjne, choć działa według innego mechanizmu niż hiperyna[8].
Właściwości chemiczne
Hiperforyna jest prenylowaną pochodną floroglucyny (1,3,5-trihydroksybenzenu) i należy do grupy policyklicznych poliprenylowanych acylofloroglucyn (PPAP, z ang. polycyclic polyprenylated acylphloroglucinols), której liczni przedstawiciele występują w roślinach z rodziny dziurawcowatych i rodzin pokrewnych[4][10]. Szkielet floroglucyny spięty jest trzywęglowym mostkiem, tworząc układ bicyklo[3.3.1]nonanu, występujący u wielu acylofloroglucyn[8]. W roztworach fragment 1,3,5-trihydroksybenzenowy oraz boczna grupa karbonylowa hiperforyny znajdują się w dynamicznej równowadze tautomerycznej, co utrudnia analizę widm NMR tego związku[8][6].
Hiperforyna została wyizolowana po raz pierwszy z dziurawca zwyczajnego w 1971 r., a w 1975 r. naukowcy z Instytutu Chemii Bioorganicznej im. M.M. Szemiakina Akademii Nauk ZSRR wyjaśnili jej strukturę[10][11]. Sygnały 1H i 13C NMR tego związku zostały jednoznacznie przypisane do struktury w 2002 r., natomiast jego konfiguracja absolutna została ustalona wcześniej, w latach 1982–1983, za pomocą rentgenografii strukturalnej pojedynczego kryształu[8].
Niestabilność hiperforyny wynika z obecności układu β-dikarbonylowego, gdyż analogiczne związki, w którym go nie ma, są trwałe[8]. W ekstraktach z części dziurawca wystawionych na działanie powietrza zidentyfikowano kilka produktów utlenienia, w których jeden z atomów tlenu i łańcuchów bocznych zostały połączone w układ furanu, zawierający dodatkową grupę hydroksylową[9][12]. Komercyjne alkoholowe ekstrakty z dziurawca zawierają 1–5% hiperforyny, przekształconej w sól dicykloheksyloamoniową, co zapewnia trwałość w temperaturze pokojowej i odporność na obecność powietrza[8].
Synteza chemiczna hiperforyny była dużym wyzwaniem ze względu na obecność czterech sąsiadujących grup karbonylowych/enolowych oraz bocznych łańcuchów terpenoidowych gęsto rozmieszczonych na szkielecie bicyklo[3.3.1]nonanu. Szczególną trudnością syntetyczną jest obecność centrum stereogenicznego w pozycji C8 (inne PPAP mają w tej pozycji zazwyczaj dwie grupy metylowe, dzięki czemu atom C8 jest achiralny)[10][13]. W 2010 r. naukowcy z Uniwersytetu Tokijskiego opisali syntezę ent-hiperforyny (czyli enancjomeru związku naturalnego)[13], co wymagało przeprowadzenia 51 etapów[10]. Natomiast synteza totalna właściwej hiperforyny została opublikowana w 2012 r. przez chemików z amerykańskiego Uniwersytetu Harvarda. Dzięki zastosowaniu innej strategii syntetycznej procedura została skrócona do 18 etapów[10].
Właściwości biologiczne
Hiperforyna jest współcześnie uważana za związek decydujący o przeciwdepresyjnych właściwościach ekstraktów z dziurawca[1][3][4][6][10][12][14][15]. Wykazuje również działanie przeciwbakteryjne[9][11][12][13], przeciwmalaryczne[13][16] i przeciwnowotworowe[4].
Farmakokinetyka
Maksymalne stężenie w osoczu stwierdzono po 3–4 godzinach od podania preparatu zawierającego 14,8 mg hiperforyny. Biologiczny okres półtrwania (t1/2) i średni czas obecności w osoczu wynosił odpowiednio 9 i 12 godzin, przy szacowanym stężeniu w stanie stacjonarnym 100 ng/ml (ok. 180 nM) dla 3 dawek dziennie. Zmiana stężeń miała charakter liniowy i nie stwierdzono kumulacji związku[2].
W innym badaniu po jednorazowym podaniu 612 mg suchego ekstraktu z dziurawca stwierdzono okres półtrwania wynoszący ok. 20 h. Nie udało się ustalić przyczyn tych rozbieżności[3].
Farmakodynamika
W warunkach in vitro działała jako inhibitor wychwytu zwrotnego neuroprzekaźników[10][15], w tym serotoniny, noradrenaliny, dopaminy, GABA i glutaminianu z IC50[uwaga 2] o wartości 40–110 μg/l dla wszystkich związków z wyjątkiem glutaminianu, dla którego IC50 wyznaczono na 450 μg/l[14].
| Neuroprzekaźnik | IC50 (nM) |
|---|---|
| Noradrenalina | 80 ± 24 |
| Dopamina | 102 ± 19 |
| Kwas γ-aminomasłowy | 184 ± 41 |
| Serotonina | 205 ± 45 |
| Glutaminian | 829 ± 687 |
| Cholina | 8500 |
Ki[uwaga 3] hiperforyny dla ludzkiego receptora dopaminowego D1 wynosi ok. 600 nM[19][20].
Interakcje z lekami
Hiperforyna jest bardzo silnym ligandem receptora pregnanu X (Ki = 27 nM), który reguluje ekspresję monooksygenazy cytochromu P450 3A4 (CYP3A4). Ponieważ enzym ten bierze udział w metabolizmie większości leków, preparaty zawierające hiperforynę mogą wpływać na ich działanie[21]. Np. znane jest przyspieszenie metabolizmu niektórych doustnych środków antykoncepcyjnych lub obniżenie biodostępności digoksyny, teofiliny, cyklosporyny i fenprokumonu[22].
Badania kliniczne właściwości antydepresyjnych
Do 2017 r. przeprowadzono dwie metaanalizy badań klinicznych oceniających skuteczność dziurawca w leczeniu łagodnej do umiarkowanej depresji. Stwierdzono skuteczność zbliżoną do selektywnych inhibitorów wychwytu zwrotnego serotoniny oraz lepszą tolerancję. Ze względu na krótki czas trwania (4–12 tygodni) recenzowanych badań, niemożliwe było ustalenie efektów długoterminowych[23][24].
Analogi
- Wybrane naturalne i półsyntetyczne analogi hiperforyny
 Adhiperforyna
Adhiperforyna Arystoforyna
Arystoforyna Trimetoksybenzoesan hiperforyny
Trimetoksybenzoesan hiperforyny Tetrahydrohiperforyna
Tetrahydrohiperforyna Oktahydrohiperforyna
Oktahydrohiperforyna Nikotynian hiperforyny
Nikotynian hiperforyny
Uwagi
- ↑ Adhiperforyna jest homologiem hiperforyny, w którym boczny łańcuch jest ketonem sec-butylowym, a nie izopropylowym[4][9].
- ↑ IC50 oznacza stężenie powodujące inhibicję specyficznego wiązania o 50%[17].
- ↑ Ki to stała inhibicji, czyli stała dysocjacji kompleksu receptor–inhibitor RI ⇄ R + I[18].
Przypisy
- 1 2 3 Hyperforin, [w:] PubChem, United States National Library of Medicine, CID: 441298 [dostęp 2021-09-21] (ang.).
- 1 2 A. Biber i inni, Oral bioavailability of hyperforin from hypericum extracts in rats and human volunteers, „Pharmacopsychiatry”, 31, 1998, s. 36–43, DOI: 10.1055/s-2007-979344, PMID: 9684946 (ang.).
- 1 2 3 Hans-Ulrich Schulz i inni, Investigation of the bioavailability of hypericin, pseudohypericin, hyperforin and the flavonoids quercetin and isorhamnetin following single and multiple oral dosing of a hypericum extract containing tablet, „Arzneimittelforschung”, 55 (1), 2005, s. 15–22, DOI: 10.1055/s-0031-1296820, PMID: 15727160 (ang.).
- 1 2 3 4 5 6 7 8 Roxana Ciochina, Robert B. Grossman, Polycyclic polyprenylated acylphloroglucinols, „Chemical Reviews”, 106 (9), 2006, s. 3963–3986, DOI: 10.1021/cr0500582, PMID: 16967926 (ang.).
- ↑ Hyperforin, [w:] DrugBank, University of Alberta, DB01892 [dostęp 2021-09-21] (ang.).
- 1 2 3 4 5 6 Mariam Gaid i inni, Biotechnological production of hyperforin for pharmaceutical formulation, „European Journal of Pharmaceutics and Biopharmaceutics”, 126, 2018, s. 10–26, DOI: 10.1016/j.ejpb.2017.03.024, PMID: 28377273 (ang.).
- ↑ Netta Roz, Moshe Rehavi, Hyperforin depletes synaptic vesicles content and induces compartmental redistribution of nerve ending monoamines, „Life Sciences”, 75 (23), 2004, s. 2841–2850, DOI: 10.1016/j.lfs.2004.08.004, PMID: 15464835 (ang.).
- 1 2 3 4 5 6 7 8 Ludger Beerhues, Hyperforin, „Phytochemistry”, 67 (20), 2006, s. 2201–2207, DOI: 10.1016/j.phytochem.2006.08.017, PMID: 16973193 (ang.).
- 1 2 3 Luisella Verotta i inni, Furohyperforin, a prenylated phloroglucinol from St. John’s wort (Hypericum perforatum), „Journal of Natural Products”, 62 (5), 1999, s. 770–772, DOI: 10.1021/np980470v, PMID: 10346967 (ang.).
- 1 2 3 4 5 6 7 Brian A. Sparling, David C. Moebius, Matthew D. Shair, Enantioselective total synthesis of hyperforin, „Journal of the American Chemical Society”, 135 (2), 2013, s. 644–647, DOI: 10.1021/ja312150d, PMID: 23270309 (ang.).
- 1 2 N.S. Bystrov i inni, The structure of hyperforin, „Tetrahedron Letters”, 16 (32), 1975, s. 2791–2794, DOI: 10.1016/S0040-4039(00)75241-5 (ang.).
- 1 2 3 V. Vajs i inni, Further degradation product of hyperforin from Hypericum perforatum (St John’s Wort), „Fitoterapia”, 74 (5), 2003, s. 439–444, DOI: 10.1016/s0367-326x(03)00114-x, PMID: 12837358 (ang.).
- 1 2 3 4 Yohei Shimizu i inni, Catalytic asymmetric total synthesis of ent-hyperforin, „Angewandte Chemie”, 49 (6), 2010, s. 1103–1106, DOI: 10.1002/anie.200906678, PMID: 20063336 (ang.).
- 1 2 3 S.S. Chatterjee i inni, Hyperforin as a possible antidepressant component of hypericum extracts, „Life Sciences”, 63 (6), 1998, s. 499–510, DOI: 10.1016/s0024-3205(98)00299-9, PMID: 9718074.
- 1 2 Kristina Leuner i inni, Hyperforin – a key constituent of St. John’s wort specifically activates TRPC6 channels, „FASEB Journal”, 21 (14), 2007, s. 4101–4111, DOI: 10.1096/fj.07-8110com, PMID: 17666455 (ang.).
- ↑ Luisella Verotta i inni, In vitro antimalarial activity of hyperforin, a prenylated acylphloroglucinol. A structure-activity study, „Bioorganic & Medicinal Chemistry Letters”, 17 (6), 2007, s. 1544–1548, DOI: 10.1016/j.bmcl.2006.12.100, PMID: 17234416 (ang.).
- ↑ Robert F. Bruns, Receptors for adenosine and adenine nucleotides, [w:] Janet L. Rideout, David W. Henry, Lowrie M. Beacham (red.), Nucleosides, nucleotides, and their biological applications. Proceedings of the 5th International Round Table, October 20-22, 1982, New York: Academic Press, 1983, s. 133, ISBN 0-12-587980-6, OCLC 9972023 (ang.).
- ↑ Hiram F. Gilbert, Basic concepts in biochemistry. A students survival guide, wyd. 2, New York: McGraw-Hill, 2000, s. 113, ISBN 0-07-135657-6, OCLC 41482499.
- ↑ Veronika Butterweck i inni, In vitro receptor screening of pure constituents of St. John’s wort reveals novel interactions with a number of GPCRs, „Psychopharmacology”, 162 (2), 2002, s. 193–202, DOI: 10.1007/s00213-002-1073-7, PMID: 12110997 (ang.).
- ↑ Activity Spreadsheet – Enzyme Inhibition Constant Data, [w:] Binding Database [online], University of California [dostęp 2021-09-28] (ang.).
- ↑ L.B. Moore i inni, St. John’s wort induces hepatic drug metabolism through activation of the pregnane X receptor, „Proceedings of the National Academy of Sciences of the United States of America”, 97 (13), 2000, s. 7500–7502, DOI: 10.1073/pnas.130155097, PMID: 10852961, PMCID: PMC16574 (ang.).
- ↑ A. Fugh-Berman, Herb-drug interactions, „The Lancet”, 355 (9198), 2000, s. 134–138, DOI: 10.1016/S0140-6736(99)06457-0, PMID: 10675182 (ang.).
- ↑ Qin Xiang Ng, Nandini Venkatanarayanan, Collin Yih Xian Ho, Clinical use of Hypericum perforatum (St John’s wort) in depression: A meta-analysis, „Journal of Affective Disorders”, 210, 2017, s. 211–221, DOI: 10.1016/j.jad.2016.12.048, PMID: 28064110 (ang.).
- ↑ Yong-hua Cui, Yi Zheng, A meta-analysis on the efficacy and safety of St John’s wort extract in depression therapy in comparison with selective serotonin reuptake inhibitors in adults, „Neuropsychiatric Disease and Treatment”, 12, 2016, s. 1715–1723, DOI: 10.2147/NDT.S106752, PMID: 27468236, PMCID: PMC4946846 (ang.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.