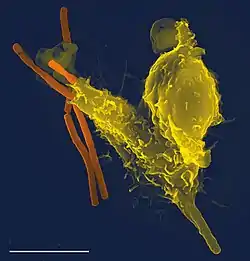
 Neutrofil (żółta komórka) fagocytujący laseczki wąglika (SEM) |

Neutrofil, granulocyt obojętnochłonny – rodzaj komórek układu odpornościowego. Neutrofile stanowią 50–75% leukocytów i najliczniejszą populację wśród granulocytów. Pełnią one zasadniczą rolę w działaniu układu immunologicznego nieswoistego i są pierwszą linią obrony organizmu przed drobnoustrojami chorobotwórczymi. Ich znaczenie polega głównie na zdolności do szybkiego reagowania, dzięki obecności odpowiednich receptorów na powierzchni komórki i możliwości bezpośredniego uruchomienia szeregu mechanizmów niszczących patogeny.
Neutrofile są produkowane w szpiku kostnym i uwalniane do krwi. Są fagocytami, które przede wszystkim występują w świetle naczyń krwionośnych. W odpowiedzi na szkodliwe dla organizmu czynniki, głównie infekcje bakteryjne, migrują szybko do miejsc zakażenia. Podążając za sygnałami chemotaktycznymi, przenikają przez ścianę naczyń i poprzez tkankę śródmiąższową docierają tam gdzie znajdują się patogeny i niszczą je. Zaczynają działanie już w początkowej, ostrej fazie zapalenia i stanowią główny składnik ropy, nadając jej białawo-żółtawą barwę.
Rozwój neutrofilów
Neutrofile pochodzą, jak wszystkie krwinki, od komórek macierzystych szpiku. Kolejnymi stadiami rozwojowymi są:
- mieloblasty – pierwsze rozróżnialne morfologicznie komórki szeregu rozwojowego granulocytów
- promielocyty – są komórkami, w których pojawiają się tzw. ziarnistości azurofilne, występujące także w dojrzałych neutrofilach, choć ich udział w dalszym rozwoju jest coraz mniejszy
- mielocyty – to komórki, które zaczynają być podobne do dojrzałych neutrofilów; na tym etapie pojawiają się ziarna kwaso- i zasadochłonne, co powoduje zróżnicowanie linii granulocytów na bazofile, neutrofile oraz eozynofile
- metamielocyty – są komórkami, których jądro przyjmuje kształt fasoli, co jest wstępem do dalszej jego fragmentacji, niezwykle charakterystycznej dla dojrzałych granulocytów
- pałeczki – to przedostatnie stadium rozwoju, w zasadzie nieodróżnialne od dojrzałych neutrofilów. Fragmentacja jądra może być niepełna. Pałeczki opuszczają szpik kostny i można znaleźć je we krwi, gdzie stanowią 1–5% komórek
- dojrzała forma – segmentowane jądro komórkowe, we krwi stanowią 57–65% komórek.

Zasadniczo neutrofile krążą we krwi do kilkunastu godzin, po czym ulegają apoptozie lub przechodzą do tkanek. W tkankach mogą przeżyć jeszcze od kilkunastu do kilkudziesięciu godzin, po czym także ulegają apoptozie. Śmierć neutrofilów jest także nieuchronnym skutkiem ich aktywacji, zatem po wypełnieniu swych funkcji obronnych komórki te nie odnawiają zapasu białek bakteriobójczych, lecz giną.
Morfologia dojrzałego neutrofila
Kształt i wielkość neutrofilów są względnie stałe – w stanie niepobudzonym mają kształt kulisty i średnicę od 12 do 15 mikrometrów. Kształt jądra komórkowego neutrofilów zależy od ich wieku. U dojrzałych neutrofili jest ono segmentowane i podzielone na 2–5 fragmentów, otaczających położoną w środku komórki centriolę. Ocenę procentową liczby płatów jądra wykorzystuje się do oceny intensywności produkcji neutrofilów i nazywa się tzw. liczbą (wzorem) Arnetha[1].
Chromatyna w jądrze jest wyraźnie podzielona na hetero- i euchromatynę, przy czym wzór jej kondensacji jest także dosyć charakterystyczny. Niezwykle ważne natomiast, nie tylko ze względów morfologicznych, ale również czynnościowych, są ziarnistości wewnątrzkomórkowe neutrofilów.
Ziarnistości wewnątrzkomórkowe
W cytoplazmie neutrofilów spotyka się trzy rodzaje ziarnistości:
- ziarnistości pierwotne, nazywane inaczej azurofilnymi, które powstają już na etapie promielocytu. Stanowią one 10–20% wszystkich zawartych w neutrofilach ziaren wewnątrzcytoplazmatycznych. Spośród zawartych w nich białek szczególnie istotne są: kwaśne hydrolazy lizosomowe, serprocydyny, defensyny i mieloperoksydaza. Ta ostatnia jest wyznacznikiem tych ziaren, tzn. wykrywając mieloperoksydazę możemy stwierdzić, że mamy do czynienia z ziarnistościami azurofilnymi.
- ziarnistości wtórne, stanowiące 80–90% wszystkich ziarnistości, nazywane są także ziarnistościami swoistymi, ze względu na fakt ich występowania tylko w neutrofilach. Zawierają m.in. alkaliczną fosfatazę (lizozym)[2]. Ich białkiem markerowym jest laktoferyna.
- ziarnistości trzeciorzędowe, czyli żelatynowe, nazwane tak ze względu na obecność enzymu żelatynazy[2]
Po pobudzeniu neutrofila dochodzi do uwolnienia ziarnistości do fagolizosomu, dzięki czemu zamknięte w nim mikroorganizmy mogą zostać zabite. Wiele mediatorów zawartych w ziarnistościach może się wydostawać na zewnątrz komórki, zaś ich wykrycie może być użyte w diagnostyce stanu zapalnego.
Funkcja i mechanizm działania neutrofilów
W walce z drobnoustrojami neutrofile wykorzystują 3 główne mechanizmy działania:
- fagocytozę
- wydzielanie cząsteczek przeciwdrobnoustrojowych (degranulacja)
- i wyrzut zewnątrzkomórkowych sieci neutrofilowych (NET)[3]
Aktywacja
Żeby neutrofile mogły sprawnie działać, muszą być najpierw aktywowane. Aktywacja tych komórek zachodzi dwustopniowo, zaś jej oznaką jest zmiana kształtu komórki na dwubiegunowy, przy czym na jednym z biegunów wytwarzają się liczne pseudopodia (nibynóżki).
Pierwszym etapem aktywacji jest tzw. preaktywacja, która dopiero przygotowuje komórkę do dalszego działania. Preaktywacja jest wywoływana przez endogenne czynniki występujące w organizmie gospodarza, głównie cytokiny. Główną rolę odgrywają tutaj TNF-alfa oraz jedna z chemokin – CXCL8 (znana również pod nazwą Interleukina 8). CXCL8 poprzez receptory chemokin, które ulegają ekspresji w błonie komórkowej neutrofila, działają chemotaktycznie przemieszczając neutrofile z krwi do tkanek i w tkankach (np. do ogniska infekcji)[4].
Preaktywacja „uczula” komórkę na działanie innych związków, takich jak występujące jedynie w bakteriach N-formylowane peptydy bakteryjne. Przyłączenie się tych substancji powoduje w komórce wzrost stężenia wapnia, cAMP oraz 1,4,5-trisfosforanu inozytolu i diacyloglicerolu. Wszystkie te czynniki są wewnątrzkomórkowymi przekaźnikami informacji i wywołują zmianę kształtu komórki, jej ruch oraz umożliwiają zachodzenie opisanego poniżej procesu fagocytozy.
Fagocytoza i degranulacja
Jednym z głównych procesów, które umożliwiają eliminację patogenów przez neutrofile jest fagocytoza. Proces ten polega na pochłonięciu całych patogenów lub też dużych cząstek pochodzących w wyniku ich rozpadu i praktycznie całkowitym strawieniu ich we wnętrzu komórki. W ogólnym zarysie fagocytoza przebiega w ten sposób, że najpierw neutrofil przyłącza się do patogenu za pośrednictwem odpowiednich receptorów, po czym patogen jest pochłaniany i zamykany w pęcherzyku zwanym fagosomem. Z kolei do fagosomu przyłącza się lizosom, zawierający we wnętrzu enzymy umożliwiające rozkład patogenu, co skutkuje powstaniem fagolizosomu, w którym te procesy przebiegają. Zabicie patogenu jest ułatwiane dodatkowo wydzieleniem do fagolizosomu białek zawartych we wspomnianych już ziarnistościach – proces ten nosi nazwę degranulacji wewnątrzkomórkowej, dla odróżnienia od degranulacji zewnątrzkomórkowej, która polega na wydzieleniu zawartości ziaren do środowiska otaczającego komórkę. Dodatkowym i z wielu powodów niezwykle istotnym zjawiskiem jest wybuch tlenowy, polegający na tworzeniu reaktywnych form tlenu, głównie wolnych rodników, które są niezwykle silnymi substancjami o znaczeniu bakteriobójczym. Wybuch tlenowy jest indukowany aktywacją neutrofilów i stanowi dopełnienie działalności białek pochodzących z ziarnistości wewnątrzkomórkowych.
Receptory, które odgrywają zasadniczą rolę w procesie fagocytozy neutrofilów można podzielić na dwa rodzaje:
- receptory biorące udział w fagocytozie nieimmunologicznej – są receptorami wiążącymi bezpośrednio patogen lub jego fragmenty. Receptory te noszą nazwę PRR, zaś cząsteczki patogenu, wiązane przez te receptory, określa się mianem PAMP.
- receptory biorące udział w fagocytozie immunologicznej – są to receptory dla części Fc przeciwciał oraz dla składowych dopełniacza. Wiązanie patogenu zachodzi w tym przypadku pośrednio: najpierw dopełniacz lub przeciwciała wiążą się z patogenem, a potem z kolei one same są wiązane przez neutrofile. Najważniejszymi receptorami dla dopełniacza są receptory oznaczone symbolami CR1 i CR3. Receptory dla dopełniacza sprawują funkcję pomocniczą, nie mogą bowiem same zapoczątkować fagocytozy. Receptory dla części Fc przeciwciał (głównie Fc&gamma R) mają natomiast taką możliwość.
Przypisy
- ↑ Malejczyk, Jacek Tadeusz., Wydawnictwo Lekarskie PZWL., Histologia, wyd. 6 uaktual. i rozsz. – 2 dodr, Warszawa: Wydawnictwo Lekarskie PZWL, [cop. 2012], ISBN 978-83-200-4349-5, OCLC 812711786 [dostęp 2019-08-23].
- 1 2 Tadeusz Cichocki, Jan Andrzej Litwin, Jadwiga Mirecka, Kompendium histologii. Podręcznik dla studentów i lekarzy, Kraków: Wydawnictwo Uniwersytetu Jagiellońskiego, 2009, ISBN 978-83-233-2752-3, OCLC 750843645.
- ↑ Volker Brinkmann i inni, Neutrophil extracellular traps kill bacteria, „Science”, 303 (5663), 2004, s. 1532–1535, DOI: 10.1126/science.1092385, ISSN 1095-9203, PMID: 15001782 [dostęp 2019-08-23].
- ↑ Jakub Gołąb, Marek Jakóbisiak, Witold Lasek, Tomasz Stokłosa: Immunologia. Warszawa: Wydawnictwo Naukowe PWN, 2009, s. 91, 121. ISBN 978-83-01-15154-6.