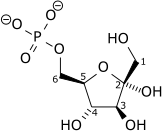
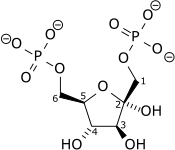
Fosfofruktokinaza I (EC 2.7.1.11), w skrócie PFK-1, jest enzymem z klasy transferaz. Bierze udział w glikolizie. Przy pomocy ATP dokonuje nieodwracalnej fosforylacji fruktozo-6-fosforanu, tworząc fruktozo-1,6-bisfosforan oraz ADP.
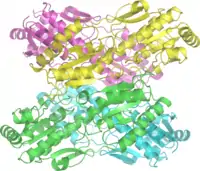
Struktura czwartorzędowa fosfofruktokinazy I
Reakcja[1]
Struktura[2]
Aktywna biologicznie fosfofruktokinaza I występuje pod postacią tetrameru. Posiada ona dwa izozymy:
Istnieje 5 kombinacji organizacji tych izozymów, tzn. istnieje 5 form tetramerów: M4, M3L, M2L2, ML3 oraz L4. Forma M4 występuje w mięśniach, L4.
U ludzi, występują trzy izozymy[3]:
- izozym M (mięśnie)
- izozym L (mięśnie)
- izozym P (fibroblasty i trombocyty)
W każdej z tkanek różna jest ekspresja tych izozymów.
Regulacja
Reakcja katalizowana przez fosfofruktokinazę I jest najważniejszym punktem kontrolnym w glikolizie. Istnieją różne sposoby jej regulacji:
- ATP - enzym jest allosterycznie hamowany przez ATP,
- AMP - duże ilości AMP aktywują fosfofruktokinazę I,
- cytrynian - duża jego ilość sygnalizuje, że ilość intermediatów cyklu kwasy cytrynowego jest duża, przez co dalszy rozkład glukozy nie jest potrzebny,
- fruktozo-2,6-bisfosforan - stymuluje przebieg glikolizy,
- Jony H+ - Fosfofruktokinaza jest hamowana przez jony wodorowe, tak więc szybkość glikolizy maleje wraz ze spadkiem pH. Zapobiega to nadmiernemu tworzeniu mleczanu w warunkach beztlenowych.
Przypisy
Bibliografia
- Metabolizm węglowodanów. W: B.D.Hames, N.M.Hooper: Krótkie wykłady. Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007 (wydanie drugie); strona 325-326
Linki zewnętrzne
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.