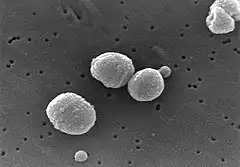
 Obraz pneumokoków w skaningowym mikroskopie elektronowym | |
| Systematyka | |
| Domena | |
|---|---|
| Typ | |
| Klasa |
Bacilli |
| Rząd | |
| Rodzina |
Streptococcaceae |
| Rodzaj | |
| Gatunek |
Streptococcus pneumoniae |
| Nazwa systematyczna | |
| Streptococcus pneumoniae (Klein 1884) Chester 1901 | |
Dwoinka zapalenia płuc, potocznie pneumokok (Streptococcus pneumoniae, pneumococcus) – bakteria Gram-dodatnia, anaerob fakultatywny, należący do paciorkowców alfa-hemolizujących. Wykryta została przez Ludwika Pasteura wraz z Charlesem Chamberlandem oraz niezależnie przez George’a Sternberga w 1881 roku[1]. Jest częstą przyczyną zachorowań na zapalenie opon mózgowo-rdzeniowych u małych dzieci oraz zapalenie płuc u osób z osłabioną odpornością, przy czym liczba zakażeń wzrosła w pierwszych latach XXI wieku[2].
Wbrew swojej nazwie bakteria może wywoływać różnego rodzaju zakażenia inne, niż zapalenie płuc, w tym ostre zapalenie zatok, zapalenie ucha środkowego, zapalenie opon mózgowo-rdzeniowych, zapalenie szpiku kostnego, septyczne zapalenie stawów, zapalenie wsierdzia, zapalenie otrzewnej, zapalenie osierdzia, tkanki łącznej i ropień mózgu.
Historia
W 1881 po raz pierwszy wyizolowano drobnoustrój będący czynnikiem etiologicznym zapalenia płuc (od gr. pneumon – płuco) i dlatego nazwano go pneumococcus. Dokonali tego jednocześnie i niezależnie lekarz armii amerykańskiej George Sternberg i francuski badacz Ludwik Pasteur wraz z Charlesem Chamberlandem.
W 1884 organizm ten został po raz pierwszy zdiagnozowany taksonomicznie przez Edwarda Kleina pod nazwą Diplococcus pneumoniae (dwoinka zapalenia płuc)[3], którą w 1980 zmieniono na Streptococcus pneumoniae (za nazewnictwem Chestera z 1901 roku[4])[5].
Bakteria ta odegrała kluczową rolę w wykazaniu, że materiał genetyczny składa się z DNA. W 1928 Frederick Griffith wykazał występowanie transformacji żywych, nieszkodliwych pneumokoków do postaci zdolnej wywoływać śmiertelną chorobę poprzez inokulację tych pierwszych do ciała myszy razem z zabitymi ciepłem, zjadliwymi pneumokokami. W 1944 Oswald Avery, Colin MacLeod i Maclyn McCarty wykazali, że czynnikiem wywołującym transformację w eksperymencie Griffitha było DNA, a nie białka, jak powszechnie uważano w tamtym czasie[6]. Prace Avery’ego zaznaczyły narodziny epoki genetyki molekularnej[7].
Morfologia
Dwoinka zapalenia płuc ma kształt kulisty lub zbliżony do kuli, średnicę około 1μm i jest zaliczana do ziarniaków. Bakterie układają się zazwyczaj w pary, a kolonie mogą przyjmować obraz łańcuszków różnej długości.
Drobnoustrój nie wytwarza przetrwalników, ale posiada otoczkę zarówno podczas infekcji w organizmie, jak i na podłożach hodowlanych. Szczepy przechodzą w formy bezotoczkowe (forma R) w niesprzyjających warunkach, jednak po przeniesieniu do sprzyjającego środowiska ponownie wytwarzają otoczkę (forma S). Opisywane są również formy przejściowe – RS, SR.
Bakterie które utraciły zdolność tworzenia otoczki, mogą ją nabyć od innych szczepów na zasadzie transdukcji[8]. Szczepy bezotoczkowe nie są patogenne[8].
Pneumokoki nie mają rzęsek, nie wykazują więc zdolności ruchu na podłożach hodowlanych.
Ze względu na antygeny obecne w otoczce wyróżnia się około 80 typów serologicznych. Antygeny otoczkowe składają się m.in. z kwasu glukuronowego, glukozy, ramnozy, aminocukrów, a wprowadzone do organizmu są w stanie go immunizować. Ze względu na brak odpowiedniego wielocukru C S. pneumoniae nie mogą być klasyfikowane według podziału Lancefield.
Profil biochemiczny
Podobnie jak reszta bakterii w tej rodzinie, dwoinka zapalenia płuc nie wytwarza katalazy. Fermentuje niektóre cukry bez wytworzenia gazu – końcowym metabolitem jest kwas mlekowy.
| Cukier | Fermentacja | Cukier | Fermentacja |
|---|---|---|---|
| Glukoza | obecna | Laktoza | obecna |
| Galaktoza | obecna | Sacharoza | obecna |
| Maltoza | obecna | Arabinoza | brak |
| Ksyloza | brak | Dulcytol | brak |
| Inozytol | brak | Sorbitol | brak |
Patogeneza
Streptococcus pneumoniae jest stwierdzana w gardle i zatokach nosowych u 5-10% zdrowych dorosłych oraz 20-40% zdrowych dzieci. Drobnoustrój ten jest stwierdzany w dużych ilościach w miejscach częstego bytowania ludzi i ich dużego zagęszczenia (np. baraki wojskowe, szpitale). Bakteria ma zdolności adhezyjne do nabłonka dróg oddechowych. Nadmierna kolonizacja w obrębie tkanki doprowadza do infekcji. Do zapalenia płuc dochodzi gdy bakteria zostanie zaaspirowana z wdychanym powietrzem do utkania płucnego. Kiedy drobnoustrój znajdzie się w miejscu swojego przeznaczenia, dochodzi do aktywacji jego białek stymulujących produkcję cytokin (czynników prozapalnych) i przyciągających białe krwinki (zwłaszcza leukocyty obojętnochłonne). Polisacharydowa otoczka czyni te bakterie odporne na fagocytozę, jeżeli w organizmie nie ma przeciwciał skierowanych przeciwko otoczce, makrofagi tkankowe nie są w stanie zneutralizować pneumokoków. Bakterie mogą przedostać się do krążenia, wywołując posocznicę, przedostać się do opon mózgowych, stawów i kości.
Streptococcus pneumoniae posiada kilka czynników zwiększających jego wirulencję, w tym wspomnianą otoczkę polisacharydową, która pozwala ominąć układ odporności nosiciela. Pneumokokowe białka powierzchniowe, hamujące aktywację dopełniacza oraz wydzielany enzym IgA1 proteazę, niszczącą przeciwciała Iga produkowane przez zakażonego.
Ryzyko infekcji pneumokokowej wzrasta u ludzi z zaburzeniami produkcji przeciwciał IgG, fagocytozy, bądź upośledzoną funkcją nabłonka dróg oddechowych. Brak śledziony (po zabiegu splenektomii, wrodzona asplenia, choroba komórek sierpowatych) predysponują do cięższego przebiegu schorzenia.
Diagnostyka

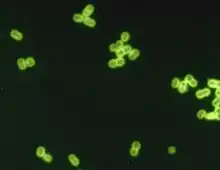
W przypadku podejrzenia zakażenia pneumokokami z biomateriału wykonuje się posiew oraz barwienie mikroskopowe. Posiew umożliwia wykonanie antybiogramu, a w konsekwencji ustalenia lekooporności szczepu.
Badanie mikroskopowe
Preparaty bezpośrednie barwi się metodą Grama, metodą Fleminga oraz wykonywany jest odczyn Neufelda (odczyn serologiczny pęcznienia otoczek). Badanie mikroskopowe ma wartość diagnostyczną, jednak nie zastępuje posiewu – nie jest możliwe ustalenie lekooporności.
Hodowla
Streptococcus pneumonie nie wzrasta na zwykłych podłożach hodowlanych, jak agar lub bulion mięsny, dlatego materiał jest posiewany na agar z krwią. Czasami stosuje się dwie hodowle: pierwsza to agar z krwią, a druga to bulion pneumokokowy, który później jest przesiewany na agar z krwią. Bulion pneumokokowy to pożywka typu namnażającego umożliwiająca szybki wzrost drobnoustroju, nie jest jednak możliwa dokładna ocena szczepu. Najlepszy wzrost uzyskuje się przy podwyższonym ciśnieniu CO2[8], pH 7,5 i temperaturze 37 °C.
Na agarze z krwią powodują hemolizę typu alfa, a w warunkach beztlenowych także beta. Kolonie mają średnice około 2 mm, są okrągłe, przejrzyste, błyszczące i płaskie, przy czym brzeg kolonii starszych jest wyższy od ich środka (wgłobienie centralnej części hodowli)[9]; przyczyną tego jest autoliza. Część szczepów (typ3) rośnie w postaci śluzowych wypukłych kolonii[9].
Rozróżnienie pneumokoków od pozostałych bakterii z rodzaju Streptococcus jest możliwe dzięki dwóm próbom. Pierwsza z nich polega na próbie rozpuszczeniu drobnoustroju w żółci – pneumokoki w przeciwieństwie do innych bakterii ulegają rozpuszczeniu, co objawia się przejaśnieniem płynu w ciągu 10–40 minut.
Druga próba polega na dodaniu do hodowli optochiny. Hamuje ona wzrost dwoinki zapalenia płuc, nie wpływając na pozostałe bakterie.
Pneumokoki, w odróżnieniu od enterokoków nie rosną przy podwyższonym stężeniu chlorku sodu lub przy pH 9,5. Są oporne na bacytracynę, co odróżnia je od Streptococcus pyogenes.
Czynniki zjadliwości
Do czynników zjadliwości pneumokoków zalicza się m.in.:
- Otoczka bakteryjna – posiada właściwości antyfagocytarne, a także umożliwia penetrację do ośrodkowego układu nerwowego. Nie ma właściwości toksycznych.
- Pneumolizyna – hemolizyna, która jest zdolna do destrukcji tkanek oraz hamowania układu immunologicznego, zwłaszcza w ciągu pierwszych godzin infekcji.
- Proteaza IgA – proteaza inaktywująca immunoglobulinę A.
- Nadtlenek wodoru – niszczy komórki, może powodować apoptozę komórek nerwowych podczas zapalenia opon mózgowych, zabija inne bakterie[10].
- Fimbrie – włosowate struktury pokrywające powierzchnie komórki, umożliwiają przyleganie do nabłonka dróg oddechowych[11].
- Leukocydyna
- Fibrynolizyna
- Hialuronidaza
- Sortaza
Dwa ostatnie wymienione czynniki to enzymy warunkujące zdolność do kolonizacji tkanek.
Chorobotwórczość

Pneumokoki są częstą przyczyną zakażeń u człowieka. Szerzą się drogą kropelkową, ze szczytem zachorowań jesienią i zimą (Polska). Infekcja często jest poprzedzona wcześniejszą kolonizacją, zwłaszcza okolicy nosowo-gardłowej. Sama obecność bakterii w górnych drogach oddechowych nie świadczy jeszcze o chorobie, ze względu na częstą bezobjawową kolonizację (zwłaszcza u dzieci)[12][13]. Współtowarzyszące lub niedawno przebyte zakażenie rynowirusem lub adenowirusem sprzyja adhezji bakterii do nabłonka[14].
- Zapalenie płuc – zarówno płatowe (najczęstsze miejsce infekcji tą bakterią), jak i odoskrzelowe
- Zapalenie opon mózgowo-rdzeniowych – dotyczy zwłaszcza dzieci (w jednym z badań na małej grupie pacjentów przyczyna około 8% tych infekcji[15]), przy czym rokowanie nie jest najlepsze[16].
- Zapalenie ucha środkowego i wyrostka sutkowatego
- Zapalenie zatok
- Zapalenie opłucnej
- Zapalenie otrzewnej
- Zapalenie rogówki
- Zapalenie stawów
- Bakteriemia i sepsa
Zakażeniu sprzyja osłabienie układu odpornościowego – wiek do dwóch lat, nowotwory, zaburzenia odporności[17], immunosupresja, stan po zabiegach, infekcja HIV[18] i inne czyniki. Brak śledziony jest czynnikiem predysponującym do infekcji wszystkimi typami bakterii otoczkowych[19][20]. S. pneumoniae może być przyczyną zakażeń szpitalnych, ale zdecydowana większość zakażeń jest nabywana poza szpitalem. Dzieci do szóstego miesiąca życia są chronione przez immunoglobuliny matki.
W przeciwieństwie do paciorkowców grupy A, gdzie tworzą się czasami autoprzeciwciała przeciwko m.in. zastawkom serca, przebycie zakażenia pneumokokami nie powoduje długotrwałych konsekwencji przebytej infekcji. Wyjątkiem jest uszkodzenie tkanek podczas zapalenia.
Leczenie
Streptococcus pneumoniae może być oporny na niektóre antybiotyki, dlatego konieczne jest sporządzenie antybiogramu. Infekcję pneumokokową leczy się z reguły antybiotykami beta-laktamowymi. W latach 1960, prawie wszystkie szczepy S. pneumoniae były wrażliwe na penicylinę, lecz od tamtego czasu wykształciła się oporność, zwłaszcza w rejonach częstego stosowania antybiotyków. Niektóre szczepy oporne na penicylinę mogą również wykazywać oporność na erytromycynę, makrolidy, klindamycynę i chinolony. Większość pozostaje jednak wrażliwa na wankomycynę, która jest rzadziej stosowanym antybiotykiem ze względu na dawkowanie oraz kwestię penetracji tkankowej. Zalecanym postępowaniem jest posiew z antybiogramem badającym oporność bakterii.
W leczeniu zapalenia opon mózgowo-rdzeniowych lub zapalenia płuc często stosuje się bardziej wyszukane antybiotyki β-laktamowe, w tym cefalosporyny, często w połączeniu z wankomycyną. Mieszanina amoksycyliny z kwasem klawulanowym stosowana jest do leczenia zakażeń narządu słuchu.
Wobec bakterii stosuje się[21] nowe fluorochinolony, cefalosporyny wszystkich generacji (poza III doustną), linkozamidy, makrolidy, tetracykliny, karbapenemy oraz ryfampicynę. Wydaje się, że stosowanie skojarzonej terapii – penicylina wraz z doksycykliną/makrolidem daje zadowalające rezultaty[22].
Aktywności nie zachowuje III doustna generacja cefalosporyn.
Bakteria zawsze jest wrażliwa na glikopeptydy (wankomycyna, teikoplanina) – są to leki ostatniej szansy. Wobec bardzo rzadko spotykanych szczepów średnio wrażliwych osiąga się sukces terapeutyczny maksymalnymi dawkami tych leków.
Oporność na penicyliny
Oporność na penicyliny wiąże się z wytworzeniem nowych lub modyfikacją już istniejących białek wiążących penicyliny, a nie z rozkładaniem antybiotyku przez β-laktamazę[23]. Wobec tych nowych miejsc wiązania antybiotyk nie zachowuje aktywności. Ze względu na wiele różnych genów kodujących różne białka wiążące penicyliny o różnym powinowactwie, istnieje wiele stopni oporności. Zakwalifikowanie szczepu do jednej z trzech poniższych grup opiera się na ustaleniu strefy zahamowania wzrostu.
- PSSP – pneumokoki wrażliwe na penicylinę (penicillin susceptible Streptococcus pneumoniae)
- PISP – pneumokoki średnio wrażliwe na penicylinę (penicillin intermediate resistant Streptococcus pneumoniae)
- PRSP – pneumokoki oporne na penicylinę (penicillin resistant Streptococcus pneumoniae)
Wobec szczepów PISP z antybiotykami beta-laktamowymi aktywność zachowują cefalosporyny II generacji oraz penicyliny z inhibitorem. W przypadku bakteriemii można stosować penicylinę G w maksymalnych dawkach, ze względu na jej dobrą penetrację do ośrodkowego układu mózgowego. Wobec szczepów PRSP można stosować cefalosporyny III generacji (należy jednak sprawdzić oporność) oraz amoksycylinę w podwójnych dawkach.
W Polsce około 20% szczepów jest opornych, a 10% średnio wrażliwych na antybiotyki tej klasy, przy czym liczba szczepów opornych wzrasta[24].
Oporność na inne antybiotyki
Poza penicylinami dwoinka zapalenia płuc może być oporna także na inne antybiotyki. W przypadku metylacji podjednostki rybosomu 23S RNA następuje zmiana miejsca, na które działają niektóre grupy antybiotyków – jest to fenotyp MLSB. Oznacza on krzyżową oporność na makrolidy, linkozamidy oraz streptograminę B. Najczęściej przyczyną jest gen ermB powodujący metylację adeniny w pozycji 2058. Brak wrażliwości na makrolidy jest klinicznie ważny, ponieważ ten lek ze względu na doskonałą penetrację do miąższu płucnego jest bardzo często stosowany w infekcjach dróg oddechowych.
Inny typ oporności polega na obecności pomp błonowych wypompowujących lek z komórki (fenotyp M). Opisano jeszcze oporność na kotrimoksazol oraz tetracykliny.
Szczepienia i oporność
Światowa Organizacja Zdrowia wprowadziła zalecenie przeprowadzania szczepień u dzieci, ze względu na narastające zjawisko oporności pneumokoków na antybiotyki. Dzieci od piątego roku życia można szczepić szczepionkami z otoczek polisacharydowych, które jednak nie są w stanie immunizować młodszych dzieci (będących w grupie zwiększonego ryzyka). U nich stosowane są bardziej kosztowne skoniugowane szczepionki białkowe.
Poza trwającą od 10 do 15 lat odpornością u zaszczepionych dzieci szczepionka może zmniejszyć liczbę szczepów lekoopornych oraz ograniczyć infekcje także u osób niezaszczepionych[25].
Wskazania do szczepienia przeciwko pneumokokom:
- wiek > 65 lat i mniej niż 6 lat
- przewlekłe choroby serca i płuc
- cukrzyca
- choroba alkoholowa
- zespół nerczycowy
- wrodzone lub nabyte niedobory odporności
- asplenia lub stan po splenektomii
- chłoniak Hodgkina
- wyciek płynu mózgowo-rdzeniowego
- wszczepiony implant ślimakowy.
Przebycie infekcji gwarantuje odporność wyłącznie do szczepu serologicznego będącego przyczyną infekcji.
Szczepienia w Anglii
W lutym 2006 podjęto w Anglii decyzję o rozpoczęciu programu szczepień przeciwko pneumokokom u dzieci. Szczepienia rozpoczęły się we wrześniu 2006 roku, przeprowadzane są szczepionką skojarzoną u dzieci w wieku 2, 4 i 13 miesięcy.
Szczepienia w Stanach Zjednoczonych
Amerykańska Agencja Żywności i Leków dopuściła pierwszą siedmiowalentną szczepionkę skojarzoną przeciwko zakażeniu pneumokokowemu do stosowania u niemowląt i małych dzieci (PCV 7) – Prevnar (producent: Wyeth Lederle), która ma zapobiegać posocznicy i zapaleniu opon mózgowo-rdzeniowych wywołanych przez S. pneumoniae. Prevnar jest polecany od 2000 roku do stosowania u wszystkich dzieci w wieku 2–24 miesiące, oraz u dzieci ryzyka w wieku 24–56 miesięcy. W normalnych warunkach stosuje się cztery kolejne dawki szczepionki, które podaje się w 2., 4., 6. i 12.-15. miesiącu życia. Prevnar chroni w dobrym stopniu przeciwko głębokim zakażeniom pneumokokowym takim jak zapalenie płuc i opon mózgowo-rdzeniowych. W fazie testowania są szczepionki 9 walentne.
W Stanach Zjednoczonych stwierdza się w ciągu roku 16 000 posocznic pneumokokowych oraz 1400 zapaleń opon mózgowo-rdzeniowych o tej samej etiologii. W badaniach wykonanych w Kaiser Permanente w Północnej Kalifornii, Prevnar w 100% zapobiegał zakażeniu siedmioma szczepami (serotypy: 4, 6B, 9V, 14, 18C, 19F i 23F) S. pneumoniae znajdującymi się w szczepionce oraz w 90% zakażeniom wywołanym przez wszystkie szczepy S. pneumoniae.
Dostępna w USA i UE szczepionka Prevenar 13 firmy Wyeth Lederle zapobiega zakażeniu trzynastoma serotypami (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F i 23F) S. pneumoniae. Schemat szczepień jest taki sam jak w przypadku szczepionki Prevenar z siedmioma serotypami[26].
Nowszą jest Pneumovax 23 (PPS-23) przeciwko 23 serotypom (1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, and 33F), jak również 98 % typów w zakażeniu krwi bakteriami pneumokokami.[27]
W USA i UE dopuszczona jest również szczepionka firmy GlaxoSmithKline o nazwie Synflorix, która zapewnia ochronę przed dziesięcioma szczepami pneumokoków (serotypy 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F i 23F). Badania kliniczne wykazały jej większą niż Prevenar 7 skuteczność w zapobieganiu ostrego zapalenia ucha środkowego wywołanego pneumokokami u dzieci. Schemat szczepień jest identyczny jak w przypadku pozostałych szczepionek przeciw pneumokokom[28].
Przypisy
- ↑ Fraenkel-Weichselbaum diplococcus w bazie Who Named It (ang.)
- ↑ del Castillo Martín F., Lodoso Torrecilla B., Baquero Artigao F., García Miguel MJ., de José Gómez MI., Aracil Santos J., Méndez Echevarría A. [Increase in the incidence of bacterial pneumonia between 2001 and 2004]. „An Pediatr (Barc)”. 2 (68), s. 99–102, luty 2008. PMID: 18341873.
- ↑ Edward Klein. Micro-organisms and diseases. „Practitioner”. 32, s. 321–352, 1884.
- ↑ Frederick Dixon Chester: A manual of determinative bacteriology. Londyn: Macmillan & co., 1901, s. 63–64.
- ↑ Skerman, V. B. D., McGowan, V., Sneath, P. H. A. Approved Lists of Bacterial Names. „International Journal of Systematic Bacteriology”. 30 (1), s. 368, Jan 1980.
- ↑ Avery OT, MacLeod CM, and McCarty M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types. „J Exp Med”. 79, s. 137–158, 1944.
- ↑ Lederberg J., Avery OT., MacLeod CM., McCarty M. The transformation of genetics by DNA: an anniversary celebration of Avery, MacLeod and McCarty (1944). „Genetics”. 2 (136), s. 423–426, luty 1994. PMID: 8150273.
- 1 2 3 Mikrobiologia i choroby zakaźne. Gabriel Virella. Wydanie I polskie. ISBN 83-85842-59-4. Strona 124-126.
- 1 2 3 Włodzimierz Kędzia: Diagnostyka mikrobiologiczna Włodzimierz Kędzia. Warszawa: Państwowy Zakład Wydawnictw Lekarskich, 1980, s. 43–55. ISBN 83-200-0204-4.
- ↑ Pericone CD., Overweg K., Hermans PW., Weiser JN. Inhibitory and bactericidal effects of hydrogen peroxide production by Streptococcus pneumoniae on other inhabitants of the upper respiratory tract. „Infect Immun”. 7 (68), s. 3990–3997, lipiec 2000. PMID: 10858213.
- ↑ Barocchi MA., Ries J., Zogaj X., Hemsley C., Albiger B., Kanth A., Dahlberg S., Fernebro J., Moschioni M., Masignani V., Hultenby K., Taddei AR., Beiter K., Wartha F., von Euler A., Covacci A., Holden DW., Normark S., Rappuoli R., Henriques-Normark B. A pneumococcal pilus influences virulence and host inflammatory responses. „Proc Natl Acad Sci U S A”. Feb 21;103. 8, s. 2857–2862, 2006. DOI: 10.1073/pnas.0511017103. PMID: 16481624.
- ↑ Chen CJ., Huang YC., Su LH., Lin TY. Nasal carriage of Streptococcus pneumoniae in healthy children and adults in northern Taiwan. „Diagn Microbiol Infect Dis”. 3 (59), s. 265–269, listopad 2007. DOI: 10.1016/j.diagmicrobio.2007.05.012. PMID: 17900847.
- ↑ Nyandiko WM., Greenberg D., Shany E., Yiannoutsos CT., Musick B., Mwangi AW. Nasopharyngeal Streptococcus pneumoniae among under-five year old children at the Moi Teaching and Referral Hospital, Eldoret, Kenya. „East Afr Med J”. 4 (84), s. 156–162, kwiecień 2007. PMID: 17894249.
- ↑ Jacoby P., Watson K., Bowman J., Taylor A., Riley TV., Smith DW., Lehmann D. Modelling the co-occurrence of Streptococcus pneumoniae with other bacterial and viral pathogens in the upper respiratory tract. „Vaccine”. Mar 22;25. 13, s. 2458–2464, 2007. DOI: 10.1016/j.vaccine.2006.09.020. PMID: 17030494.
- ↑ Elżbieta Loba-Jakubowska, Jolanta Frasunkiewicz, Danuta Chlebna-Sokół. Etiologia i przebieg kliniczny zapalenia opon mózgowo-rdzeniowych u dzieci - obserwacje własne. „Przegląd epidemiologiczny”. 57 (4), s. 613-618, 2003.
- ↑ Kallel H., Mâaloul I., Mahjoubi F., Dammak H., Ghorbel H., Chelly H., Ksibi H., Ben Hamida C., Rekik N., Ben Jemaa M., Hammami A., Bouaziz M. [Prognostic factors of pneumococcal meningitis. Retrospective study of 31 cases]. „Tunis Med”. 8 (85), s. 692–696, sierpień 2008. PMID: 18254294.
- ↑ Oksenhendler E., Gérard L., Fieschi C., Malphettes M., Mouillot G., Jaussaud R., Viallard JF., Gardembas M., Galicier L., Schleinitz N., Suarez F., Soulas-Sprauel P., Hachulla E., Jaccard A., Gardeur A., Théodorou I., Rabian C., Debré P., Fieschi C., Malphettes M., Galicier L., Georgin S., Fermand JP., Viallard JF., Jaccard A., Hoarau C., Lebranchu Y., Bérezné A., Mouthon L., Karmochkine M., Schleinitz N., Durieu I., Nove-Josserand R., Chanet V., Le-Moing V., Just N., Salanoubat C., Jaussaud R., Suarez F., Hermine O., Solal-Celigny P., Hachulla E., Condette-Wojtasik G., Sanhes L., Gardembas M., Pellier I., Tisserant P., Pavic M., Bonnotte B., Haroche J., Amoura Z., Alric L., Thiercelin MF., Tetu L., Adoue D., Bordigoni P., Perpoint T., Sève P., Rohrlich P., Pasquali JL., Soulas-Sprauel P., Couderc LJ., Giraud P., Baruchel A., Deleveau I., Chaix F., Donadieu J., Tron F., Larroche C., Blanc AP., Masseau A., Hamidou M., Debré P., Schmitt C., Le Garff-Tavernier M., Faideau B., Mkada H., Mouillot G., Théodorou I., Rabian C., Carmagnat M., Fieschi C., Malphettes M., Vince N., Georgin S., De Gouvello A., Gardeur A., Gérard L. Infections in 252 patients with common variable immunodeficiency. „Clin Infect Dis”. May 15;46. 10, s. 1547–1554, 2008. DOI: 10.1086/587669. PMID: 18419489.
- ↑ Gill CJ., Mwanakasale V., Fox MP., Chilengi R., Tembo M., Nsofwa M., Chalwe V., Mwananyanda L., Mukwamataba D., Malilwe B., Champo D., Macleod WB., Thea DM., Hamer DH. Impact of human immunodeficiency virus infection on Streptococcus pneumoniae colonization and seroepidemiology among Zambian women. „J Infect Dis”. Apr 1;197. 7, s. 1000–1005, 2008. DOI: 10.1086/528806. PMID: 18419536.
- ↑ Fuentes-Ferrer ME., Cano-Escudero S., Mato-Chaín G., Mariano-Lázaro A., Fereres-Castiel J. [Vaccination coverage against Streptococcus pneumoniae in splenectomized patients in a fourth-level hospital (1999–2004).]. „Enferm Infecc Microbiol Clin”. 4 (26), s. 194–198, kwiecień 2008. PMID: 18381038.
- ↑ Konradsen HB., Rasmussen C., Ejstrud P., Hansen JB. Antibody levels against Streptococcus pneumoniae and Haemophilus influenzae type b in a population of splenectomized individuals with varying vaccination status. „Epidemiol Infect”. 2 (119), s. 167–174, październik 1997. PMID: 9363015.
- ↑ Polski serwis antybiotykowy. infekcje.com.pl. [zarchiwizowane z tego adresu (2008-04-15)]..
- ↑ Charles PG., Whitby M., Fuller AJ., Stirling R., Wright AA., Korman TM., Holmes PW., Christiansen KJ., Waterer GW., Pierce RJ., Mayall BC., Armstrong JG., Catton MG., Nimmo GR., Johnson B., Hooy M., Grayson ML., Charles P., Grayson L., Pierce R., Mayall B., Johnson P., Whitby M., Armstrong J., Nimmo G., Munckhof W., Looke D., Garske L., Playford G., Fuller A., Stirling R., Spelman D., Kotsimbos T., Holmes P., Korman T., Bardin P., Waterer G., Christiansen K., Heath C., Wright A., Catton M., Birch C., Druce J., Norbert R., Irving L., Hart D. The etiology of community-acquired pneumonia in Australia: why penicillin plus doxycycline or a macrolide is the most appropriate therapy. „Clin Infect Dis”. May 15;46. 10, s. 1513–1521, 2008. DOI: 10.1086/586749. PMID: 18419484.
- ↑ Maria Lucyna Zaremba, Jerzy Borowski: Mikrobiologia lekarska. Podręcznik dla studentów medycyny. Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 288. ISBN 83-200-2896-5.
- ↑ Koiuszko S., Białucha A., Gospodarek E. [The drug susceptibility of penicillin-resistant Streptococcus pneumoniae]. „Med Dosw Mikrobiol”. 59. 4, s. 293–300, 2008. PMID: 18416121.
- ↑ McClure CA., Ford MW., Wilson JB., Aramini JJ. Pneumococcal conjugate vaccination in Canadian infants and children younger than five years of age: Recommendations and expected benefits. „Can J Infect Dis Med Microbiol”. 1 (17), s. 19–26, styczeń 2008. PMID: 18418479.
- ↑ Centrum Informacji o Leku – Indeks leków – EPAR. leki-informacje.pl. [zarchiwizowane z tego adresu (2012-05-02)]..
- ↑ Package Insert - Pneumovax 23. US Food and Drug Administration. 2019
- ↑ Centrum Informacji o Leku – Indeks leków – EPAR. leki-informacje.pl. [zarchiwizowane z tego adresu (2012-07-19)]..
Bibliografia
- Leon Jabłoński (red): Podstawy Mikrobiologii Lekarskiej. Warszawa: PZWL, 1979, s. 204–223. ISBN 83-200-0181-1.
- Danuta Dzierżanowska: Antybiotykoterapia praktyczna. s. 272–280. ISBN 978-83-7522-013-1.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.