Dostępność farmaceutyczna – mierzona w warunkach laboratoryjnych ilość substancji czynnej uwalnianej z preparatu farmaceutycznego i rozpuszczającej się w otaczającym go płynie ustrojowym. Parametr ten określa również szybkość procesu uwalniania. Jest to wartość opisująca pierwszy etap w układzie przemian leku w ustroju (LADME). Wyraża się ją jako procent lub ułamek dawki leku, jaki rozpuścił się w płynie odbiorczym w określonym czasie (np. 90% w ciągu 15 minut).
Dostępność farmaceutyczna charakteryzuje jakość leku.
Uwalnianie substancji czynnej z leku
Etap uwalniania substancji czynnej do otaczających farmaceutyk płynów ustrojowych jest kluczowy dla skuteczności terapii lekiem. Tylko substancja uwolniona z danej postaci leku i rozpuszczona może być wchłaniana i może wywierać swoje działanie farmakologiczne. Leki muszą być zatem skonstruowane tak, aby odpowiednia ilość substancji leczniczej mogła się z nich wydostać.
Czynniki wpływające na szybkość uwalniania
Szybkość i stopień uwalniania substancji aktywnej zależy przede wszystkim od postaci leku. Inaczej uwalnia się lek z czopka, a inaczej z tabletki, czy maści. Na proces uwalniania wpływają też zastosowane substancje pomocnicze oraz metoda sporządzania leku. Fakt ten może być wykorzystywany do modyfikowania uwalniania substancji leczniczej z leku. Przez dodatek odpowiednich substancji pomocniczych uzyskuje się między innymi leki o przedłużonym uwalnianiu (np. transdermalne systemy terapeutyczne) albo leki uwalniające substancję czynną w określonym miejscu, na przykład w jelicie (tabletki dojelitowe).
Do czynników fizykochemicznych wpływających na szybkość uwalniania zaliczamy:
- rozpuszczalność substancji leczniczej – im większa rozpuszczalność tym szybsze uwalnianie
- powierzchnię kontaktu substancji leczniczej z otaczającym płynem – im większa powierzchnia tym szybsze uwalnianie, zatem substancja uwolni się szybciej z granulatu niż z tabletki.
- stopień rozdrobnienia substancji leczniczej – im większy tym szybsze uwalnianie
- współczynnik podziału olej–woda
- struktura krystaliczna substancji leczniczej
- rodzaj płynu, w którym uwalnia się substancja lecznicza (płynu odbiorczego)
Inne czynniki wpływające na szybkość uwalniania to:
- szybkość rozpadu lub deformacji leku
- przenikalność substancji aktywnej do krwiobiegu (jeśli substancja łatwo przenika do krwi, jej stężenie w okolicach leku zmniejsza się i proces uwalniania może zachodzić szybciej)
- obecność substancji modyfikujących uwalnianie, na przykład związków powierzchniowo czynnych, ułatwiających rozpuszczanie substancji leczniczej
Rozpuszczalność substancji leczniczej
Rozpuszczalność jest jednym z najważniejszych czynników decydujących o dostępności farmaceutycznej leku. Jeśli substancja lecznicza słabo rozpuszcza się w wodzie, dąży się do zwiększenia jej rozpuszczalności. Można to osiągnąć następującymi sposobami:
- zmieniając pH roztworu, na przykład przez dodanie do leku buforów łatwo rozpuszczalnych w wodzie i tworzących w otoczeniu leku pH sprzyjające rozpuszczaniu
- modyfikując cząsteczkę substancji leczniczej chemicznie. Niektóre zmiany w budowie chemicznej nie wpływają na działanie farmakologiczne, a jedynie zmieniają właściwości fizykochemiczne cząsteczki. Popularnym sposobem zwiększenia rozpuszczalności przez modyfikację chemiczną jest przyłączenie do cząsteczki dodatkowych grup -OH.
- kompleksując substancję leczniczą związkami hydrofilowymi
- dodając współrozpuszczalnik (kosolwent), czyli dodatkowy rozpuszczalnik, mieszający się z wodą. Jeśli w tym drugim rozpuszczalniku substancja lecznicza rozpuszcza się lepiej niż w wodzie, będzie się również lepiej rozpuszczać w mieszaninie kosolwentu i wody. Współrozpuszczalnikiem odpowiednim dla wielu leków jest etanol.
- dodając solubilizatory, czyli substancje hydrofilne tworzące z substancją leczniczą mieszaniny lepiej rozpuszczalne w danym rozpuszczalniku. Solubilizatorami mogą być na przykład substancje powierzchniowo czynne.
Mechanizm uwalniania
Proces uwalniania składa się najczęściej z dwóch etapów: rozpadu lub deformacji preparatu farmaceutycznego oraz rozpuszczania substancji czynnej. Dopiero po rozpuszczeniu może nastąpić wchłanianie.
Mechanizm uwalniania substancji leczniczej z preparatu jest jednak różny dla różnych postaci leku.
Postaci doustne
Tabletki o szybkim uwalnianiu rozpadają się w żołądku i substancja czynna rozpuszcza się w płynie wypełniającym żołądek. Tabletki o modyfikowanym uwalnianiu mogą natomiast uwalniać substancję czynną na różne sposoby, przez:
- rozpuszczanie jej w niewielkiej objętości płynu, dostającego się do wnętrza tabletki
- dyfuzję na zewnątrz substancji rozpuszczonej uprzednio we wnętrzu tabletki
- dyfuzję substancji czynnej wymuszoną ciśnieniem osmotycznym
- dyfuzję substancji czynnej następującą na skutek wymiany jonów wnętrza tabletki z otaczającym środowiskiem
- powolne wydostawanie się substancji czynnej przez otwór dozujący.
Postaci dopochwowe, doodbytnicze i docewkowe
Pierwszym etapem uwalniania substancji leczniczej z czopków jest ich deformacja. Jeśli czopek jest wykonany na podłożu lipofilowym, deformacja polega na jego stopieniu się. Jeśli podłoże jest hydrofilowe, czopek rozpuszcza się w otaczającym go płynie. Po deformacji rozpuszcza się i przenika do krwi substancja czynna.
Metody badania dostępności farmaceutycznej
Określenie dostępności farmaceutycznej jest jednym z niezbędnych elementów charakteryzacji leku wprowadzanego na rynek. Badania dostępności przeprowadza się obowiązkowo dla tabletek, kapsułek i przezskórnych systemów terapeutycznych. Wskazane jest określanie dostępności także dla zawiesin, czopków i maści, które mają wywierać działanie ogólnoustrojowe – jednak ze względów ekonomicznych i metodycznych badania czopków i maści prowadzi się rzadko. Duży nacisk kładzie się natomiast na badania postaci doustnych, przede wszystkim tabletek i kapsułek.
Dostępność farmaceutyczną bada się dla nowych leków oraz dla leków generycznych. Określenie różnic w dostępności leku oryginalnego i generycznego jest podstawowym badaniem porównawczym i decyduje o możliwości wprowadzenia generyku do obrotu.
Metodologia badań dostępności farmaceutycznej
Badania dostępności farmaceutycznej przeprowadza się w warunkach in vitro, w specjalnych aparatach przeznaczonych do tego celu. Warunki badania określają odpowiednie przepisy i zalecenia zawarte w farmakopeach.
Badanie dostępności farmaceutycznej tabletek
Badanie to polega na umieszczeniu tabletki w odpowiednim płynie odbiorczym, a następnie określaniu stężenia uwolnionej substancji czynnej w zadanych odstępach czasu. Na podstawie badań wyznacza się krzywą zależności uwalniania substancji leczniczej od czasu (zwaną niekiedy profilem uwalniania) i kinetykę tego procesu.

Objętość płynu odbiorczego musi być tak dobrana, by roztwór, który utworzyłby się przez rozpuszczenie 100% substancji aktywnej zawartej w badanej tabletce, nie miał zbyt dużego stężenia. Stężenie roztworu po rozpuszczeniu całej substancji leczniczej nie może być większe niż 20% stężenia roztworu nasyconego. Jeśli więc stężenie roztworu nasyconego danej substancji leczniczej wynosi 15%, maksymalne stężenie możliwe do osiągnięcia w aparacie do badania dostępności nie może być większe niż 3% (stężenie procentowe substancji równe 3% odpowiada dwudziestu procentom stężenia roztworu nasyconego). W związku z tym do badania tabletki zawierającej 0,5 g tej substancji należy użyć co najmniej 16,17 g płynu odbiorczego. Takie warunki rozpuszczania substancji leczniczej określa się terminem „warunki sink”. W praktyce używa się znacznie większych objętości odnośnego płynu.
Aparat łopatkowy
Aparat łopatkowy służy do badania tabletek, najczęściej szybko uwalniających lek. Składa się ze zlewki o zaokrąglonym dnie i pojemności 1 l i zanurzonego w nim mieszadła. Prędkość obrotów mieszadła wynosi 50–100 obr./min. Do zlewki wprowadza się zazwyczaj 500 ml[1] (±1%) płynu odbiorczego. Płynem tym jest najczęściej kwas solny o stężeniu 0,1 mol/l (pH = 1) lub bufor fosforanowy o pH równym 6,8. Badanie przeprowadza się w temperaturze 37 °C (±0,5).
Aparat koszyczkowy
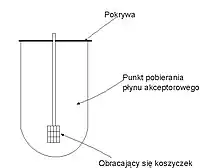
Aparat koszyczkowy służy do badania tabletek unoszących się na powierzchni płynu, kapsułek i tabletek wolno rozpadających się. Składa się ze zlewki o zaokrąglonym dnie i pojemności 1 l i zanurzonego w nim, obracającego się koszyczka. W koszyczku tym umieszcza się badany lek w taki sposób, że nie może się on wydostać, a jednocześnie płyn odbiorczy ma do niego swobodny dostęp. Prędkość obrotów koszyczka wynosi 100 obr./min. Do zlewki wprowadza się zazwyczaj 500 ml[1] (±1%) płynu odbiorczego. Płynem tym jest najczęściej kwas solny o stężeniu 0,1 mol/l (pH = 1) lub bufor fosforanowy o pH równym 6,8. Badanie przeprowadza się w temperaturze 37 °C (±0,5).
Aparat przepływowy
Aparat przepływowy służy do badania leków zawierających substancje trudno rozpuszczalne w wodzie, zawiesin i mikrosfer. Składa się z komory o pojemności 8–18 ml, w której umieszcza się badany lek. Przez komorę tę przepływa, z ustaloną szybkością, płyn odbiorczy. W aparacie tym można łatwo zmieniać płyn w trakcie badania, co lepiej imituje warunki, z jakimi spotyka się tabletka w organizmie ludzkim, przemieszczając się z żołądka do jelit. Badanie przeprowadza się w temperaturze 37 °C (±0,5).
Badanie dostępności farmaceutycznej czopków
Badania krzywej uwalniania substancji leczniczej z czopków nie są obowiązkowe, mimo że ich dostępność farmaceutyczna jest zmienna i wrażliwa na wiele czynników. Wpływa na nią, poza zastosowanymi substancjami leczniczymi, również technologia produkcji.
Czopki bada się w aparacie przepływowym. Jego główna część – komora przepływowa – składa się z dwóch podłużnych naczyń, połączonych wąską rurką szklaną. Przez naczynia przepływa ze stałą szybkością płyn odbiorczy, o stałej temperaturze. Drugie naczynie jest zakończone filtrem, zatrzymującym stopione podłoże. W jednym naczyniu umieszcza się czopek, a w drugim zbiera się podłoże. Wszystkie elementy aparatu muszą mieć w czasie badania stałą temperaturę, na poziomie 37 °C (±0,5). W trakcie badania pobiera się, w określonych odstępach czasu, płyn odbiorczy przepływający przez komorę z czopkiem i oznacza w nim stężenie substancji czynnej.

Oprócz badania szybkości i krzywej uwalniania substancji leczniczej z czopków (opisanego powyżej) należy wyznaczyć czas całkowitej deformacji w temperaturze 37 °C. Badanie takie przeprowadza się w aparacie składającym się ze szklanej rurki z przewężeniem, umieszczonej w wodzie o stałej temperaturze. Do rurki wlewa się 5 lub 10 ml wody, a następnie badany czopek umieszcza się w rurce tak, żeby oparł się na przewężeniu, i obciąża się go szklanym prętem. Czas deformacji mierzy się od momentu obciążenia czopka do obsunięcia się pręta do pozycji zerowej, to jest takiej, jakby pręt włożony był do pustej rurki. Pręt obsunie się całkowicie dopiero po całkowitej deformacji czopka. Według Farmakopei Polskiej całkowity czas deformacji powinno się oznaczać dla trzech egzemplarzy. Czas ten nie powinien być dłuższy niż 15 minut, dla wszystkich badanych sztuk.
Badanie dostępności farmaceutycznej maści
Wyznaczanie dostępności farmaceutycznej maści nie jest obowiązkowe dla wszystkich produktów, ale zalecane ze względu na duże rozbieżności w dostępności różnych preparatów.
Badania dostępności farmaceutycznej maści polegają na ocenie zdolności dyfuzji substancji leczniczej z podłoża przez membranę, do wody lub odpowiedniego roztworu (płynu odbiorczego). Ściśle określoną ilość maści umieszcza się w komorze do tego przeznaczonej i przykrywa membraną. Membranami używanymi do tego typu badań są najczęściej błony wykonane z polimerów celulozy, błony celofanowe lub nylonowe. Zastosowana błona nie powinna wpływać na szybkość uwalniania. Błona nie może też absorbować na swojej powierzchni ani substancji czynnej, ani żadnych innych składników maści i płynu odbiorczego – jej zadaniem jest jedynie powstrzymywanie mieszania się maści z płynem i zapobieganie zmienności powierzchni uwalniania. Nasączenie błony mirystynianem izopropylu powoduje, że wyniki badań lepiej korelują z uwalnianiem z maści w warunkach naturalnych (in vivo). Nad komorą z maścią znajduje się komora z płynem odbiorczym, którym jest najczęściej woda, izotoniczny roztwór NaCl (o stężeniu 0,9%) lub odpowiedni bufor. Objętość płynu odbiorczego musi być tak dobrana, aby zachowane były warunki sink (patrz sekcja: Badanie dostępności farmaceutycznej tabletek). Aparat powinno się umieścić w specjalnej wytrząsarce, tak, aby płyn był stale mieszany. Podczas badania pobiera się, w określonych odstępach czasu, płyn odbiorczy z komory i oznacza w nim stężenie substancji czynnej. Badanie przeprowadza się w temperaturze 37 °C (±0,5), przez co najmniej 6 godzin, pobierając próbki płynu w co najmniej 5 punktach czasowych (5 razy).
Badanie dostępności farmaceutycznej maści można również prowadzić w innych aparatach:
- aparat łopatkowy z komorą ekstrakcyjną, gdzie na dnie zlewki z płynem odbiorczym umieszcza się komorę z maścią pokrytą membraną
- komora dyfuzyjna Franza, w której maść znajduje się na błonie przykrywającej komorę z niewielką objętością płynu, mieszanego za pomocą mieszadła magnetycznego. Aparat taki daje możliwość badania dostępności w różnych warunkach aplikacji leku – na przykład warstewkę maści można odkryć i badać, jak zmienia się szybkość uwalniania substancji czynnej w trakcie odparowywania niektórych zawartych w maści składników. Do badań w tym aparacie można użyć wycinków naturalnej skóry zamiast sztucznej membrany, co daje lepszą korelację wyników z faktyczną dostępnością biologiczną leku.
Wyznaczona w badaniach in vitro dostępność farmaceutyczna maści stosunkowo słabo koreluje z faktyczną dostępnością maści w warunkach in vivo. Jednak badania dostępności farmaceutycznej są dobrym sprawdzianem jakości i powtarzalności produkcji.
Znaczenie dostępności farmaceutycznej
Wyniki badań dostępności farmaceutycznej, prowadzone w warunkach laboratoryjnych (in vitro), nie zawsze odzwierciedlają zachowanie się leku w organizmie ludzkim (in vivo). W związku z tym, dla określenia jakości leku i przewidywania jego skuteczności terapeutycznej, badania dostępności farmaceutycznej są niewystarczające. Badania te nie uwzględniają wpływu rozmaitych czynników obecnych w organizmie, zmieniających uwalnianie i wchłanianie substancji leczniczej. Do czynników tych należą między innymi:
- zmienny czas przebywania leku w przewodzie pokarmowym
- wahania pH soku żołądkowego, uzależnione od spożywanych pokarmów i współistniejących chorób
- interakcje z innymi lekami i z pożywieniem
- obecność enzymów trawiennych
- ograniczona objętość płynów, w których rozpuszcza się lek (np. płynu w odbytnicy, niezbędnego do rozpuszczania czopków)
- motoryka przewodu pokarmowego
- choroby zmieniające wchłanianie, choroby skóry.
Uboga, ale stosunkowo prosta, metodyka badań in vitro ma, mimo wszystko, swoje zalety. Głównym celem badań tego typu jest określanie powtarzalności procesu technologicznego sporządzania leków oraz, szybkie i tanie, wstępne porównywanie różnych preparatów farmaceutycznych. Badania dostępności farmaceutycznej pozwalają bez większych nakładów finansowych i bez powodowania zagrożenia dla ludzi (przez podawanie im badanych leków) kontrolować jakość wytwarzanych produktów.
Niemniej jednak dąży się do jak największego zbliżenia warunków badań laboratoryjnych, do warunków faktycznie panujących w miejscach podawania leków. Osiąga się to przez modyfikacje metodologii badań i wprowadzania do nich elementów biologicznych (np. wycinki skóry zamiast sztucznych błon w badaniu dostępności maści). Stopień korelacji wyników otrzymywanych w warunkach in vitro do wyników in vivo (w skrócie IVIV) zależy również od postaci leku. Dobrą korelację IVIV otrzymuje się dla transdermalnych systemów terapeutycznych i innych postaci o przedłużonym oraz kontrolowanym uwalnianiu. Dobrą korelację wykazują również substancje lecznicze słabo rozpuszczalne w wodzie, ale dobrze przenikające przez membrany biologiczne (grupa II w klasyfikacji BCS), niezależnie od postaci, w jakiej są podane.
Przypisy
- 1 2 European Medicines Agency – System/website unavailable [online], www.emea.europa.eu [dostęp 2018-05-19] (ang.).
Bibliografia
- Stanisław Janicki, Małgorzata Sznitowska, Waldemar Zieliński: Dostępność farmaceutyczna i dostępność biologiczna leków. Warszawa: Ośrodek Informacji Naukowej „Polfa”, 2001. ISBN 83-914984-1-7.
- Stanisław Janicki, Adolf Fiebig, Małgorzata Sznitowska, Teresa Achmatowicz: Farmacja stosowana: podręcznik dla studentów farmacji. Warszawa: Wyd. Lekarskie PZWL, 2003. ISBN 83-200-2847-7.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.