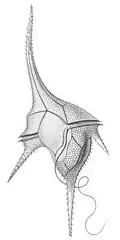
 Ceratium hirundinella (rys. Ernsta Haeckla) | |||||
| Systematyka[1] | |||||
| Domena | |||||
|---|---|---|---|---|---|
| Supergrupa | |||||
| Królestwo | |||||
| Gromada |
Miozoa | ||||
| Klasa |
Dinophyceae (bruzdnice) | ||||
| Rząd |
Gonyaulacales | ||||
| Rodzina |
Ceratiaceae | ||||
| Rodzaj |
Ceratium | ||||
| Gatunek |
Ceratium hirundinella | ||||
| Nazwa systematyczna | |||||
| Ceratium hirundinella (O.F.Müll.) Dujard. 1841: 377 Histoire naturelle des Zoophytes, Infusoires, comprenant la physiologie et la clasification de ces animaux et la manière de les étudier à l'aide du microscope. pp. i-xii, 1-684. Paris: Librarie Encyclopédique de Roret[2]. | |||||
| |||||
Ceratium hirundinella – gatunek bruzdnic występujących w różnych typach wód na całym świecie.
Budowa
Gatunek bardzo zmienny morfologicznie. Organizm jednokomórkowy, o kształcie niesymetrycznym, silnie spłaszczony grzbietobrzusznie, ale z wyraźnymi kolcami (rogami). Komórki o długości od 40 do 450 μm i szerokości 30-75 μm[3]. Przyjmuje się, że przeciętna objętość małych osobników to 14 910 µm³, a dużych 58 755 µm³[4]. Róg apikalny jest długi, wąski i prosty, na szczycie otwarty i ścięty[3] oraz otoczony wieńcem drobnych kolców[5]. Z kolei rogi postekwatorialne (tylne) (dwa lub trzy) są zamknięte i zaostrzone, a przy tym mogą być wygięte lub proste[3]. Najdłuższy z nich, antapikalny, jest ustawiony ku tyłowi, czasem nieco w lewo. Prawy jest krótszy, ustawiony równolegle do apikalnego lub odgięty, a lewy najkrótszy (a czasem nieobecny) i odgięty[5]. Pancerzyk zbudowany jest z celulozy[6]. Tworzy go 16 siatkowanych tarczek, czasem mających drobne kolce. Na dość szerokim wieczku znajduje się pięć tarczek okrężnych górnych (preekwatorialnych) przylegających do bruzdy okrężnej – prawie kolistej lub skręconej – oraz cztery tarczki szczytowe (apikalne), tworzące róg apikalny. Wszystkie tarczki apikalne mają podobny rozmiar i sięgają do końca rogu. Z drugiej strony, na denku, do bruzdy okrężnej przylega 5 tarczek okrężnych dolnych (postekwatorialnych). Mniejsze rogi tylne są wypustkami tarczek okrężnych. Róg główny tylny tworzą dwie tarczki antapikalne. Bruzda brzuszna sięga tyłu komórki, nachodząc na wieczko[3].
Protoplast wchodzi również do wnętrza rogów. Dość liczne, płytkowate chloroplasty są żółte do żółtobrązowych[3], jako że zawierają oprócz chlorofili a i c fikopirynę i perydyninę[6]. Jądro komórkowe umieszczone mniej więcej w środku komórki, duże[3], o strukturze ziarnistej lub nitkowatej. Materiałem zapasowym jest skrobia i tłuszcze[6].
Ze względu na zmienność morfologiczną wyróżnia się kilka morfotypów, których przybieranie może zależeć od różnych czynników i niekoniecznie świadczą one o różnicach genetycznych. W Europie najczęstszy jest morfotyp gracile. Inne to m.in. austriacum, carinthiacum, piburgense, robustum czy scotticum. Różnią się między sobą typową wielkością, liczbą rogów antapikalnych, długością rogów, ich ustawieniem itp.[5]
Gatunki podobne
Podobnym gatunkiem jest Ceratium furcoides różniący się głównie bardziej smukłymi komórkami i tym, że jedna z tarczek apikalnych (4') jest krótsza od pozostałych, nie dochodząc do końca rogu[3]. Gatunek ten początkowo był wyróżniany jako odmiana C. hirundinella, a podobieństwo może sprawiać, że niektóre opisy odnoszące się do C. hirundinella w rzeczywistości dotyczą C. furcoides[5][7].
Biologia
Odżywianie
Jest gatunkiem miksotroficznym, odżywiając się m.in. okrzemkami, jednak lepiej rozwija się na świetle, mając możliwość fotosyntezy[6].
Brak wapnia upośledza rozwój komórek tego gatunku, ale nadmiar wapnia w stosunku do magnezu również jest dla nich szkodliwy. Do mikroelementów pobudzających wzrost należą żelazo i molibden, podczas gdy przeciwnie działają miedź i wanad. Wśród substancji niezbędnych do pozyskiwania ze środowiska jest witamina B12. Preferowanym źródłem azotu jest azotan sodu. Oprócz typowego dla glonów pobierania nieorganicznych fosforanów potrafi przyswajać fosfor ze związków organicznych. Optymalna temperatura to kilkanaście stopni Celsjusza[6].
Rozmnażanie i rozwój
U Ceratium hirundinella występują różne postacie i różne sposoby rozmnażania. Komórki żyjące w planktonie rozmnażają się przez podział. Płaszczyzna podziału przebiega ukośnie od lewej górnej strony do prawej dolnej, mniej więcej pod kątem 45° w stosunku do bruzdy okrężnej[8]. Podział zajmuje około trzech godzin i często zachodzi w drugiej połowie nocy. Osobniki dzielące się zwykle wybierają na ten czas górne warstwy wód jeziornych. W czasie podziału każda komórka potomna zachowuje połowę pancerzyka i odbudowuje resztę[6].
Latem i jesienią wewnątrz osobników planktonowych wytwarzają się grubościenne cysty spoczynkowe o kształcie podobnym do komórek rodzicielskich, ale z krótszymi wypustkami. Wydostają się one z komórki macierzystej i przez jakiś czas unoszą w planktonie. Jesienią opadają w pobliże dna, a wiosną są unoszone i kiełkują. Cysty łatwo mogą przeczepiać się do ciał ptaków i być przez nie przenoszone między zbiornikami wodnymi[6]. Niektóre cysty mogą przez kilka lat przetrwać zagrzebane w osadach[7]. Wewnątrz cysty przygotowującej się do kiełkowania powstaje komórka o cienkiej błonie oddzielającej ją od pancerzyka. Cystę opuszcza postać określana jako gymnoceratium. Jest ona w przybliżeniu elipsoidalna i bardzo ruchliwa. Po kilku lub kilkunastu godzinach przybiera ona kształt coraz bliższy stożkowi, a ściana stopniowo twardnieje. U formy praeceratium zaczynają powstawać kolce, a z czasem powstaje z niej forma dojrzała[6].
Formy z jedynie dwoma rogami tylnymi częściej pojawiają się wiosną[5]. Osobniki letnie są często krótsze niż wiosenne. Sezonowa zmienność morfologiczna osobników Ceratium hirundinella jest uważana za przykład cyklomorfozy[6].
Na początku XX wieku zaobserwowano procesy płciowe między osobnikami Ceratium hirundinella[8], ale później obserwacje te zostały podważone, choć potwierdzono je u innych gatunków rodzaju Ceratium[9].
Ekologia
Gatunek planktonowy. Występuje w wodach stojących i płynących o różnym rozmiarze i poziomie trofii[3]. Najbardziej odpowiadają mu wody mezotroficzne i eutroficzne[6]. Bywał podawany jako wskaźnik oligosaprobowości[10], ale jego masowe występowanie jest raczej wskaźnikiem eutrofizacji. Preferuje wody od odczynie zasadowym, co wiąże się z dość dużą zawartością wapnia (powyżej 20 mg/l) i małą kwasów humusowych[6].
Jest gatunkiem wykonującym w niektórych warunkach dobowe migracje pionowe. W ciągu dnia podpływa ku powierzchni wody (fototaksja dodatnia), podczas gdy nocą obniża poziom przebywania. W przypadku silnego nasłonecznienia unika jednak warstw najbliższych powierzchni, zapobiegając fotoinhibicji. Unika również stref przydennych w razie wystąpienia w nich deficytu tlenowego. Na rozmieszczenie populacji tego gatunku w zbiorniku wodnym oddziałują warunki wietrzne, także przez wpływ na prądy wznoszące. Niemniej część migracji odbywa się na zasadzie aktywnego przeciwdziałania prądom[11].
W jeziorach mazurskich Ceratium hirundinella konkuruje z sinicami planktonowymi, zwłaszcza Planktolyngbya limnetica, przez co okresy dominacji tych gatunków następują naprzemiennie[12]. W konkurencji z innymi glonami przewagę temu gatunkowi daje zdolność wykorzystywania fosforu w związkach organicznych[6].
Obecność kolczastych wyrostków utrudnia bycie zjadanym przez inne organizmy planktonowe[6]. Nie są one przeszkodą dla tak dużych organizmów, jak larwy wodzienia Chaoborus flavicans, dla których Ceratium hirundinella w pewnych warunkach może być głównym pokarmem[7]. Również niektóre wrotki i widłonogi są zdolne do ich schwytania. Z kolei filtratory z grupy wioślarek są z reguły za małe, żeby połknąć te bruzdnice, ale większe osobniki mogą je uszkodzić w trakcie filtrowania i jednocześnie uszkodzić swój aparat filtracyjny. Przy dużym zagęszczeniu wioślarek częściej spotykane są osobniki Ceratium hirundinella z odłamanymi rogami. W związku z tym w takich warunkach częściej występują osobniki z trzema niż dwoma rogami, co utrudnia bycie przypadkowo schwytanym przez filtratora[13]. Stwierdzono na nich pasożytowanie skoczkowców Chytriomyces elegans, które także odżywiają się saprotroficznie ich pancerzykami[14], oraz innych grzybów[7].
Notowany jest na prawie wszystkich kontynentach w różnych strefach klimatycznych. Zwykle podawany z wód słodkich, ale także z Morza Bałtyckiego czy Czarnego[1]. W Polsce powszechnie występuje w jeziorach przez cały rok, latem często stając się dominantem fitoplanktonu[12]. W jeziorach tatrzańskich również występuje, choć jest tam rzadszym gatunkiem[15]. Może wywoływać zakwity wody, mimo stosunkowo wolnego wzrostu, dzięki zdolności do aktywnego poruszania się w toni wodnej i tworzenia skupień[16].
Opis taksonomiczny
Jest to pierwszy opisany naukowo przedstawiciel bruzdnic[17]. Gatunek po raz pierwszy opisany w 1773 przez Ottona Friedricha Müllera, który uznał go za przedstawiciela orzęsków (Infusoria), nadając mu nazwę Bursaria hirundinella i ustanawiając taksonem typowym dla nowo utworzonego rodzaju Bursaria. Dwadzieścia lat później Franz de Paula von Schrank opisał nowy rodzaj Ceratium i gatunek Ceratium tetraceros. Za obowiązujący współcześnie opis uważa się dokonany przez Félixa Dujardina w 1841, który połączył opisy kilku wcześniej wyróżnianych gatunków pierwotniaków, w tym Bursaria hirundinella i Ceratium tetraceros, uznając je za opisy gatunku, który nazwał Ceratium hirundinella[1]. Epitet gatunkowy nawiązuje do łacińskiej nazwy jaskółki (hirundo) i ma związek z wypustkami, które Müllerowi przypominały tego ptaka[18].
Przypisy
- 1 2 3 M.D. Guiry, Ceratium hirundinella (O.F.Müller) Dujardin 1841 [online], AlgaeBase [dostęp 2020-06-29] (ang.).
- ↑ Félix Dujardin, Histoire naturelle des Zoophytes, Infusoires, comprenant la physiologie et la clasification de ces animaux et la manière de les étudier à l'aide du microscope [pdf], Paryż: Librarie Encyclopédique de Roret., 1841, s. 377-378 (fr.).
- 1 2 3 4 5 6 7 8 Joanna Picińska-Fałtynowicz, Jan Błachuta, Klucz do identyfikacji organizmów fitoplanktonowych z rzek i jezior dla celów badań monitoringowych części wód powierzchniowych w Polsce [pdf], Warszawa: Główny Inspektorat Ochrony Środowiska, 2012 (Biblioteka Monitoringu Środowiska), s. 52, ISBN 978-83-61227-05-2.
- ↑ PEG_BVOL2020 [xlsx], International Council for the Exploration of the Sea (ang.).
- 1 2 3 4 5 Family 1. Ceratiaceae, [w:] Øjvind Moestrup, António J. Calado, Dinophyceae, Springer Spektrum, 2018 (Süßwasserflora von Mitteleuropa, Bd. 6 - Freshwater Flora of Central Europe), s. 163-177, DOI: 10.1007/978-3-662-56269, ISBN 978-3-662-56268-0 (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 Danuta Krupa, Planktonowa bruzdnica Ceratium hirundinella (O. F. Mull.) Bergh. — gatunek wskaźnikowy dla postępującej eutrofizacji jezior, „Wszechświat”, 87 (1), 1986, s. 10-13.
- 1 2 3 4 Karin Rengefors, Anke Kremp, The ecology of freshwater dinoflagellates, [w:] Øjvind Moestrup, António J. Calado, Dinophyceae, Springer Spektrum, 2018 (Süßwasserflora von Mitteleuropa, Bd. 6 - Freshwater Flora of Central Europe), s. 27-36, DOI: 10.1007/978-3-662-56269, ISBN 978-3-662-56268-0 (ang.).
- 1 2 J.Z., Rozmnażanie się Ceratium hirundinella, „Wszechświat”, XXIII (36), 1904, s. 573-574.
- ↑ Lois A. Pfiester, Sexual Reproduction, [w:] David L. Spector (red.), Dinoflagellates, Orlando: Academic Press Inc, 1984, s. 182, ISBN 0-12-656520-1 (ang.).
- ↑ Kazimierz Karaffa-Korbutt, Higjena : kurs dla studentów, lekarzy, inżynierów i urzędników zdrowia publicznego, Wilno: Wydawnictwo Drukarni i Księgarni Józefa Zawadzkiego, 1932, s. 325.
- ↑ E. Frempong, A seasonal sequence of diel distribution patterns for the planktonic dinoflagellate Ceratium hirundinella in a eutrophic lake, „Freshwater Biology”, 14 (4), 1984, s. 401-421, DOI: 10.1111/j.1365-2427.1984.tb00163.x (ang.).
- 1 2 Józefa Półtoracka, Sezonowe zmiany planktonu roślinnego pięciu jezior okolic Węgorzewa, „Acta Societatis Botanicorum Poloniae”, XXXI (4), 1962, s. 667-681 (pol.).
- ↑ Andrea Bertolo i inni, Relationship between fish and the number of horns in Ceratium hirundinella (Dinophyceae): a food-web mediated effect on algal morphology?, „Journal of Phycology”, 46 (1), 2010, s. 33-40, DOI: 10.1111/j.1529-8817.2009.00775.x (ang.).
- ↑ The species of Chytriomyces: taxonomic descriptions, references and distribution, The University of Alabama [zarchiwizowane z adresu 2011-05-27] (ang.).
- ↑ Cecylia Szklarczyk-Gazdowa, Plankton roślinny niektórych stawów tatrzańskich, „Acta Societatis Botanicorum Poloniae”, XXIX (4), 1960, s. 597-624 (pol.).
- ↑ Barbara Kawecka, Pertti Vesa Eloranta, Zarys ekologii glonów wód słodkich i środowisk lądowych, Warszawa: Wydawnictwo Naukowe PWN, 1994, s. 184, ISBN 83-01-11320-0.
- ↑ Some highlights of the 200-year history of exploration of freshwater dinophlagellates, from O.F. Müller to Pieree Bourrelly, [w:] Øjvind Moestrup, António J. Calado, Dinophyceae, Springer Spektrum, 2018 (Süßwasserflora von Mitteleuropa, Bd. 6 - Freshwater Flora of Central Europe), s. 3, DOI: 10.1007/978-3-662-56269, ISBN 978-3-662-56268-0 (ang.).
- ↑ Otto Friedrich Müller, Vermium terrestrium et fluviatilium, seu animalium infusoriorum, helminthicorum et testaceorum, non marinorum, succincta historia [pdf], Kopenhaga, Lipsk: Heineck & Faber, 1773, s. 64 (łac.).