| Ranoidea raniformis[1] | |||
| (Keferstein, 1867) | |||
 | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Rząd | |||
| Podrząd | |||
| Rodzina | |||
| Podrodzina | |||
| Rodzaj | |||
| Gatunek |
australorzekotka różnobarwna | ||
| Synonimy | |||
| |||
| Kategoria zagrożenia (CKGZ)[3] | |||
 | |||
| Zasięg występowania | |||
 | |||
Australorzekotka różnobarwna (Ranoidea raniformis) – gatunek płaza bezogonowego z podrodziny Pelodryadinae w rodzinie Pelodryadidae. Zamieszkuje południową Australię, w tym Tasmanię, został introdukowany na Nowej Zelandii. Jego grzbiet ubarwiony jest na zielono i złoto z ciemnymi cętkami, brzuszna strona ciała jest żółta. Barwa niebieska pojawia się w okolicy pachwin i ud. Jego skóra wytwarza aureiny, peptydy o działaniu przeciwbakteryjnym i antynowotworowym. Bytuje w zbiornikach wodnych i ich okolicach, samce zwykle nawołują samice z wody. Wśród głównych zagrożeń dla gatunku wymienia się ryby z rodzaju Gambusia i epizoocję grzybiczą.
Systematyka
Gatunek ten ma długą historię, a jego systematyka i status podlegały zmianom. Został opisany przez Kefersteina w 1867 na podstawie osobnika pochodzącego z nieznanej lokalizacji. Badacz nadał mu nazwę naukową Chirodryas ranifiormis. 4 lata później zmienił jednak zdanie, uznając opisane przez siebie zwierzę za tożsame z Hyla aurea. W 1938 Parker zajął pogląd pośredni, uznając oba płazy za dwa podgatunki w 1 gatunku H. aurea. Umieszczano w nim też trzeci podgatunek H. a. cyclorhynchus, podniesiony potem do rangi odrębnego gatunku. Tymczasem w 1957 płaz typu australorzekotki różnobarwnej został opisany ponownie, znów jako odrębny gatunek, po badaniach krzyżowania się osobników. Opisu dokonał Copland, autor nazwy Hyla moorei. Wtedy też uczony ten wydzielił z H. aurea raniformis populację nazwaną przez siebie H. a. major[4].
Płaza cały czas umieszczano w obrębie rodzaju Hyla[4] i rodziny rzekotkowatych (Hylidae). Sytuację zmieniła rewizja taksonomiczna Tylera dokonana w 1971[5]. Badacz ten, wyciągając wnioski z odrębności mięśni worków powietrznych, zaproponował przeniesienie gatunków australijskich i papuaskich do rodzaju Litoria[4].
Przez pewien czas zwierzę to uznawano za podgatunek Litoria aurea, określając go jako Litoria aurea raniformis. Poglądowi temu sprzeciwili się w 1975 Courtice i Crigg, którzy opisali australorzekotkę różnobarwną jako osobny gatunek L. raniformis. W momencie jej publikacji Litoria moorei i Litoria cyclorhynchus uznawano już za odrębne gatunki, jednakże formy raniformis, ulongae i major wciąż traktowano jak podgatunki L. aurea. Uczeni ci zaproponowali uznanie za gatunek australorzekotki różnobarwnej i wyodrębnienie z niej również jako osobny gatunek Litoria flavipunctata. Pozostałe formy spotkał los wręcz przeciwny: L. a. ulongae zsynonimizowano z L. aurea, a L. a. major, różniącą się od L. a. raniformis tylko rozmiarami, z australorzekotką różnobarwną[4].
Budowa ciała
Osobnik dorosły mierzy 55–104 mm. Australorzekotka różnobarwna wyróżnia się bladym[6], zielonym pasmem biegnącym w połowie grzbietu zabarwionego zielono i złoto. Podobne pasmo występuje również u Litoria flavipunctata, nie ma go natomiast u Litoria aurea. Mogą się nań znajdować ciemne plamki i paski, czarne lub brązowe. Błona bębenkowa jest złota. W okolicy oka rozpoczyna się złoty pasek, zanikający w okolicy pachwiny, przebiegający grzbietowo-bocznie[4]. Pachwina przyjmuje barwę turkusu[6] lub niebieską, podobnie jak niebieskie tylne czy wewnętrzne części bioder, a nawet stopy; jednak mniej połyskującą, niż u L. aurea. Na grzbietowej powierzchni biodra widać kilka niedużych plam barwy żółtej. Brzuszną powierzchnię ciała opisywanego przez siebie samca Courtice określa jako żółtą, granulowaną. Kolor ten występuje również na rezonatorach samców[4].
Grzbiet ciała jest znacznie bardziej brodawkowaty, niż u blisko spokrewnionej australorzekotki złocistej[6].
Długość głowy (22,5 mm) i jej szerokość (20,0 mm) prawie się nie różnią (stosunek wynosi 1,02). Nozdrza są bardziej oddalone od oczu, niż od siebie nawzajem. Duża błona bębenkowa cechuje się średnicą stanowiącą 59% średnicy oka. Język jest wolny i szeroki. Z kolei długość głowy stanowi 37% odległości dzielącej czubek niezbyt wydatnego pyska i naturalny otwór ciała równej 60,3 mm[4].
Najdłuższym palcem kończyn przednich jest trzeci, następny pod tym względem – czwarty. Pierwszy i drugi nie różnią się długością, którą ustępują pozostałym. Na tylnych kończynach najdłuższy jest czwarty palec, a dwaj jego sąsiedzi nie różnią się długością, wyprzedzając palec drugi. Najkrótszy jest pierwszy. Opuszki palców nie przekraczają wielkością reszty palców, podobnie jak u L. flavipunctata, inaczej niż u australorzekotki złocistej. Błona pławna uległa pewnej redukcji[4].
Fizjologia
W temperaturze 23 °C osobniki dorosłe radzą sobie dobrze. Ilość zużywanego tlenu nie różni się zbytnio od ilości zaobserwowanej u Litoria ewingii. Różnicę obserwuje się natomiast w temperaturze 7 °C, gdy australorzekotka różnobarwna zapada w odrętwienie. Oznacza to mniejsze zużycie tlenu. L. ewingii cechuje się bowiem dłuższym okresem rozrodu, co musiało skutkować przystosowaniem do niskich temperatur. W 15 °C u niektórych osobników L. raniformis nie obserwowano w ogóle ruchów płuc[5].
Aureiny
W wydzielinach gruczołów tego płaza znaleziono substancje zwane aureinami. Związki te dzieli się na 5 grup oznaczanych kolejnymi cyframi. Związki z grup od 1 do 3 wykazują modyfikacje potranslacyjne w postaci grupy NH2 przyłączonej do C-terminalnej grupy karboksylowej. Dzięki fragmentom o właściwościach hydrofobowych i hydrofilowych, układających się w strukturę drugorzędową α-helisy, peptydy te mają właściwości amfipatyczne. Peptydy z grup 4 i 5 również cechują się amfipatycznością, nie posiadają jednak tak dobrze wyróżnionych fragmentów hydrofobowych i hydrofilowych. Taka budowa umożliwia tym związkom oddziaływanie z błoną biologiczną i nadaje im właściwości przeciwbakteryjne. Rozek i współpracownicy wykazali ich działanie przeciwko Bacillus cereus, Leuconostoc lactis, Listeria innocua, Micrococcus luteus, Pasteurella multocida, Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus uberis. Prócz tego aureiny zdają się wykazywać działanie przeciwnowotworowe. W obu przypadkach szerokie spektrum działania wykazują trzy pierwsze grupy aurein. Należąca do nich 1.2, licząc 13 reszt aminokwasowych, jest najmniejszych odkrytym do tej pory pochodzącym od płaza peptydem wykazującym jednocześnie działanie przeciwbakteryjne i antykancerogenne[6].
Związki te ze względu na swoje działanie nie mogą być syntetyzowane od razu w postaci aktywnej, tworzone są jako propeptydy. W tej pozbawionej aktywności biologicznej postaci mogą być przechowywane w obrębie gruczołów wydzielniczych. Odpowiedni bodziec sprawia, że endoproteaza hydrolizuje odpowiednie wiązanie, przekształcając propeptyd w postać aktywną. W podobny sposób odbywa się degradacja tych aktywnych związków. W przypadku 2.1, 2.4 oraz 3.3 polega ona na odcięciu dwóch pierwszych reszt aminokwasowych, natomiast 3.1 wykazuje 2 różne produkty rozpadu, pozbawione dwóch pierwszych albo trzech ostatnich reszt aminoacylowych[6].
Poniższa tabela prezentuje aureiny znalezione przez Rozeka i współpracowników[6].
| Aureina | Masa cząsteczkowa | Struktura |
|---|---|---|
| 1.1 | 1444 | GLFDIIKKIAESI-NH2 |
| 1.2 | 1478 | GLFDIIKKIAESF-NH2 |
| 2.1 | 14613 | GLLDIVKKVVGAFGSL-NH2 |
| 2.1.1 | 1443 | LDIVKKVVGAFGSL-NH2 |
| 2.5 | 1647 | GLFDIVKKVVGAFGSL-NH2 |
| 2.6 | 1627 | GLFDIAKKVIGVIGSL-NH2 |
| 3.1 | 1736 | GLFDIVKKIAGHIAGSI-NH2 |
| 3.1.1 | 1480 | GLFDIVKKIAGHIA-OH |
| 3.1.2 | 1566 | FDIVKKIAGHIAGSI-NH2 |
| 3.2 | 1766 | GLFDIVKKIAGHIASSI-NH2 |
| 3.3 | 1794 | GLFDIVKKIAGHIVSSI-NH2 |
| 3.3.1 | 1624 | GLFDIVKKIAGHIVSSI-NH2 |
| 4.2 | 240 | GLLQTIKEKLKEFAGGVVTGVQS-OH |
| 4.4 | 2424 | GLLQTIKEKLKELATGLVIGVQS-OH> |
| 5.1 | 2544 | GLLDIVTGLLGNLIVDVLKPKTPAS-OH |
| 5.2 | 2450 | GLMSSIGKALGGLIVDVLKPKTPAS-OH |
Tryb życia
Litoria raniformis wykazuje dużą zależność od środowiska wodnego. Płazy te chłodną porę roku spędzają zahibernowane, zagrzebane w mule na dnie zbiornika wodnego lub też w kryjówkach pod kamieniami czy kłodami drewna. Istnieją jednak doniesienia o wybudzaniu się podczas łagodniejszych okresów[5].
Cykl życiowy
Rozród odbywa się w stawach stałych i bagnach[3]. Badania z Canterbury wykazały, że rozród przypada na wiosnę i lato[5]. Jednakże Hero, Littlejohn i Marantelli donoszą, że samce nawołują od sierpnia do kwietnia[3]. Badania prowadzone przez Cree w Nowej Zelandii wskazują jednakże na okres kumkania od grudnia do lutego[5]. Samce kumkają zarówno w dzień, jak i w nocy, częściej jednak w nocy. Samce kumkające w dzień, w słoneczne popołudnie, odnotowano w sierpniu i wrześniu 1982. Znajdowały się one pośród roślinności takiej, jak paprocie i jagody. Zwyczajne nocne kumkania odbywają się jednak w zbiorniku wodnym. Temperatura wody, w której przebywają płazy, mieści się w granicach od 12 do 16 °C, także przy opadach śniegu[5].
Kłęb skrzeku składanego przez samicę jest dość luźny. Znajduje się w nim około 1700 jaj. Z jaja wylęga się wolno pływająca larwa zwana kijanką[3]. W temperaturze około 23 °C rozwój przebiega dobrze, kijanki żyją w tej postaci ponad 70 dni, a szesnastodniowa umieralność oceniana jest na 5%; w 15 °C notuje się już wysoką śmiertelność 80%, a umieszczone w takim środowisku larwy nie pobierają pożywienia ani nie pływają. Jednakże w obu temperaturach obserwowano udane przeobrażenia. Od złożenia jaj do zakończenia metamorfozy mija 90 dni. Kijanki niemające jeszcze kończyn obserwowano w Nowej Zelandii od grudnia do marca, z wykształconymi już kończynami od stycznia do kwietnia[5].
Późnym latem lub jesienią kijanki przystępują do przeobrażenia lub też, jak opisują Gillespie, Osborne i McElhinney, zimują w postaci larwalnej, przechodząc metamorfozę dopiero w następnym sezonie[3]. Podczas metamorfozy głowa i tułów podlegają niewielkim zmianom. Resorbowany jest ogon. Kijanka osiąga maksymalnie 77 mm, po niej natomiast odległość od pyska do kloaki wynosi od 25 do 29 mm. Młode żabki w Nowej Zelandii obserwowano od stycznia do kwietnia[5].
Pomimo sympatrycznego występowania z australorzekotką złocistą nie odnotowano hybrydogenezy[4].
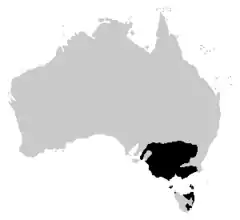
Rozmieszczenie geograficzne
Zwierzę zamieszkuje południowo-wschodnią Australię, w tym Tasmanię. W Nowej Południowej Walii i w Australijskim Terytorium Stołecznym zasięg ten skupia się w dolinach rzek Murray oraz Murrumbidgee i ich dorzeczach[3], płaz występuje więc na południu stanu[6]. W obrębie Wiktorii rzekotka występuje prawie w całym stanie, pomijając jedynie regiony położone najbardziej na wschodzie i na zachodzie stanu, z uwagi na panujące tam warunki pustynne lub górskie[3]. W Australii Południowej L. raniformis spotykana jest również na południu stanu[6], IUCN wymienia tutaj dolinę położoną w dolnym biegu rzeki Murray i południowy wschód w okolicach Keith. Na Tasmanii bezogonowy zamieszkuje północ i wschód wyspy[3] (Rozek i współpracownicy wymieniają jedynie północ[6]). Oprócz tego zwierzę zamieszkuje wyspę Bass Strait, gdzie Brook zauważył je i udokumentował jego obecność w 1979. Na południu stanu płaz występuje w rozproszeniu[3].
Płaza introdukowano w Adelaide Hills w stanie Australia Południowa, ale zamieszkująca je populacja jest niewielka. Poza kontynentem australijskim[3] ponad 130 lat temu[5] został wprowadzony na Nową Zelandię. Odnotowuje się go zarówno na Wyspie Północnej, jak i na Południowej, a z mniejszych wysp na Wyspach Stuarta i Great Barrier[3].
Strefy sympatrycznego występowania z australorzekotką złocistą występują w okolicy Canberry oraz na wybrzeżu Gippsland w Wiktorii. Oba gatunki spotykano w tych samych zbiornikach wodnych[4].
Ekologia
Płaz bytuje na wysokości od poziomu morza do 1300 m[3]. Jako siedlisko Rozek wymienia duże stawy[6]. IUCN natomiast mówi tutaj o okolicach tam, stawów, bagien. Australorzekotka różnobarwna zdaje się preferować zbiorniki wodne istniejące stale, aczkolwiek spotyka się ją również w istniejących tylko okresowo. Jako preferowaną roślinność wymienia się turzyce i rośliny wiodące częściowo wodny tryb życia. Zwierzę ukrywa się także pod pniami i skałami[3].
Zbiornik zajęty przez rzekotki może otaczać zarówno las, jak i pastwisko[3]. Spotyka się ją na trawiastych brzegach, w przeciwieństwie do preferującej poza tym podobne siedliska i częściowo sympatrycznej australorzekotki złocistej[4].
Zagrożenia i ochrona
Australorzekotka różnobarwna należała niegdyś do płazów występujących pospolicie, jednakże w 1999 Mahony opisał spadek liczebności w części zasięgu. Wymienia się nawet obszary, na których zniknął całkowicie. Zaliczają się tutaj wzgórza w środkowej i południowej Nowej Południowej Walii, jak podaje IUCN za Ehmannem i White’em (1997), jak również pewne okolice leżące nad rzeką Murrumbidgee, o czym donosi również Mahony. Zupełnie inaczej sytuacja ta wygląda nad rzeką Murray, gdzie płaz występuje powszechnie. IUCN podaje również brak współczesnych doniesień z powiatu Monaro. W Wiktorii, w Gippsland populacje są pofragmentowane, jednakże kilka z nich zamieszkuje okolice stolicy tego stanu, Melbourne. Podobnie wygląda sytuacja na Tasmanii, w środkowej części wyspy płaz prawie wyginął[3].
Na Nowej Zelandii, gdzie płaz pojawił się w związku z działalnością człowieka, żyją dziś tysiące osobników, pomimo szerzącej się epizoocji chytridiomycosis oraz ryb z rodzaju Gambusia, które to czynniki odpowiadają za lokalne spadki liczebności australorzekotki. Na wyspach tych niekorzystny wpływ wywiera także osuszanie terenów podmokłych. Grzybica, pierwszy raz wykryta u tego gatunku właśnie na obszarze Nowej Zelandii (Christchurch), wiąże się ze spadkiem liczebności płazów także w kontynentalnej części Australii, m.in. w Australii Południowej (góra Compass). Niestety płaz prawdopodobnie przeniósł chytridioidomycosis na rodzime gatunki nowozelandzkie. Prócz grzyba wśród zagrożeń dla gatunku wymienia się również infekcje wirusowe[3].
Obecnie całkowita liczebność gatunku obniża się[3].
IUCN objęło australorzekotkę różnobarwną w 1994, nie przyznano jej jednak odpowiedniego statusu wskazującego na stopień zagrożenia, lecz umieszczono wśród gatunków niewystarczająco dobrze poznanych dla takiej klasyfikacji (Issuficiently Known). Dwa lata później zaliczono zwierzę do gatunków zagrożonych wyginięciem (Endangered). W 2006 potwierdzono ten status. Nowa Zelandia przyznaje jej status Vulnerable[3].
Monitoring prowadzi Werribee Open Range Zoo. Rozród w niewoli odbywa się w parku zoologicznym w Melbourne[3].
Przypisy
- ↑ Ranoidea raniformis, [w:] Integrated Taxonomic Information System (ang.).
- ↑ Darrel Frost: Litoria raniformis (Keferstein, 1867). Amerykańskie Muzeum Historii Naturalnej, 2010. [dostęp 2012-09-22]. (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 J. Hero i inni, Litoria raniformis, [w:] The IUCN Red List of Threatened Species [dostęp 2020-01-31] (ang.).
- 1 2 3 4 5 6 7 8 9 10 11 Gillian P Courtice, Gordon C Grigg. A taxonomic revision of the Litoria aurea complex (Anura: Hylidae) in south-eastern Australia. „Australian zoologist”. 18, s. 149-163, 1975-08-01. (ang.).
- 1 2 3 4 5 6 7 8 9 Alison Cree. Breeding biology, respiration, and larval development of two introduced frogs (Litoria raniformis) and (L. ewingi). „New Zealand Journal of Zoology”. 11, s. 179-187, 1984. DOI: 10.1080/03014223.1984.10423756. (ang.).
- 1 2 3 4 5 6 7 8 9 10 Tomas Rozek, Kate L. Wegener, John H. Bowie, Ian N. Olver, John A. Carver, John C. Wallace & Michael J. Tyler. The antibiotic and anticancer active aurein peptides from the Australian Bell Frogs Litoria aurea and Litoria raniformis. „European Journal of Biochemistry”. 267, s. 5330–5341, 2000 09. DOI: 10.1046/j.1432-1327.2000.01536.x. (ang.).