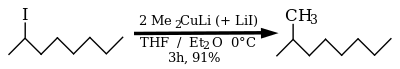| ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C9H20 | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
128,26 g/mol | |||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna ciecz[1] | |||||||||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||||||||
| Numer CAS | ||||||||||||||||||||||||||||||||||
| PubChem | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||||||||
2-Metylooktan, C
9H
20 – organiczny związek chemiczny z grupy alkanów, jeden z izomerów konstytucyjnych nonanu. Występuje w napojach alkoholowych. Jest jednym z głównych składników olejku z dziurawca zwyczajnego[7]. Związek ten występuje również w ropie naftowej, z której w postaci czystej wydzielono go w 1937 roku[4].
Otrzymywanie
2-Metylooktan został otrzymany w 1913 roku przez Ernsta Spätha w trakcie jego badań nad reakcjami związków Grignarda z halogenkami alkilowymi w roztworze eteru dietylowego[8]. Można go również otrzymać poprzez dehydratację 2-metylo-2-oktanolu, który powstaje w wyniku reakcji 2-heptanonu z bromkiem metylomagnezu[5]:
- O=C(CH
3)((CH
2)
5CH
3) + CH
3MgBr → (CH
3)
2C(OH)CH
2CH
2CH
2CH
2CH
2CH
3 - (CH
3)
2C(OH)CH
2CH
2CH
2CH
2CH
2CH
3 → (CH
3)
2C=CHCH
2CH
2CH
2CH
2CH
3 + H
2O
W kolejnym etapie otrzymaną olefinę uwodornia się z użyciem wodoru w chwili powstania (otrzymanego np. w reakcji pyłu cynkowego z suchym chlorowodorem)[5] lub za pomocą wodoru cząsteczkowego wobec niklu Raneya na aktywowanym tlenku glinu w charakterze katalizatora oraz wobec podwyższonego ciśnienia[3]:
- (CH
3)
2C=CHCH
2CH
2CH
2CH
2CH
3 + H
2 → (CH
3)
2CHCH
2CH
2CH
2CH
2CH
2CH
3
Wydzielenie 2-metylooktanu z ropy naftowej jest dość złożone. W 1937 roku wykorzystano do tego frakcję wrzącą w zakresie 140–145 °C, otrzymaną z ropy naftowej pochodzącej z pól naftowych w Oklahomie. W pierwszym etapie wyekstrahowano z niej ksyleny (głównie o-ksylen) za pomocą ciekłego SO
2. Po tej procedurze frakcja ta zawierała co najmniej 2 węglowodory naftenowe o 9 atomach węgla, 4 łańcuchowe izomery nonanu oraz niewielką zawartość węglowodorów aromatycznych. Frakcję tą rozdestylowano pod ciśnieniem 215 Tr za pomocą kolumny rektyfikacyjnej wyposażonej w 30 półek dzwonowych. Frakcje zebrane w zakresie temperatury 100,5–103,5 °C (co odpowiada frakcji wrzącej w zakresie 142,5–145,5 °C pod ciśnieniem normalnym) zawierały wciąż około 2% molowych węglowodorów aromatycznych, więc przefiltrowano je przez złoże żelu krzemionkowego, a następnie poddano destylacji z lodowatym kwasem octowym w celu przeprowadzenia naftenów w wyżej wrzące pochodne octanowe. W kolejnym etapie uzyskany destylat poddano rektyfikacji za pomocą kolumny posiadającej 60 półek teoretycznych stosując ponownie ciśnienie 215 Tr, zbierając pojedyncze frakcje co 0,2 °C. Bogate w 2-metylooktan były frakcje wrzące w zakresie 100,8–102 °C. Poddano je krystalizacji z dichlorodifluorometanu, produkt przefiltrowano przez złoże żelu krzemionkowego w celu usunięcia śladów rozpuszczalnika. Uzyskane 250 cm³ produktu rozdestylowano na 20 frakcji. Wszystkie otrzymane frakcje wrzały w temperaturze 143,35 °C, jednak pierwsza i trzy ostatnie miały nieco wyższy współczynnik załamania światła. Środkowe 100 cm³ uznano za najlepszy wzorzec 2-metylooktanu pochodzącego z ropy[4].
Ropa naftowa jako źródło 2-metylooktanu jest łatwo dostępna, jednak procedura wydzielania jest złożona, dlatego poszukiwano innych dróg syntezy z łatwo dostępnych surowców. Wykorzystano do tego celu 2-oktanol, który po przeprowadzeniu w 2-jodooktan pozwala na otrzymanie 2-metylooktanu w reakcji z odczynnikiem Gilmana[9].
Właściwości
2-Metylooktan jest bezbarwną cieczą[1] nierozpuszczalną w wodzie, słabo rozpuszczalną w tetrachlorku węgla, rozpuszczalną w etanolu i eterze dietylowym oraz bardzo dobrze rozpuszczalną w eterze naftowym[2]. Wartość jego stałej dielektrycznej względem powietrza w 20 °C wynosi 1,967[10]. Gęstości względne 2-metylooktanu wynoszą: 0,7134 (w 20 °C)[uwaga 4]; 0,7132 (w 20 °C)[uwaga 5][5]; 0,7107 (w 20,1 °C)[uwaga 5][3].
Uwagi
- ↑ Nazwa izononan bywa stosowana również w odniesieniu do innych rozgałęzionych izomerów nonanu, np. 3-metylooktanu bądź 4-metylooktanu.
- 1 2 Wartości wyznaczone niezależnie od autorów przez amerykańskie National Bureau of Standards, autorzy podali temperaturę topnienia −80 °C oraz współczynnik załamania światła 1,40285.
- ↑ Wartość wyznaczona przez E.R. Smitha z National Bureau of Standards, autorzy podali 142,8 °C.
- ↑ Wartość wyznaczona względem gęstości wody o temperaturze 4 °C przez Wydział Wag i Miar Narodowego Biura Standardów USA, autorzy podali 0,7107 w 20 °C.
- 1 2 Wartość wyznaczona względem gęstości wody o temperaturze 4 °C.
Przypisy
- 1 2 3 4 5 2-Methyloctane (nr 68170) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2016-06-27]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- 1 2 3 4 5 6 7 8 9 10 CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, s. 3-384, 6-68, ISBN 978-1-4822-0867-2 (ang.).
- 1 2 3 4 5 6 7 8 Frank C. Whitmore, H. Philip Orem. A New Synthesis of Tertiary Hydrocarbons. „Journal of the American Chemical Society”. 60 (11), s. 2573–2574, 1938. DOI: 10.1021/ja01278a004.
- 1 2 3 4 5
 Joseph D. White, Augustus R. Glasgow. Separation of three methyloctanes from midcontinent petroleum. „Journal of the Research of the National Bureau of Standards”. 19, s. 423–435, 1937. [dostęp 2016-07-08].
Joseph D. White, Augustus R. Glasgow. Separation of three methyloctanes from midcontinent petroleum. „Journal of the Research of the National Bureau of Standards”. 19, s. 423–435, 1937. [dostęp 2016-07-08]. - 1 2 3 4 5 Frank C. Whitmore, Harriet A. Southgate. The Nonanes. 2-Methyloctane, 3-Ethylheptane, 2,3-Dimethylheptane and 2,2,4,4-Tetramethylpentane. „Journal of the American Chemical Society”. 60 (11), s. 2571–2573, 1938. DOI: 10.1021/ja01278a003.
- ↑ 2-Methyloctane (nr 68170) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2016-06-27]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Isononane, [w:] Human Metabolome Database, Genome Canada, HMDB31556 [dostęp 2016-06-27] (ang.).
- ↑ Ernst Späth. Über die Einwirkung von Halogenalkylen auf Alkylmagnesiumhaloide. „Monatshefte für Chemie”. 34 (10), s. 1965–2014, 1913. DOI: 10.1007/BF01518988. (niem.).
- ↑ Bruce H. Lipshutz, Joseph A. Kozlowski, Curt M. Breneman. Chemical and spectroscopic studies on copper iodide derived organocuprates: new insight into the composition of Gilman’s reagent. „Journal of the American Chemical Society”. 107 (11), s. 3197–3204, 1985. DOI: 10.1021/ja00297a027.
- ↑ T.W. Richards, J.W. Shipley. The dielectric constants of typical aliphatic and aromatic hydrocarbons, cyclohexane, cyclohexanone, and cyclohexanol. „Journal of the American Chemical Society”. 41 (12), s. 2002–2012, 1919. DOI: 10.1021/ja02233a017.