Wykresy adsorpcji par i gazów – graficzne ilustracje stanu równowagi procesu adsorpcji składnika cieczy lub gazu na powierzchni stałego adsorbentu. Wykresy dotyczą zwykle równowagi w stałej temperaturze (izotermy). Przedstawiana jest zależność ilości związku zaadsorbowanego na powierzchni adsorbentu od stężenia tego związku w roztworze albo od jego ciśnienia cząstkowego w gazie.
Według Brunauera izotermy adsorpcji par i gazów można podzielić na pięć zasadniczych typów. Krzywa typu I charakteryzuje adsorpcję chemiczną (chemisorpcję), krzywe typu II, III, IV i V – adsorpcję fizyczną. Na ogół chemisorpcji odpowiada początkowo stromy przebieg krzywej, która następnie ulega stopniowo spłaszczeniu. Przyjmuje się, że stromy odcinek krzywej odpowiada silnej tendencji powierzchni do wiązania cząsteczek gazowych, a płaska część krzywej – wysyceniu sił wiążących powierzchni. Adsorpcji fizycznej odpowiadają izotermy wykazujące rosnące nachylenie dodatnie przy wzroście ciśnienia gazu. Każdy kolejny przyrost względnego ciśnienia gazu powoduje większy przyrost ilości zaadsorbowanego gazu, aż do granicznej wartości ciśnienia równej prężności pary substancji adsorbowanej; przy tym ciśnieniu następuje kondensacja i izoterma adsorpcji przebiega pionowo w górę.
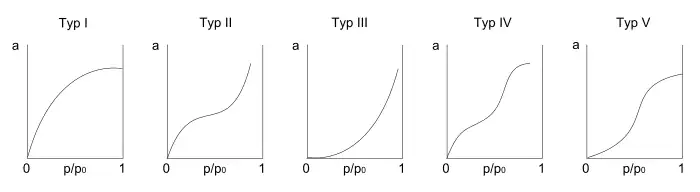
Oznaczenia: a - ilość zaadsorbowanej substancji na jednostkę masy sorbentu (adsorpcja); po - ciśnienie pary nasyconej; p - ciśnienie
Typ I
Typ I odpowiada izotermie Langmuira. Przebieg izotermy odzwierciedla podstawowe założenie teorii Langmuira, iż powierzchnia adsorbentu posiada określoną liczbę miejsc aktywnych (zwanych centrami aktywnymi), a na jednym miejscu aktywnym może zaadsorbować się tylko jedna cząsteczka adsorbatu. Wielkość adsorpcji początkowo rośnie proporcjonalnie do ciśnienia, następnie wzrost ten stopniowo maleje i adsorpcja osiąga stałą wielkość. Wszystkie miejsca aktywne zostają zajęte i tworzy się monowarstwa (warstwa monomolekularna). Większa ilość cząstek adsorbatu nie może zostać zaadsorbowana na powierzchni adsorbentu.
Typ II
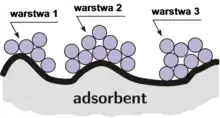
Jest bardzo rozpowszechniony w adsorpcji fizycznej. Wiąże się z powstaniem wielomolekularnej warstwy. Został opracowany zgodnie z założeniem teorii Brunauera, Emmetta i Tellera (w skrócie BET – izoterma BET). Zgodnie z tą teorią, cząstka adsorbatu trafiając na zajęte miejsce nie opuszcza go od razu. Powstaje krótkotrwały kompleks adsorpcyjny. Wzrost ciśnienia powoduje zmniejszanie liczby miejsc aktywnych zajętych przez jedną cząsteczkę adsorbatu, ponieważ tworzą się podwójne, potrójne kompleksy adsorpcyjne.
Typ III
Jest stosunkowo rzadki. Izoterma odpowiada przypadkom, gdy oddziaływanie cząstek adsorbatu z adsorbentem jest dużo mniejsze niż międzycząsteczkowe oddziaływanie cząsteczek adsorbatu np. wywołane pojawieniem się wiązań wodorowych.
Typ IV i Typ V
Izotermy typów IV i V odpowiadają krzywym typu II i III. Różnią się od nich tym, że na pewnym odcinku biegną równolegle do osi ciśnień. Przyczyną tego jest powstawanie w porach adsorbentu tylko ograniczonej liczby warstw adsorpcyjnych ze względu na szerokość porów.
Histereza adsorpcji
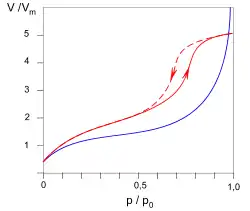
Histereza adsorpcji dotyczy izoterm adsorpcji zachodzącej na materiałach porowatych. Histerezę charakteryzuje inny przebieg izotermy adsorpcji (przy podwyższaniu ciśnienia adsorbatu) niż izotermy desorpcji (przy obniżaniu ciśnienia). Linia niebieska na wykresie obok obrazuje proces adsorpcji fizycznej zachodzącej na materiale nieporowatym. Linia czerwona ilustruje proces adsorpcji fizycznej zachodzącej na materiale porowatym. Czerwona linia przerywana ilustruje proces desorpcji.
Bibliografia
- Adsorpcja na granicy faz ciało stałe-gaz. W: J. Ościk: Adsorpcja. Warszawa: PWN, 1973. ISBN 83-01-00554-8.
- Zjawiska powierzchniowe.Adsorpcja. W: S Bursa: Chemia fizyczna. Wyd. drugie. Warszawa: PWN, 1979, s. 538-550. ISBN 83-01-00152-6.
- A Bielański: Zjawiska powierzchniowe. W: Chemia fizyczna. Warszawa: PWN, 1980, s. 710-718.
- Procesy zachodzące na powierzchni ciał stałych. W: P.W. Atkins: Chemia fizyczna. Warszawa: PWN, 2001, s. 826-832. ISBN 83-01-13502-6.