Węglany – grupa związków chemicznych, soli i estrów kwasu węglowego.
Sole
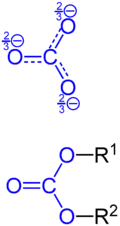
Sole zawierają anion węglanowy CO2−
3. Znane są też wodorowęglany, zawierające anion HCO−
3. Węglany są dość rozpowszechnione w przyrodzie, odgrywają również dużą rolę w gospodarce, np. w przemyśle chemicznym czy w budownictwie. Sole te, prócz węglanów metali alkalicznych, są słabo rozpuszczalne w wodzie. Silne kwasy wypierają z nich resztę węglanową, która w roztworach wodnych szybko ulega przemianie do gazowego dwutlenku węgla (CO
2).
Ważniejsze węglany występujące w przyrodzie:
- węglan magnezu (MgCO
3) - węglan sodu (Na
2CO
3, soda) – znajduje zastosowania w życiu człowieka: produkcja szkła, produkcja proszków do prania, zmiękczanie wody - węglan wapnia (CaCO
3, wapień, marmur, kreda) – otrzymuje się z niego m.in. szkło, cement i kredę szkolną. Używa się go także przy produkcji papieru oraz do odtleniania żelaza w procesach hutniczych. - węglan litu (Li
2CO
3) – stosowany w leczeniu zaburzeń afektywnych dwubiegunowych. - węglan potasu (K
2CO
3) – główny składnik potażu
Estry
Estry kwasu węglowego można podzielić na monoestry i diestry. Monoestry kwasu węglowego są nietrwałe i mogą być izolowane jedynie w formie soli, np. potasowych lub sodowych typu ROC(=O)O−
M+
, które są ciałami stałymi o wysokich temperaturach topnienia. Natomiast w formie kwasowej typu ROC(=O)OH, monoestry ulegają spontanicznemu rozkładowi do alkoholi i CO
2. Diestry (R1
OC(=O)OR2
), np. węglan dimetylu lub węglan difenylu są stabilne[1].
Zobacz też
Przypisy
- ↑ Abbas-Alli G. Shaikh, Swaminathan Sivaram, Organic Carbonates, „Chemical Reviews”, 96 (3), 1996, s. 951–976, DOI: 10.1021/cr950067i, PMID: 11848777.